中等强度他汀类药物治疗不同ApoE基因组型ACS合并糖尿病的临床疗效观察
2020-05-26璐1赵红丽张晓丹
高 璐1,李 潞,赵红丽,张晓丹,于 淼
急性冠脉综合征(ACS)合并糖尿病是临床极高危疾病,如何有效降低风险,减少主要心血管事件的发生是研究的热点问题。降脂治疗在冠心病一级预防和二级预防中的核心作用明显,《2016年中国成人血脂异常防治指南》[1]指出:针对合并糖尿病人群,首选他汀类调脂药物,起始应用中等强度。载脂蛋白E(ApoE)基因作为影响他汀类药物药效动力学重要基因,具有基因多态性,不同基因型导致药物作用疗效的差异。本研究观察中等强度他汀类药物治疗不同ApoE基因组型ACS合并糖尿病的临床疗效,现报道如下。
1 资料与方法
1.1 研究对象 随机选取2016年9月—2018年6月沈阳医学院附属第二医院收治的ACS合并糖尿病病人103例。纳入标准:符合《中国2型糖尿病防治指南(2017年版)》《2016非ST段抬高型急性冠状动脉综合征指南》《2017ESC ST段抬高型心肌梗死指南》关于ACS及糖尿病诊断;所有病人均签署知情同意书,并遵医嘱规律服用中等强度他汀类药物6个月,阿托伐他汀钙片(辉瑞制药有限公司生产,国药准字:H20051408)20 mg每晚1次,睡前口服,或瑞舒伐他汀钙片[阿斯利康药业(中国)有限公司生产,国药准字:J20170008]10 mg每晚1次,睡前口服。排除标准:合并严重肝、肾功能障碍(转氨酶超过正常值3倍以上,血清肌酐>451 μmol/L);病理活检确诊为恶性肿瘤;未规律服用他汀类药物,应用他汀类药物治疗6个月后未复查血脂。
1.2 研究方法 抽取所有病人空腹静脉血200 μL置于乙二酸四乙胺(EDTA)抗凝管内,使用血液基因组DNA提取试剂盒进行血液DNA提取,人类SLCO1B1和ApoE基因检测试剂盒(购自武汉友芝友医疗科技股份有限公司)进行基因扩增,并录入病人性别、年龄、体质指数(BMI)、高血压病史、糖化血红蛋白(HbA1c),服用药物前后测定血脂,包括三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)。
1.3 实验操作
1.3.1 DNA提取 将采集200 μL血液样品置于EP管中,加入200 μL缓冲液GB及20 μL蛋白酶K,充分混匀,56 ℃放置10 min,混匀数次。室温放置2~5 min,冷却后加入350 μL缓冲液BD,充分混匀。将所得溶液及沉淀加入已安装收集管的吸附柱内,12 000 r/min离心30 s,倒掉收集管中废液。加入500 μL缓冲液GDB,12 000 r/min离心30 s,倒掉收集管中废液。加入600 μL漂洗液PWB,12 000 r/min离心30 s,倒掉收集管中废液。再次加入600 μL漂洗液PWB,12000 r/min离心30 s,倒掉收集管中废液。12 000 r/min离心2 min,倒掉废液,室温放置吸附柱2 min后,将其放置于新的EP管中。向吸附柱内吸附膜中间位置,悬空滴加80 μL洗脱缓冲液TB,室温放置2 min,12 000 r/min离心2 min,EP管中所得溶液即为提取到的DNA。
1.3.2 PCR扩增 取23 μL的ApoE2反应液,ApoE4反应液置于反应管中,分别加入2 μL待测样本提取的DNA、弱阳性对照、空白对照,制成总体积为25 μL反应管。将反应管置于低速离心机中离心30 s,放入实时荧光定量PCR仪器样品槽中,记录放置顺序。应用全自动医用PCR分析系统进行基因扩增,扩增条件为:37 ℃ 10 min,1个循环;95 ℃ 5 min,1个循环;95 ℃ 15 s,40个循环;60 ℃ 60 s,40个循环。荧光通道FAM收集野生型荧光信号,荧光通道VIC收集突变型荧光信号,而荧光通道ROX作为内标荧光信号,根据扩增曲线读取基因类型。
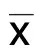
2 结 果
2.1 基因型分布 本研究共收集ACS合并糖尿病病人103例,年龄35~90岁,男56例,女47例。103例病人共表达4种基因型:ApoE2/E3占9.7%,ApoE3/E3占68.0%,ApoE3/E4占20.4%,ApoE4/E4占1.9%;3种基因组型:E2型占9.7%,E3型占68.0%,E4型占22.3%。
2.2 不同基因组型ACS合并糖尿病病人临床资料比较(见表1)
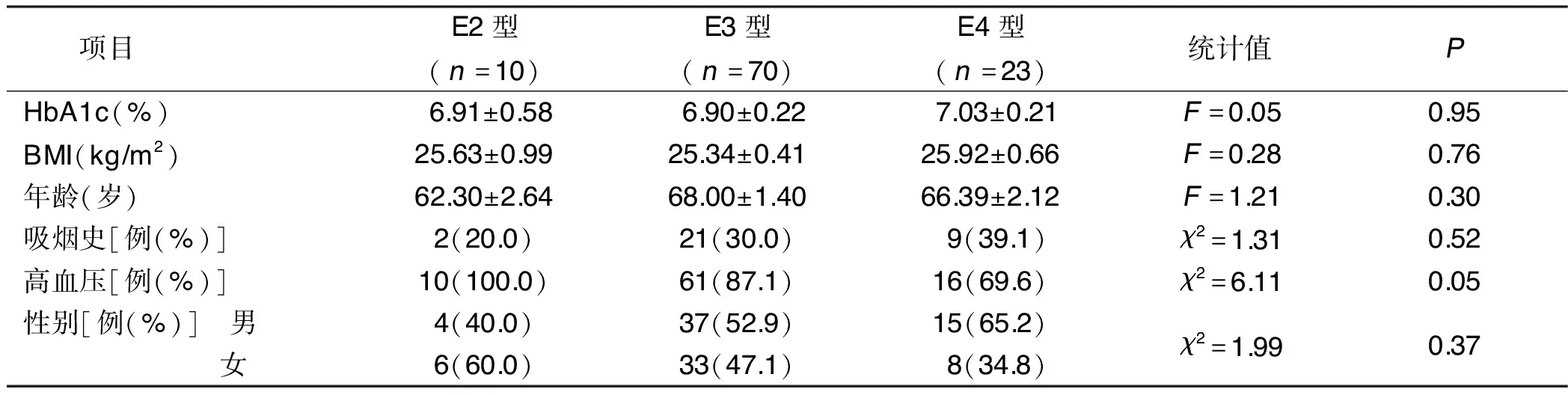
表1 不同基因组型ACS合并糖尿病病人临床资料比较
2.3 中等强度他汀类药物治疗前后血脂变化情况(见表2)

表2 中等强度他汀类药物治疗前后血脂变化情况(±s) 单位:mmol/L
2.4 中等强度他汀类药物治疗不同基因组型ACS合并糖尿病血脂疗效比较 治疗后,E2型与E3型、E2型与E4型降低TG方面,差异有统计学意义(P<0.05);E2型与E3型、E2型与E4型降低TC方面,差异有统计学意义(P<0.05);E2型与E4型降低LDL-C方面,差异有统计学意义(P<0.05)。详见表3。

表3 中等强度他汀类药物治疗不同基因组型ACS合并糖尿病血脂疗效比较
3 讨 论
他汀类药物,即羟甲基戊二酰辅酶A(hydroxymethyl-glutaryl coenzyme A,HMG-CoA)还原酶抑制剂,可竞争性抑制HMG-CoA还原酶活性,阻碍胆固醇合成,代偿性增加LDL-C受体合成,使血浆大量LDL-C被摄取,降低血浆LDL-C水平,抑制极低密度脂蛋白胆固醇(VLDL-C)合成,降低血浆TG水平,可轻度增加HDL-C水平,是临床常见且使用广泛的降脂药物。既往文献表明,他汀类药物不仅能降低血脂,还具有改善血管内皮功能、抗炎及抗氧化作用,抗血小板聚集和抑制血栓形成、稳定粥样硬化斑块、抑制平滑肌细胞增殖及迁移等,在冠心病、缺血性脑卒中、糖尿病血管病、心律失常、阿尔茨海默病、高血压等心脏血管疾病中发挥重要作用[2]。
尽管他汀类药物作用强大,但其降脂作用存在较大的个体差异,即使调整他汀类药物剂量,仍有部分病人达不到预期效果。有研究显示,这种差异除受病人年龄、性别、肝肾功能和药物相互作用等因素影响,还与参与药物代谢酶、转运蛋白及药物靶受体等基因多态性密切相关[3]。既往文献表明,遗传因素可解释40%~60%最终胆固醇水平和约70%他汀类药物治疗效果,他汀类疗效研究中,常见的基因是ApoE基因[4]。
ApoE基因定位于19号染色体上[5],所编码的载脂蛋白通过多种途径参与机体脂质代谢调节,是影响机体血脂水平的重要内在因素。ApoE同样具有基因多态性,可形成3种单倍体[6],分别为:ApoE2、ApoE3、ApoE4。其中,携带E2等位基因病人应用他汀类药物治疗后降脂效果好,而携带E4等位基因病人降脂效果较差[7]。既往研究显示,ApoE3/E3型病人经阿托伐他汀治疗后血脂下降水平高于ApoE3/E4型[8]。根据基因突变情况分为3种基因组型:E2型(ApoE2/E2、ApoE2/E3)、E3型(ApoE2/E4、ApoE3/E3),E4型(ApoE3/E4、ApoE4/E4),本研究基于此,分析不同ApoE基因组型ACS合并糖尿病病人降脂效果差异。
本研究共纳入103例ACS合并糖尿病病人,表达4种基因型,以ApoE3/E3为主,E3基因频率为83.05%,E2基因频率为4.85%、E4基因频率为12.1%,与既往研究结果[6]相似。中等强度他汀类治疗6个月后,TG、TC、LDL-C水平均下降,但HDL-C未见明显变化,可能与本研究样本量有限,随访时间短有关。通过对不同ApoE基因组型病人中等强度他汀药物疗效比较发现,ApoE2型相较于ApoE4型,降低TG、TC、LDL-C方面效果显著;ApoE2型相较于ApoE3型,降低TG、TC方面效果显著。即携带E2型基因降低TG、TC、LDL-C方面更具优势。
综上所述,ACS合并糖尿病应用中等强度他汀药物治疗后,可降低病人TG、TC及LDL-C水平,但不同ApoE基因组型间他汀类药物治疗效果差异,针对携带E4基因人群,可增加他汀类用药剂量或合并应用其他降脂药物,以达到目标血脂水平。
