富血小板血浆宫腔灌注对反复种植失败妇女妊娠结局的影响
2020-05-25刘科鹏李丽斐成慧刘媛张学红
刘科鹏,李丽斐,成慧,刘媛,张学红*
(1.兰州大学第一医院生殖专科医院,兰州 730000;2.西北民族大学附属医院,兰州 730000)
体外受精-胚胎移植(IVF-ET)成功的关键是优质的胚胎和子宫内膜同步化发育以及两者之间的协调配合。尽管近年来辅助生殖技术有了很大发展,但反复种植失败(RIF)仍然是患者和临床医生共同面临的难题。很多患者经历多次助孕失败,导致很大的精神和经济负担。Thornhill等[1]将RIF定义为至少连续3次IVF周期植入失败,其中每个周期移植1~2枚高质量的胚胎或多次移植胚胎数量共计≥10枚仍未获得临床妊娠。IVF-ET过程中,反复种植失败的发生率为7.7%~11.1%,植入失败与母亲因素及胚胎因素有关,母亲因素包括子宫解剖异常、血栓形成、降低的子宫内膜容受性和免疫因素;胚胎因素与遗传异常或胚胎固有的其他因素有关[2]。其中由于子宫内膜容受性下降导致的植入失败占到总数的2/3[3]。因此,采取有效措施改善子宫内膜容受性成为RIF研究的热点。通过患者全血离心获得的血浆血小板浓缩物称为富血小板血浆(Platelet-rich plasma,PRP),2015年,Chang等[4]首先描述了子宫腔内灌注PRP可以治疗薄型子宫内膜。Zadehmodarres等[5]也描述了PRP促进子宫内膜发育的有效性。本研究通过回顾性分析,探讨使用宫腔内灌注PRP能否提高反复种植失败妇女子宫内膜容受性进而提高再次IVF-ET后的临床妊娠率。
一、资料与方法
1.研究对象:选择2018年2月至2019年1月于兰州大学第一医院生殖专科医院就诊的RIF妇女,再次IVF-ET治疗前接受过PRP灌注的患者;另取同期未经PRP灌注的匹配RIF患者为对照组。纳入标准:(1)年龄≤40岁;(2)有连续3次及以上胚胎种植失败史;(3)不孕因素主要包括盆腔输卵管因素、排卵障碍、男方因素;(4)宫腔镜检查,子宫形态正常;(5)卵巢功能正常[血清FSH、LH、抗苗勒氏管激素(AMH)水平均处于正常范围],自然排卵周期或使用促性腺激素刺激卵泡发育周期中,至少有1个卵泡发育至直径≥18 mm。排除标准:(1)既往有雌激素相关性肿瘤病史;(2)宫腔镜检查显示宫腔形态异常、宫腔粘连、内膜息肉、黏膜下子宫肌瘤等;(3)内膜异常增生、内膜结核及内膜炎等内膜病变;(4)子宫腺肌症;(5)双侧输卵管积水;(6)甲状腺功能异常、血液病等全身性疾病。本研究共纳入127例患者。观察组63例患者于再次行IVF-ET术前行PRP宫腔灌注,对照组64例患者IVF-ET术前未行PRP宫腔灌注。
2.控制性超促排卵方案:月经前黄体中期使用长效促性腺激素释放激动剂(GnRH-a)(曲普瑞林,辉凌,德国)1.4 mg 肌肉注射,14 d后进行B超和血清E2水平检查,如达到垂体降调节标准,开始注射重组人FSH(果纳芬,默克雪兰诺,意大利)75~150 U/d,通过B超和激素水平(血清FSH、LH、E2、孕酮)监测卵泡发育,主导卵泡直径达到18~20 mm时,肌肉注射重组人HCG(艾泽,辉凌,德国)250 μg,36 h后取卵。取卵后即开始肌肉注射黄体酮(浙江仙琚制药)60 mg/d进行黄体支持,取卵3 d后进行胚胎移植。根据胚胎数目和形态进行评分,选择评分最高的2~3枚胚胎进行移植。
3.PRP的制备及应用:如先前报道,PRP由自体血液采用两次离心法制备[6]。月经结束后第3天使用预先装有5 ml 3.2%柠檬酸钠抗凝溶液的注射器抽取15 ml患者自身静脉血,立即于18℃下以相对离心力300g离心 10 min。离心后形成三层,底部为红细胞层,上清液为血浆层,中间为血沉棕黄层。将上面的2层转移到新的无菌离心管中,然后在18℃下以700g再次离心15 min。丢弃约四分之三的上清液后,从离心管底部吸取1 ml PRP,添加凝血酶粉末(25 U/ml,Sigma-Aldrich,美国)和氯化钙(20 mmol/ml,Kalmia,美国)以激活PRP。PRP激活后立即进行宫腔灌注,患者于检查床上取膀胱截石位,用窥阴器暴露宫颈,消毒外阴及阴道。使用注射器吸取1 ml PRP后连接移植管。移植管穿过宫颈口,将PRP缓慢推入宫腔内,灌注后患者静卧30 min。
4.妊娠判断:胚胎移植后14 d查血β-HCG水平,血β-HCG≥50 IU/L定义为HCG阳性。30 d后行B超检查宫腔,了解有无胚囊及其数目,B超检查探及宫内孕囊中有胚芽及心管搏动即为临床妊娠。
5.观察指标及计算:子宫动脉搏动指数(PI)、子宫动脉阻力指数(RI);胚胎种植率=B超检查发现宫内孕囊数/移植胚胎总数×100%。临床妊娠率=获得临床妊娠的患者数/总患者数×100%。
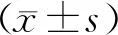
二、结果
1.两组患者的一般资料及促排卵情况:两组患者的年龄、不孕年限、不孕原因等差异均无统计学意义(P>0.05);两组患者血清基础 FSH 值、Gn 使用天数及总量和获卵数等差异均无统计学意义(P>0.05)(表 1)。
2.治疗后两组间子宫内膜厚度、子宫动脉血流参数比较:HCG注射日和胚胎移植日观察组子宫内膜厚度均显著大于对照组(P<0.05),子宫动脉搏动指数(PI)、子宫动脉阻力指数(RI)均显著小于对照组(P<0.05)(表 2)。
3.两组患者的胚胎移植情况及妊娠结局:统计结果显示,两组患者移植胚胎数和优质胚胎数均无显著性差异(P>0.05),观察组的胚胎种植率和临床妊娠率均显著高于对照组(P<0.01)(表 3)。
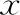
表1 两组患者一般资料及促排卵情况比较[(-±s),n(%)]
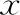
表2 两组间HCG注射日和胚胎移植日内膜厚度、子宫动脉血流参数比较(-±s)
注:与对照组比较,*P<0.05

表3 两组患者胚胎移植及妊娠结局比较(%)
注:与对照组比较,*P<0.01
三、讨论
在自然月经周期中,当胚胎发育到胚泡期时,人的子宫内膜会在排卵后约6 d接受植入。胚泡与子宫内膜间发生一系列复杂的相互作用,导致胚胎附着在宫腔上皮上,随后侵入基质,从而与母体脉管系统建立联系,良好的子宫内膜容受性是胚胎能够顺利植入的前提[7]。B超下子宫内膜的性状如厚度、形态、血流等可以直观地反映子宫内膜状况,也是评估子宫内膜容受性最重要的指标。子宫内膜血流、厚度、类型在月经周期中表现出规律性的变化。围排卵期子宫内膜上皮细胞、内皮细胞、间质细胞迅速增生,表现为子宫内膜厚度增加,腺体增生,螺旋动脉血流灌注更加丰富,RI、PI、脐动脉舒张压血流速度高低比值(S/D值)降低,血流呈低阻力,子宫内膜血流灌注情况可以直接反映胚胎着床部位的微环境,对于受精卵成功着床非常重要,形态上则出现“三线征”。三线征同样提示了良好的子宫内膜血流灌注,胚胎种植前子宫内膜主要表现为细胞的增生、分化和血液供应的增加,且腺体与间质发育同步。另一个子宫内膜容受性的形态学指标为胞饮突,其作用可能为使宫腔上皮可以更好地吸附胚泡。因此,胚泡着床能力与胞饮突的数量存在正相关关系。胞饮突的数量可以作为子宫内膜容受性和植入窗打开的微观形态学指标,分泌期胞饮突的增多意味着子宫内膜处于最佳状态。
PRP是自体血液的一部分,是通过患者全血离心后获得的血小板浓缩物。血小板在其细胞质颗粒中储存了各种生长因子和细胞因子,这些颗粒在激活因子(例如细胞外基质胶原蛋白)存在下会发生胞吐作用从血小板中释放出来[8]。PRP中发现的多种细胞因子和生长因子包括转化生长因子-β(TGF-β)、血小板衍生生长因子(PDGF)、胰岛素样生长因子-I(IGF-I)、血管内皮生长因子(VEGF)、表皮生长因子(EGF)、肝细胞生长因子(HGF)和白细胞介素8(IL-8)[9],因此,向患者给予PRP宫腔灌注也代表了大量细胞因子和趋化因子的输注。细胞因子和生长因子在胚胎植入过程中发挥的重要作用是众所周知的,由血细胞储存和释放的这些信号分子可以促进细胞的迁移,增殖和分化[10],进而促进正常生理条件下的子宫内膜生长和胚胎植入过程。本研究结果显示,HCG注射日和胚胎移植日观察组子宫内膜厚度均显著大于对照组(P<0.05),子宫动脉搏动指数(PI)、子宫动脉阻力指数(RI)均显著小于对照组(P<0.05),这意味着PRP宫腔灌注可以增加子宫内膜厚度,改善子宫内膜血流,继而改善了子宫内膜容受性。
使用自体PRP进行生育治疗的第1份报告来自于不孕的母马,结果表明交配前接受PRP宫腔灌注的母马其妊娠率显著增加[11]。另一项使用体外牛子宫内膜炎症模型的研究表明,经PRP处理的细胞具有更高的增殖速率,并且参与植入的若干基因表达更高[12]。Chang等[4]报道了薄型子宫内膜(<7 mm)患者输注PRP后子宫内膜生长和妊娠结局更好。之后另外几项研究分别报道了 PRP 宫腔灌注可以改善薄型子宫内膜生长和妊娠结局[13-14]。本研究回顾性分析发现将PRP应用于反复种植失败妇女再次IVF-ET过程中行PRP宫腔灌注能改善临床妊娠结局,观察组与对照组相比较,胚胎种植率(20.69% vs 9.09%)、临床妊娠率(42.85% vs 18.75%)均显著提高(P<0.01),与以往研究结果一致。由于对PRP宫腔灌注的研究时间并不长,我们对其机制和原理知之甚少。一项体外实验表明,活化的PRP可以促进人子宫内膜上皮细胞、子宫内膜间质成纤维细胞、子宫内膜间充质干细胞(MSC)、骨髓源性MSC和子宫内膜腺癌细胞的迁移、增殖和分化[15]。这些数据为使用自体PRP增强子宫内膜容受性提供了机制原理的初步证据,最新的研究报告显示PRP宫腔灌注可以促进新血管生成,该研究表明,不孕妇女在冻融胚胎移植周期中子宫内膜欠佳时进行PRP灌注,通过多普勒超声观察到的血管信号数量显著增加,到达子宫内膜3区和4区的血管数量增加[16]。因此我们推测PRP宫腔灌注可以加速内膜的生长和与胚胎发育的同步化,促进子宫内膜螺旋动脉的生成,增加内膜血流,增加胚胎种植的营养供给,改善子宫内膜容受性。
综上所述,PRP宫腔灌注能提高反复种植失败妇女再次IVF-ET术后的胚胎种植率和临床妊娠率,改善妊娠结局。
