人卵巢癌细胞侵袭迁移及其化疗敏感性与双调蛋白的关系与机制研究
2020-05-25赵骏达李晓兰武欣马俊旗
赵骏达,李晓兰,武欣,马俊旗*
(1.新疆医科大学第一附属医院妇科中心,乌鲁木齐 830054;2.复旦大学附属妇产科医院妇科,上海 200082)
卵巢癌是女性生殖系统发病率较高的三大恶性肿瘤之一,也是死亡率最高的妇科恶性肿瘤[1-2]。尽管目前临床上采取手术切除联合铂类、紫杉醇等一线化疗药物进行综合治疗,但患者术后5年生存率并不乐观[3-4],而且化疗药物自身的毒副作用及肿瘤细胞化疗的耐药性都严重影响卵巢癌的疗效[5-6]。因此,积极寻找高效低毒的耐药逆转剂及化疗增敏剂是近年来该领域的研究热点。
双调蛋白(amphiregulin,AREG)是上皮细胞生长因子家族成员[7],且作为表皮生长因子受体(epidermal growth factor receptor,EGFR)的配体之一,可通过自分泌、近端以及旁分泌多种途径作用于EGFR,并使其产生生物学效应[8]。有研究报道,AREG与EGFR相结合会显著增加EGFR的合成,而过表达的EGFR参与细胞下游的多条信号通路的活化,进而参与细胞的增殖与分化[9]。细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族成员之一,也是EGFR信号通路的下游蛋白,它的激活可使转录因子磷酸化并调节相应基因的表达,抑制细胞凋亡,促进细胞增殖[10]。研究发现,EGFR-ERK信号通路可以调控细胞分化、传递细胞外信号至细胞核,该通路的激活与细胞的增殖、分化、癌变以及恶性进展程度密切相关[11]。经前期文献调研发现,有关AREG通过EGFR-ERK信号通路调控卵巢癌细胞化疗敏感性机制的研究尚不多见。因此,本研究以EGFR-ERK信号通路为切入点,通过抑制内源性AREG的表达,初步探索AREG对卵巢癌细胞株COC1的增殖抑制作用、化疗增敏作用及可能的作用机制,为临床的化疗提供理论依据。
材料与方法
一、主要材料与试剂
TRIzol试剂购买于美国Invitrogen公司;兔抗人AREG、EGFR多抗、山羊抗人ERK多抗购买于美国Santa Cruze公司;辣根过氧化物酶(HRP)标记的二抗购买于杭州联科生物技术有限公司;RPMI-1640培养基购买于美国Gibco公司;小牛血清购买于河南华美生物工程公司;四甲基偶氮唑蓝(MTT)以及二甲基亚砜(DMSO)购买于美国Sigma公司;LipofectamineTM2000转染试剂购于美国Ambion公司;反转录PCR(RT-PCR)试剂盒购买于美国Promega公司;注射用顺铂(Cisplatin,CDDP)购买于山东齐鲁制药有限公司;BCA试剂盒购于上海碧云天生物有限公司,紫杉醇购于山东鲁抗辰欣药业有限公司。
引物通过上海生工生物工程公司合成;人卵巢癌细胞株COCl购于武汉大学中国典型培养物保藏中心。Transwell小室购于美国 Corning costar公司;酶标仪购于美国Molecular Devices公司;凝胶成像仪购于美国Biorad公司(型号K8500)。
二、研究方法
1.细胞培养:将人卵巢癌细胞株COC1置于含10%小牛血清的RPMI-1640培养基中,于37℃、5%CO2培养箱中培养,细胞呈悬浮生长,每隔1 d换一次液,每2~3 d按照1∶2的比例进行传代培养,取对数生长期的COC1用于细胞迁移和侵袭等实验。
2.AREG基因的siRNA寡核苷酸序列设计与合成:利用美国Ambion公司在线设计程序,选取AREG基因cDNA序列起始点280个核苷酸之后的连续19 nt作为RNA干扰质粒的特异性序列,并经Blast同源性比较分析,设计为能表达其发卡结构的小干扰RNA(siRNA)的DNA序列,AREG-siRNA mimics质粒(AREG-siRNA)及AREG-siRNA阴性对照(Non-siRNA)质粒引物序列(表1)。

表1 siRNA引物序列(5’-3’)
3.细胞转染及分组:采用LipofectamineTM2000转染试剂转染,按其操作说明优化转染条件。实验分为正常对照组、阴性转染组和AREG转染组。正常对照组细胞不进行任何干预;阴性转染组(Non-siRNA)转染由Ambion公司质粒试剂盒所提供的非特异性质粒;AREG转染组转染AREG-siRNA质粒。转染前1天将细胞接种至6孔板,每孔5×105个细胞,转染当天细胞融合度约85%左右,将质粒与LipofectamineTM2000混合成转染复合物(质粒质量∶LipofectamineTM2000=1∶1.5),加入细胞中轻柔摇匀,置于37℃、5%CO2培养箱中孵育48 h后采用Western blot法检测转染效果,结果表明其转染效率为80%,继续扩增培养用于细胞迁移和侵袭等实验。
4.检测细胞生长抑制率和对化疗药物的敏感性:采用MTT法检测细胞的生长抑制率。取对数生长期的各组COC1(5×103个)接种于96孔板上,培养箱中分别培养24 h、48 h和72 h,用酶标仪于490 nm处检测吸光度(A)值,计算细胞存活率,细胞生长抑制率=(1-细胞存活率)×100%。检测COC1对化疗药物敏感性时,待细胞融合度达85%左右之后,弃去培养基,换用含有顺铂(CDDP,浓度为0.08 mmol/L)或紫杉醇(PTX,浓度为0.115 mmol/L)的1%小牛血清的培养基继续培养48 h,MTT检测细胞生长抑制率。
5.定量反转录PCR(qRT-PCR)检测AREGmRNA的表达:按照RNA分离试剂盒以及TRIzol试剂盒说明书的操作步骤提取纯化各组COC1的总RNA,逆转录以及扩增按其试剂盒说明书操作步骤进行。以各组cDNA作为模板,进行实时定量PCR,每组设置3个复孔,反应体系为:2×All-in-One qPCR Mix 10 μl,5×Syber Green 2 μl,Primer F 1 μl,Primer R 1 μl(表2),cDNA 2 μl,ddH2O 4 μl。反应条件为:95℃ 2 min;95℃ 2 min;95℃ 20 s;60℃ 30 s;75℃ 30 s,一共45个循环,采用ΔΔCT法对不同组别AREG基因差异表达进行统计分析。

表2 引物序列及片段长度
6.细胞划痕实验:调整COC1细胞浓度为l×106个/ml接种于6孔板,待其细胞融合度达70%时分别以AREG-siRNA质粒、Non-siRNA质粒转染细胞,正常对照组不作任何处理,于培养箱中培养24 h后,移去培养基,用预冷的PBS缓冲液洗涤2次,用无菌枪头在底板划一直线,将刮下的细胞洗去,镜下测量痕距。继续培养24 h和48 h,镜下分别测量痕距,计算细胞的迁移率,公式为:细胞迁移率=[0 h划痕宽度 D0-(24 h或者48 h)划痕宽度 D1]/D0×100%,实验重复3次。
7.Transwell 侵袭实验:Transwell小室的上室用100 μl Matrigel胶包被,在紫外线下照射2 h。调整COC1浓度为l×106个/ml接种于6孔板,待其细胞融合度达70%时分别以AREG-siRNA质粒、Non-siRNA质粒转染细胞,正常对照组不作任何处理,于培养箱中培养24 h后各组分别吸取200 μl细胞接种于上室,将小室置于24孔板,在下室中加入含有10%小牛血清的RPMI-1 640培养基继续培养24 h。拭去上室的Matrigel胶和细胞。甲醇固定10 min后以0.1%结晶紫染液染色。在显微镜下随机计数6个视野穿透Matrigel胶的细胞数,计算平均值,实验重复3次。
8.Western blot检测AREG、EGFR及ERK蛋白的表达:取对数生长期COC1,调整细胞浓度为l×106个/ml接种于6孔板,待细胞融合度达85%时,分别以AREG-siRNA质粒、Non-siRNA质粒转染细胞,正常对照组不作任何处理,于培养箱中培养48 h后,弃去培养基,胰酶消化收集细胞,提取蛋白质,BCA试剂盒检测各组蛋白浓度。每组取50 μg的蛋白样品进行SDS-PAGE电泳,转膜、5%脱脂牛奶封闭后,加入AREG、EGFR及ERK一抗(稀释倍数均为1∶1 000)以及内参蛋白β-actin一抗(稀释倍数为1∶7 000),4℃过夜。室温条件下孵育二抗(稀释倍数为1∶5 000)1 h,TBST漂洗3次,加入ECL化学发光液曝光。采用凝胶成像仪分析各目标蛋白及内参的灰度值,以目的条带/内参条带灰度比值为各目的蛋白相对表达量。
三、统计学分析
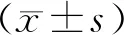
结 果
一、各组COC1细胞的生长抑制情况
对3组卵巢癌细胞之间的生长抑制率进行统计分析,结果显示:与AREG转染组相比较,正常对照组和阴性转染组细胞的生长抑制率显著降低(P<0.01),正常对照组与阴性转染组之间的差异无统计学意义(P>0.05);随着孵育时间的延长,3组COC1的生长抑制率均有增加,但同一组中各时间段之间差异无统计学意义(P>0.05)(表3)。
二、AREG-siRNA转染对COC1中AREG mRNA表达的影响
对各组COC1中AREG基因的mRNA表达水平进行比较,其结果表明:与正常对照组相比,阴性转染组细胞AREGmRNA表达略有下降,但差异无统计学意义(P>0.05);与正常对照组和阴性转染组相比较,AREG转染组细胞中AREGmRNA表达显著下降(P<0.01)(图1)。
表3 各组COC1不同处理时间段的生长抑制率(-±s)
注:与同时段AREG转染组相比较,*P<0.01
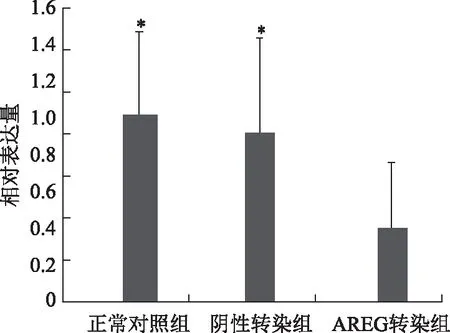
与AREG转染组比较,*P<0.01图1 三组COC1中AREG mRNA表达水平
三、AREG-siRNA转染对COC1迁移及侵袭行为的影响
各组COC1迁移及侵袭行为的统计分析显示,与正常对照组相比,阴性转染组细胞的迁移及侵袭行为被抑制,但差异无统计学意义(P>0.05),而AREG转染组细胞的迁移及侵袭行为被显著抑制(P<0.01);与阴性转染组相比,AREG转染组细胞的迁移及侵袭行为显著被抑制(P<0.01);同组不同时间段的迁移率相比,48 h的迁移率显著高于24 h(P<0.01)(表4、图2~3)。
表4 COC1迁移率与侵袭行为比较[(-±s),%]
注:与同时段AREG转染组相比较,*P<0.05;与同组24 h相比较,#P<0.01;与AREG转染组相比,ΔP<0.01
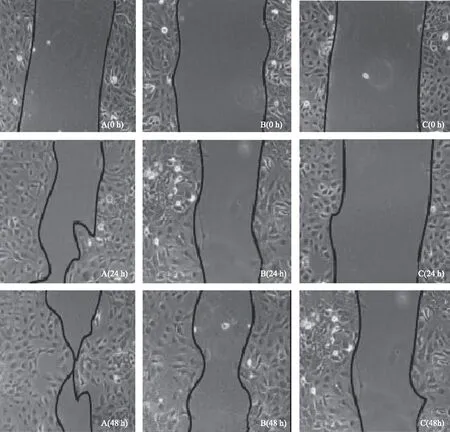
A:正常对照组;B:阴性转染组;C:AREG转染组图2 AREG对COC1迁移的影响(划痕实验)
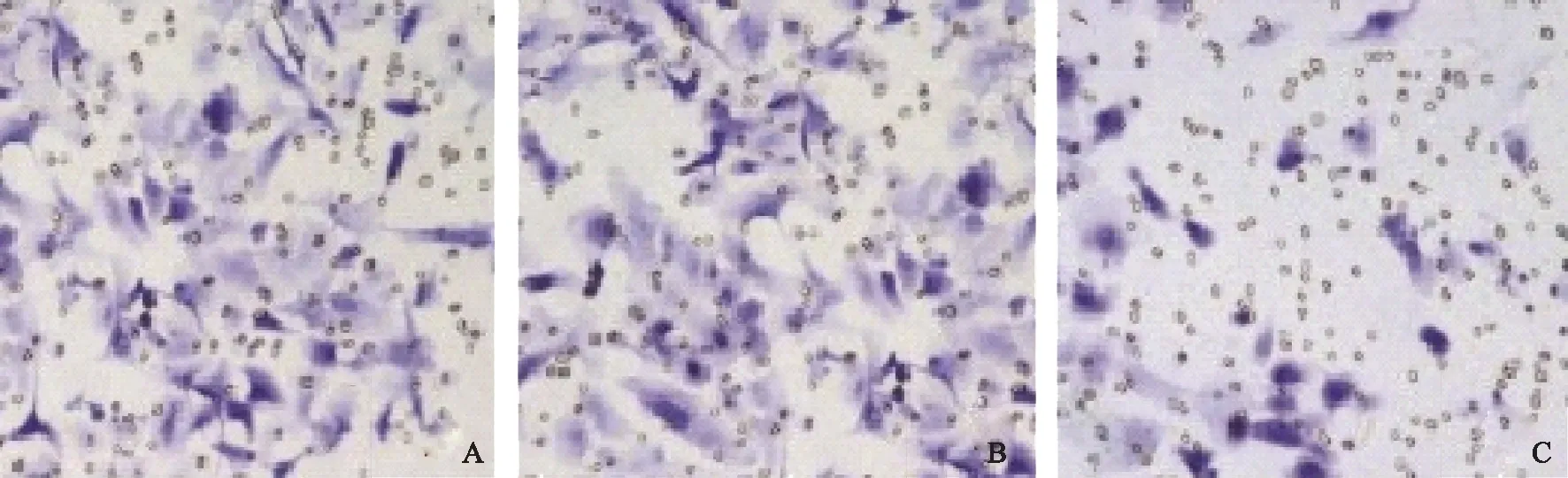
A:正常对照组;B:阴性转染组;C:AREG转染组图3 AREG对COC1侵袭能力的影响(结晶紫染色)
四、AREG-siRNA转染对COC1化疗敏感性的影响
针对转染AREG-siRNA对COC1化疗敏感性的影响进行研究,结果表明:对顺铂(CDDP)而言,与正常对照组相比,阴性转染组细胞的化疗敏感性略有增加,但差异无统计学意义(P>0.05);而AREG转染组COC1的化疗敏感性显著增强(P<0.01);与阴性转染组相比,AREG转染组细胞的化疗敏感性增强,差异有统计学意义(P<0.01);而对于紫杉醇(PTX)而言,各组细胞的化疗敏感性差异均无统计学意义(P>0.05)(表5)。
表5 三组COC1对不同药物化疗敏感性的比较(-±s)
注:同AREG转染组相比较,*P<0.01
五、各组卵巢癌细胞COC1中AREG、EGFR及ERK蛋白的表达情况
与正常对照组相比,阴性转染组细胞中AREG、EGFR及ERK蛋白表达水平略有下调,但差异无统计学意义(P>0.05),而AREG转染组细胞中AREG、EGFR及ERK蛋白表达被显著抑制(P<0.01);与阴性转染组相比,AREG转染组细胞中AREG、EGFR及ERK蛋白表达被显著抑制(P<0.01)(图4)。
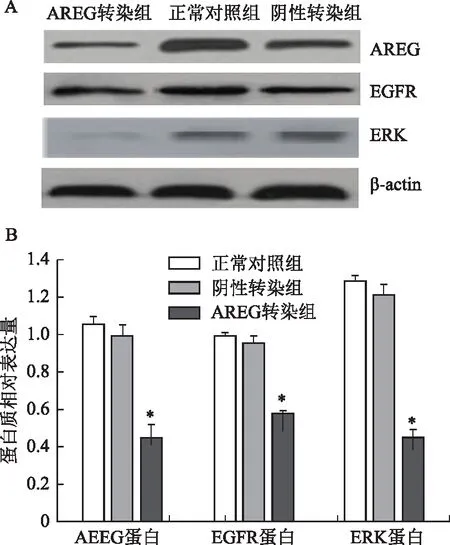
A:Western Blot检测条带图;B:三组COC1中AREG、EGFR 和ERK蛋白相对表达情况;与其余两组比较,*P<0.01图4 COC1中AREG、EGFR及ERK蛋白的相对表达水平比较
讨 论
卵巢癌、子宫癌以及宫颈癌并称为女子生殖系统的三大恶性肿瘤[12]。其中因卵巢位于盆腔,发病隐蔽,临床上缺乏早期特异性的诊断方法,导致卵巢癌的死亡率跃居妇科肿瘤之首[13]。目前顺铂作为卵巢癌临床一线化疗药物,取得了一定的疗效,但因其化疗耐药性的产生严重限制其临床应用,同时卵巢癌术后常发生转移及复发,预后不佳,患者5年的生存率低于30%,因此积极寻求高效、低度的化疗增敏药物及分子靶标可能为卵巢癌的治疗以及延缓其复发提供新的策略[14]。
有研究报道,EGFR信号失调在人类一系列上皮恶性肿瘤的发生及发展中均发挥关键作用[15]。尽管有关EGFR的表达与癌症患者预后之间的研究报道较多,但目前就二者之间的关系尚未达成共识。Cheng等[16]研究结果显示EGFR过表达与胰腺癌患者低生存率之间呈显著相关性,然而也有研究报道显示胰腺癌病人EGFR表达水平不能反映其病人的预后状况[17]。迄今为止,有关EGFR的表达与卵巢癌的发生及发展的关联性尚未形成理论依据。
作为EGFR配体家族的成员,双调蛋白(AREG)通过与EGFR相结合,活化细胞内级联信号通路,从而参与调节细胞存活、增殖和迁移[18]。目前,尽管AREG在抗肿瘤免疫和耐受中的作用机制尚不清楚,但是临床上广泛的应用EGFR拮抗剂治疗转移性上皮癌表明AREG可能在调节肿瘤免疫应答中发挥关键作用[19]。但有关AREG-EGFR信号转导与卵巢癌的发生发展之间的关联性研究报道较少。
ERK作为丝裂原活化蛋白激酶家族的一员,位于EGFR信号的下游,也是EGFR信号转导的一条经典通路[20]。研究表明,ERK同时扮演着膜蛋白与转录因子的双重角色,在细胞信号通路的调控中发挥着十分重要的作用[21]。而ERK的激活使转录因子磷酸化并调节基因的表达,抑制细胞凋亡,促进细胞增殖[22]。因此在卵巢癌微环境大量细胞因子的作用下,内源性AREG的过表达将导致EGFR的活化,由此触发下游ERK通路的活化,进一步启动细胞级联反应,从而促进恶性肿瘤的发生、发展、转移及侵袭。
因此,本研究采用siRNA转染人卵巢癌细胞COC1,抑制AREGmRNA的表达,初步探索AREG调控EGFR-ERK信号通路对卵巢癌细胞化疗敏感性、细胞迁移及侵袭行为的影响。由研究结果可知:通过AREG-siRNA转染干预内源性AREG表达后,卵巢癌细胞COC1的生长抑制率显著高于正常对照组及阴性转染组;且经AREG-siRNA转染干预后,卵巢癌细胞COC1的迁移及侵袭性被显著抑制,且对顺铂化疗药物的敏感性显著提高,大约是正常癌细胞的3倍,对紫杉醇药物的敏感性也有所增加,但与其他组相比,其差异不具有统计学意义(P>0.05)。经AREG-siRNA转染干预后,卵巢癌细胞中AREGmRNA水平及蛋白水平较其他两组均降低,且EGFR、ERK的蛋白表达水平与其他两组相比,也降低,其差异具有统计学意义(P<0.01)。
综上所述,本研究通过siRNA转染卵巢癌细胞,干扰内源性AREG的表达,抑制了COC1的增殖、迁移和侵袭,增强了卵巢癌细胞COC1对顺铂化疗的敏感性,其可能作用机制与AREG调控EGFR-ERK信号通路的转导有关,为逆转化疗耐药性及卵巢癌细胞的侵袭与转移提供了实验依据。但有关AREG调控EGFR-ERK信号通路具体机制有待后续进一步探讨。
