非水相体系阿魏酸淀粉酯的合成及其抗氧化特性
2020-05-25肖志刚陶莉伟吕春月崔晓彤张权峰杨庆余
肖志刚 陶莉伟 吕春月 王 娜 崔晓彤 张权峰 杨庆余
(沈阳师范大学粮食学院1,沈阳 110034)
(沈阳农业大学食品学院2,沈阳 110161)
藜麦又称为南美藜[1],营养价值十分丰富,具有抗肿瘤[2]、抗菌、抗氧化[3,4]、增强免疫[5,6]的作用,对糖尿病[7,8]及心血管疾病[9,10]有良好的防治作用。淀粉是藜麦种子的主要成分,约占干物质的53.5%~69.2%[11],藜麦淀粉具有极好的冻融和凝沉稳定性,藜麦淀粉可以作为化学改性淀粉的替代品。阿魏酸是米糠的主要成分之一,具有很强的抗氧化能力和抗紫外线吸收特性[12],阿魏酸也被认为是一种结肠癌的潜在化学预防成分[13]。目前,阿魏酸淀粉酯的合成主要是化学法[14],但化学法中使用的三氯化磷、氯化亚砜等用来活化阿魏酸的酰化剂都具有剧毒并且会对环境造成污染,在化学反应过程中还会发生副反应,导致有害副产物的产生。此外,在使用酰化剂的同时,反应过程中需要通入氮气来保证阿魏酸淀粉酯的合成,所以,在操作上比较繁琐,而且取代度也比较低。
本研究以原藜麦淀粉为原料,异辛烷作为溶剂体系,猪胰脂肪酶和Novozym435脂肪酶为催化剂,通过非水相酶法制备具有抗氧化性的阿魏酸藜麦淀粉酯。利用扫描电子显微镜、傅里叶变换红外光谱仪、X射线衍射仪及差示扫描量热仪等方法研究阿魏酸藜麦淀粉酯的结构和性质的变化规律,并揭示其抗氧化特性的变化规律。该研究为功能性淀粉的制备提供参考。
1 材料与方法
1.1 材料与试剂
藜麦、阿魏酸(FA)、猪胰脂肪酶、 Novozym435脂肪酶、DPPH(1,1-二苯基-2-三硝基苯肼)。
1.2 仪器与设备
Avanti J高效离心机;D-max-2 500型X射线衍射仪;DSC-Q20差示扫描量热仪;RVA-TecMaster快速黏度分析仪;Nicolet 380型傅里叶红外光谱仪;NHITACHIS-3 400扫描电子显微镜。
2 实验方法
2.1 藜麦淀粉的提取
将藜麦种子粉碎后过100目筛,取筛下物保存备用。称取适量藜麦粉100目筛下物并将其与0.2%的NaOH溶液按照1∶5的比例混合,搅拌3 h后,静置过夜。将混合物于5 000 r/min离心10 min,去除上层黄色蛋白质和下层灰色沉淀,取出中间白色淀粉反复离心、洗涤,用HCl调节pH至中性。最后将产物置于45 ℃烘箱中干燥后粉碎封袋保存。
2.2 阿魏酸藜麦淀粉酯的制备
称取8 g原藜麦淀粉于100 mL烧杯中,加入80 mL有机溶剂异辛烷,其中未加酶的反应条件:精确称取0.4 g阿魏酸加入到烧杯中,35 ℃水浴锅中磁力搅拌9 h;猪胰脂肪酶的催化反应条件:精确称取0.4 g阿魏酸与0.16 g猪胰脂肪酶混合加入到烧杯中,35 ℃水浴锅中磁力搅拌9 h;Novozym435脂肪酶的催化反应条件:精确称取0.4 g阿魏酸与0.16 gNovozym435脂肪酶混合加入到烧杯中,70 ℃水浴锅中磁力搅拌5 h。反应结束后用无水乙醇反复离心(5 000 r/min,10 min)清洗除去未反应的阿魏酸,洗涤后将样品置于50 ℃烘箱中烘干,研磨后备用。
2.3 取代度的测定
采用UV-1 200S型紫外可见分光光度计对产物取代度进行测定,将产物的碱水解液用乙酸乙酯萃取后,测得水解后阿魏酸的吸光度值,经回归方程计算其含量,从而计算出取代度。
2.3.1 标准曲线的绘制
准确称取一定量的阿魏酸定容于一定体积的乙酸乙酯中后稀释,配制得到质量浓度为1、2、3、4、5、6 μg/mL的阿魏酸标准溶液,在320 nm处测定不同浓度溶液的吸光度值,以溶液浓度为横坐标,吸光度值为纵坐标,绘制得到阿魏酸的标准曲线。
2.3.2 取代度的计算
淀粉酯的水解:称取0.1 g干燥后的产物,加入到50 mL带塞三角瓶中,加入30 mL 1 mol/L的NaOH溶液,在50 ℃磁力搅拌下水解3 h,水解后用1 mol/L盐酸滴定至pH 2左右,移取20 mL水解液于分液漏斗中,用100 mL乙酸乙酯萃取4次,备用。
利用UV紫外可见分光光度计,在320 nm下测定萃取液吸光值,根据标准曲线计算得到阿魏酸含量,并按公式计算取代度:
式中:W为阿魏酸在阿魏酸淀粉酯中的质量百分比/%;C为根据标准曲线计算得出的阿魏酸浓度/g/L;V为萃取液体积/L;m0为产物质量/g;M为阿魏酸相对分子质量,194.19。
2.4 扫描电子显微镜
将一定量的淀粉充分分散于固定在载物台上双面导电胶上,用洗耳球吹去多余未粘附的样品,在真空条件下进行镀金处理后观察,加速电压为15 kV,放大倍数分别为5 000倍和20 000倍。
2.5 傅里叶红外光谱
称取5 mg(干基)样品与溴化钾粉末混合均匀后研磨,采用压片法制样并放入红外光谱分析仪进行测试,扫描波长范围为(500~4 000)cm-1。先在室温下以空气为背景波长扫描,后对样品进行扫描。
2.6 X-射线衍射
X-射线衍射分析参考杨庆余等[15]的方法略作调整:室温下用D-max-2 500型X射线衍射仪测定,采用Cu-Kα靶,石墨单色器、40 kV和2 000 mA,扫描速度为2(°)/min,扫描范围在3~40°。相对结晶度根据Miao等[16]进行计算,X-射线衍射数据采用MDI Jade 6.0进行拟合处理,对原始图进行平滑处理。相对结晶度采取公式计算:
式中:Ac和An分别代表结晶区域和无定型区域,Xc为结晶度。
2.7 热特性分析
使用差示扫描量热仪(DSC,TA,Q20)进行测定,称取3.0 mg(干基)淀粉样品放于铝制坩埚中,按质量比1∶2比例加入蒸馏水,将坩埚用压盖密封平衡水分后进行测定,以空坩埚作参比,扫描温度范围为20~140 ℃,扫描速度10 ℃/min。每个样品适当重复3次,取其平均值。
2.8 糊化特性分析
糊化特性的测定参考潘治利[17]的方法并加以改进,采用快速黏度测定仪(RVA)分析淀粉的糊化特性。准确称取3.00 g淀粉样品和25 mL蒸馏水于铝盒内,按12%的湿基校正。然后在RVA上按以下程序测试:初始搅拌速率960 r/min,10 s后,待形成均匀悬浊液,在50 ℃条件下恒温1 min,再以12℃/min由50 ℃上升至95 ℃并恒温3 min,之后以同样的速率由95 ℃下降至50 ℃,并恒温3 min,测试结束。样品平行测3次,所有特征参数取3次数据平均值。
2.9 DPPH自由基清除力的测定
DPPH自由基清除力的测定参考王萍萍[18]的方法略作调整。
2.00×10-4mol/L DPPH溶液的配制:精确称取0.007 8 g DPPH试剂于100 mL容量瓶中,用无水乙醇溶解并定容。
移取2 mL样品溶液和2 mL DPPH无水乙醇溶液于10 mL试管中,混匀,避光反应30 min,在517 nm处测定其吸光度,原藜麦淀粉作空白,平行测定3次。
DPPH自由基清除率按公式计算:
式中:A0为原藜麦淀粉+DPPH的吸光度;AS为样品淀粉+DPPH的吸光度。
2.10 数据分析
每次实验均进行3次平行,数据采用SPSS 18.0软件进行统计分析,方差分析采用Duncan’s方法,用Origin9.1软件绘图。
3 结果与分析
3.1 不同条件制备的阿魏酸藜麦淀粉酯取代度的测定
3.1.1 阿魏酸标准曲线
采用UV-1 200S型紫外可见分光光度计对不同质量浓度的阿魏酸标准溶液进行测定,得到的回归方程为:y=0.100 4x-0.000 1,R2=0.999 5。
3.1.2 取代度测定结果
图1是不同条件制备的阿魏酸藜麦淀粉酯取代度。由图1可知,QSFA-1、QSFA-2和QSFA-3的取代度分别为0.16%、0.23%、0.39%。由此可见,原藜麦淀粉与阿魏酸用Novozym435脂肪酶催化制备的阿魏酸藜麦淀粉酯的取代度最高,而猪胰脂肪酶催化制备的阿魏酸藜麦淀粉酯取代度偏低,说明脂肪酶的种类对于阿魏酸淀粉酯的合成有很大关系。这可能是因为Novozym435脂肪酶更容易催化有机溶剂中的酯化反应,酶的活性中心与阿魏酸更有效的结合从而使催化效率更高[19]。
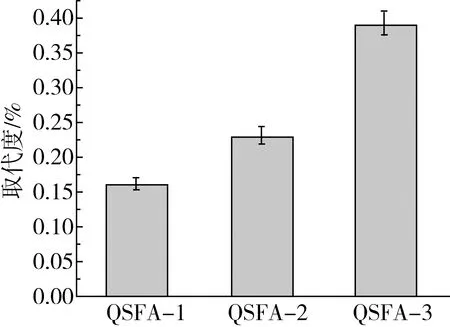
注:QSFA-1、QSFA-2、QSFA-3分别为原藜麦淀粉+FA制得的阿魏酸藜麦淀粉酯、原藜麦淀粉+FA+猪胰脂肪酶制得的阿魏酸藜麦淀粉酯、原藜麦淀粉+FA+Novozym435制得的阿魏酸藜麦淀粉酯。图1 不同条件制备的阿魏酸藜麦淀粉酯的取代度
3.2 不同条件制备的阿魏酸藜麦淀粉酯的电镜分析
图2为原藜麦淀粉和阿魏酸藜麦淀粉酯的扫描电镜图。从图2中可以看出,原藜麦淀粉颗粒的形状为多边形,颗粒的形状比较均匀,淀粉颗粒的表面比较平滑。而在阿魏酸藜麦淀粉酯的颗粒表面观察到部分团聚体,并且随着阿魏酸取代度的升高,阿魏酸藜麦淀粉酯颗粒的表面变得更加粗糙,颗粒形貌的变化程度加剧。这可能是因为溶解的阿魏酸与淀粉颗粒通过氢键相互作用使淀粉颗粒表面失去原有的平顺性[20],或者淀粉颗粒在酯化过程中发生断裂被羟基取代并且发生凝胶化,使淀粉颗粒的表面变得粗糙。

注:NQS为原藜麦淀粉a1、b1、c1、d1分别为:NQS、QSFA-1、QSFA-2、QSFA-3 (×5 000);a2、b2、c2、d2分别为:NQS、QSFA-1、QSFA-2、QSFA-3 (×20 000)。图2 原藜麦淀粉与不同条件制备的阿魏酸藜麦淀粉酯的电镜图
3.3 不同条件制备的阿魏酸藜麦淀粉酯的红外光谱分析
图3是原藜麦淀粉和阿魏酸藜麦淀粉酯的傅里叶红外光谱图。在原藜麦淀粉中,光谱的指纹区域由923~1 162 cm-1之间的三个特征峰组成,归因于C—O键伸展,2 926 cm-1处的尖锐带是与环次甲氧氢原子相关的C—H伸展,由于氢键合的羟基相关的复杂振动伸展,在3 250~3 650 cm-1处有吸收峰。而在阿魏酸藜麦淀粉酯的图谱中,1 650~1 700 cm-1之间新峰的出现与酯基的特征峰出峰的范围相吻合,由此证明了酯键的生成。此外,在2 933 cm-1附近为苯环上O—CH3的不对称伸缩振动峰。由此说明,以异辛烷作为反应介质的有机溶剂体系,采用猪胰脂肪酶和Novozym435脂肪酶作为催化剂可以合成阿魏酸藜麦淀粉酯。
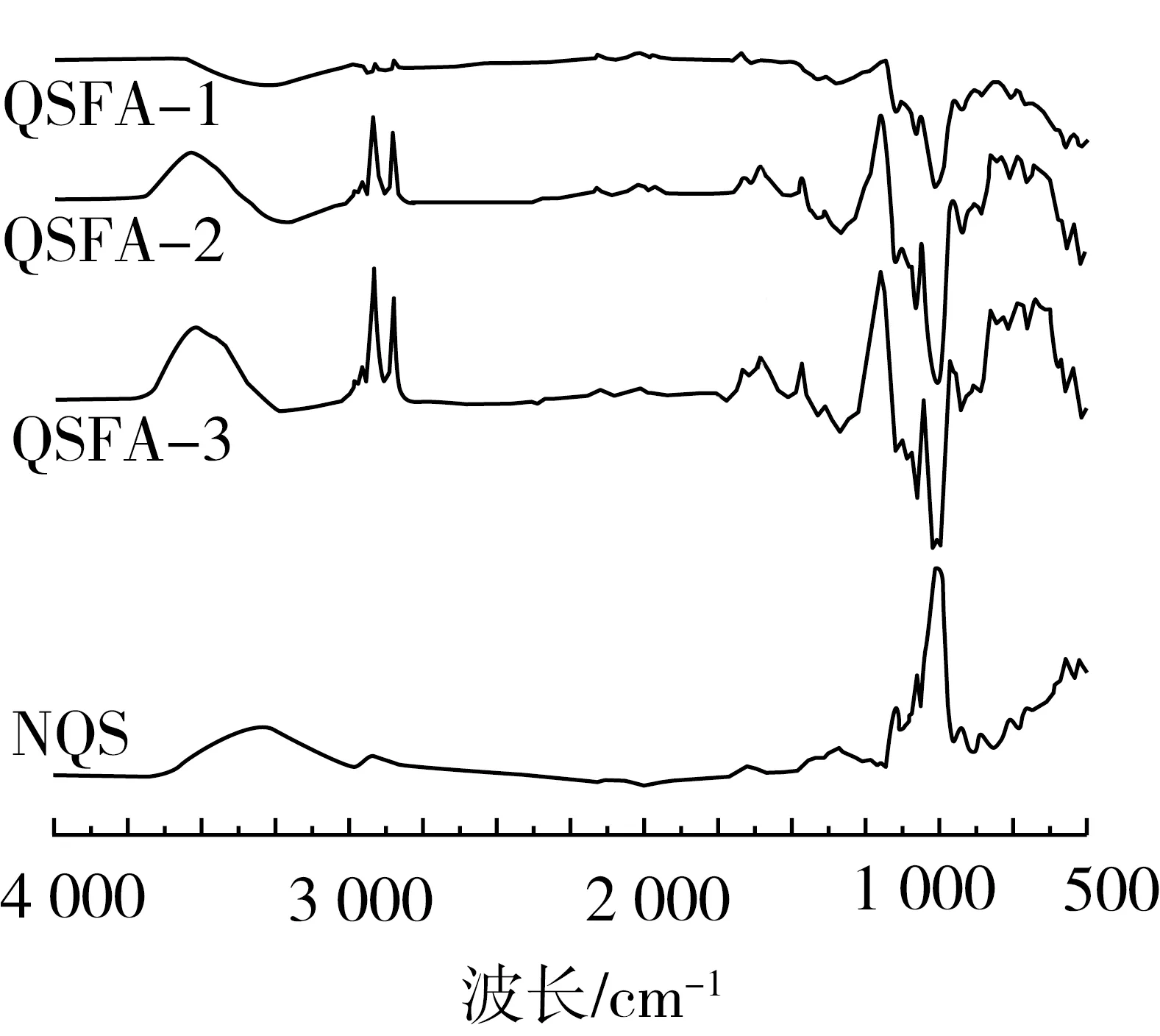
图3 原藜麦淀粉与不同条件制备的阿魏酸藜麦淀粉酯的红外光谱图
3.4 不同条件制备的阿魏酸藜麦淀粉酯的X-射线衍射分析
由图4可知,原藜麦淀粉和阿魏酸藜麦淀粉酯均在2θ为15°、17°和23°处有强吸收峰,说明原藜麦淀粉和阿魏酸藜麦淀粉酯都属于A型结构。原藜麦淀粉和阿魏酸藜麦淀粉酯的结晶度分别为24.65%、17.78%、17.10%、19.93%,阿魏酸藜麦淀粉酯的结晶度均低于原藜麦淀粉。可能是因为原藜麦淀粉与阿魏酸在非水相中发生反应,淀粉颗粒的结晶区受到不同程度的破坏,淀粉颗粒失去了原有结晶结构,排列规整的结晶单位数量减少[21],无定型区域增加,原藜麦淀粉的分子结构更加趋于无序化。
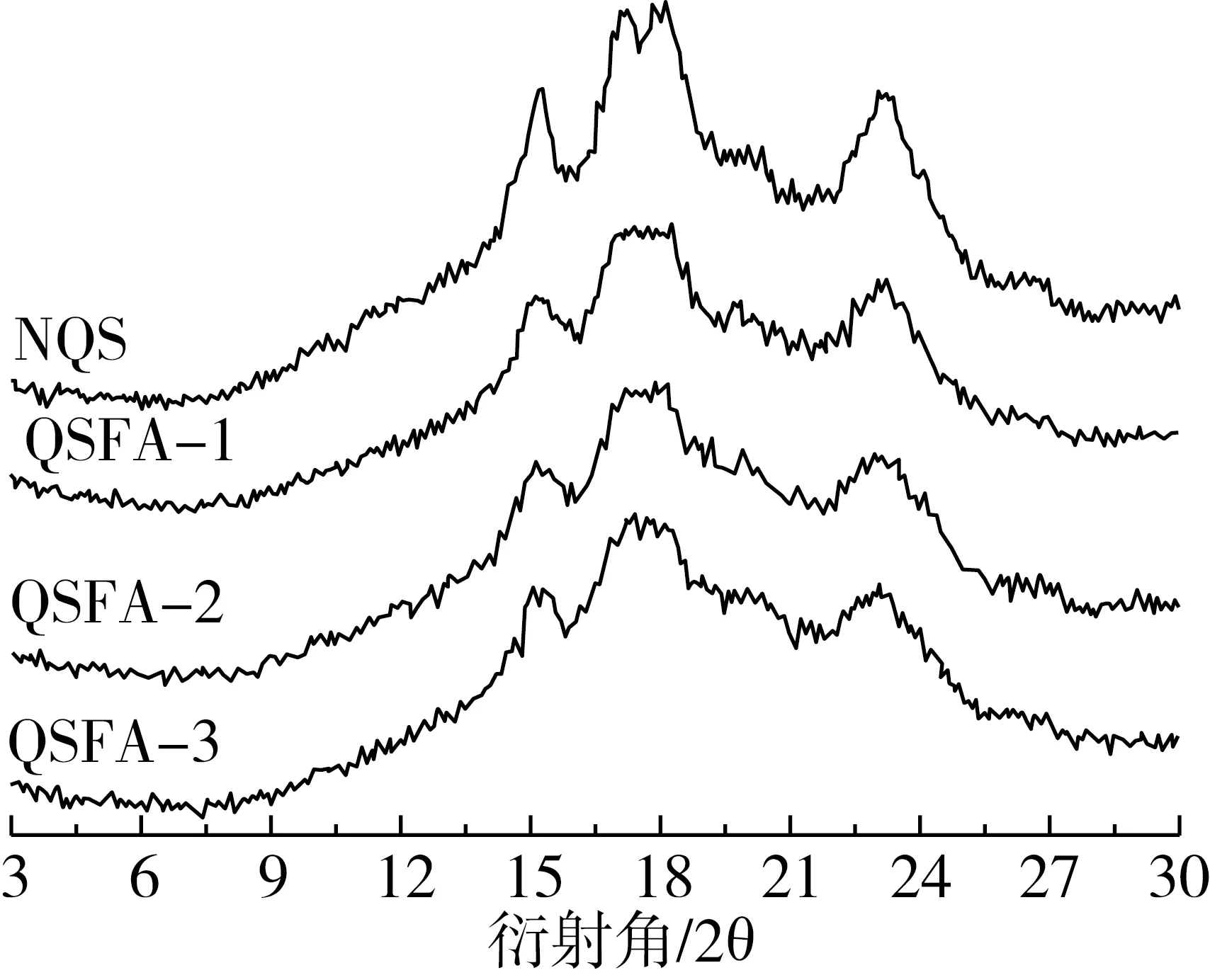
图4 原藜麦淀粉与不同条件制备的阿魏酸藜麦淀粉酯的X-射线衍射图
3.5 不同条件制备的阿魏酸藜麦淀粉酯的热特性分析
表1为原藜麦淀粉和阿魏酸藜麦淀粉酯的DSC参数表。由表1可知,原藜麦淀粉的糊化起始温度(T0)为54.77 ℃,峰值温度(Tp)为62.76 ℃,终值温度(Tc)为81.31 ℃,焓值为15.67 J/g。阿魏酸藜麦淀粉酯的凝胶焓值均低于原藜麦淀粉,凝胶焓值变化趋势与结晶度结果相一致。凝胶焓值降低的原因可能是膨胀的淀粉颗粒中部分相邻葡萄糖单元之间氢键发生断裂[22],淀粉分子间的双螺旋结构发生解旋,淀粉颗粒的部分结晶结构被破坏,使分子结构的无定化程度提高。因此,阿魏酸藜麦淀粉酯的焓值低于原藜麦淀粉。原藜麦淀粉仅有1个吸热峰,而阿魏酸藜麦淀粉酯出现了2个吸热峰,其中第一个为原藜麦淀粉的糊化吸热峰,第二个即为阿魏酸藜麦淀粉酯的裂解峰,证明了阿魏酸藜麦淀粉酯的形成。
3.6 不同条件制备的阿魏酸藜麦淀粉酯的糊化特性分析
图5为原藜麦淀粉和阿魏酸藜麦淀粉酯的黏度图谱。由图5可知,与原藜麦淀粉相比,阿魏酸藜麦淀粉酯的起始黏度、峰值黏度和终值黏度呈下降趋势。这可能是由于多酚具有多元结构,其羟基与支链淀粉的侧链发生反应,并且与淀粉颗粒的无定型区发生不同程度的结合,从而改变晶质和无定型质之间的偶合力,促使淀粉颗粒之间发生简单水合,使糊化热能减少[23]。其次,在酯化过程中,化学修饰导致部分或全部淀粉分子断裂,从而削弱其膨胀能力。此外,在酯化反应中发生一定程度的解聚反应,这也可能导致黏度降低。以猪胰脂肪酶为催化剂制得的阿魏酸藜麦淀粉酯的黏度极低,可能的原因是反应体系中淀粉分子上更多的糖苷键发生断裂,或者剧烈的剪切作用使淀粉分子之间的作用减弱,相互缠绕的淀粉分子发生定向排列,聚集程度下降,从而导致黏度降低[24-25]。

表1 原藜麦淀粉与不同条件制备的阿魏酸藜麦淀粉酯的热特性参数
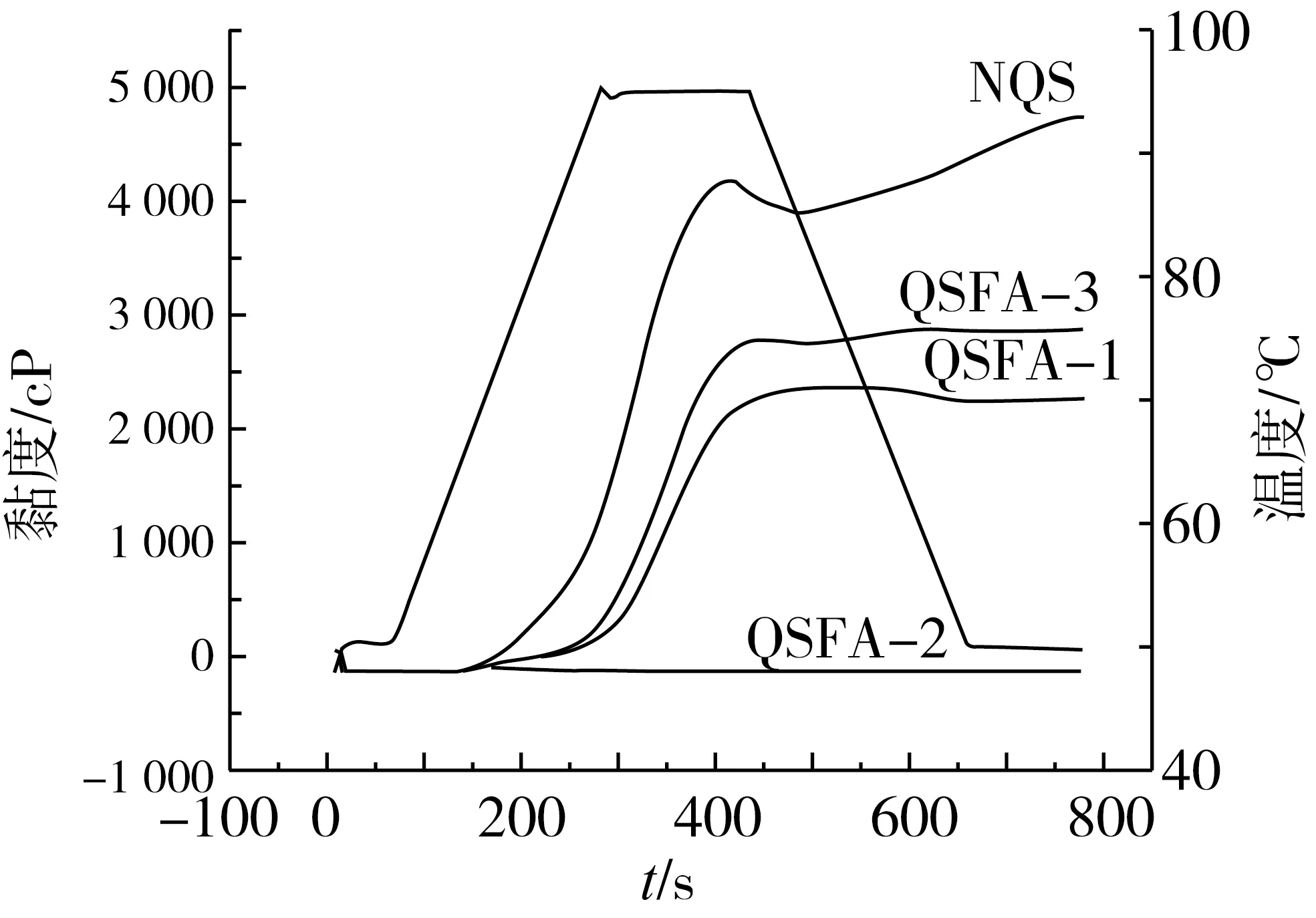
图5 原藜麦淀粉与不同条件制备的阿魏酸藜麦淀粉酯的黏度曲线
3.7 不同条件制备的阿魏酸藜麦淀粉酯DPPH自由基清除率结果分析
图6为不同条件制备的阿魏酸藜麦淀粉酯的抗氧化结果。随着阿魏酸藜麦淀粉酯的取代度增加,DPPH自由基的清除率也随之增强,QSFA-1、QSFA-2和QSFA-3的DPPH自由基清除率分别为9.55%、17.05%和28.78%。高取代度的阿魏酸淀粉酯,其DPPH自由基的清除效果越好,证明阿魏酸在藜麦淀粉上接枝的量越多,阿魏酸淀粉酯的抗氧化能力越高,这与Yu等[14]报道的结果一致。因此,DS-FA0.39%中结合的阿魏酸有助于提高藜麦淀粉的抗氧化能力。
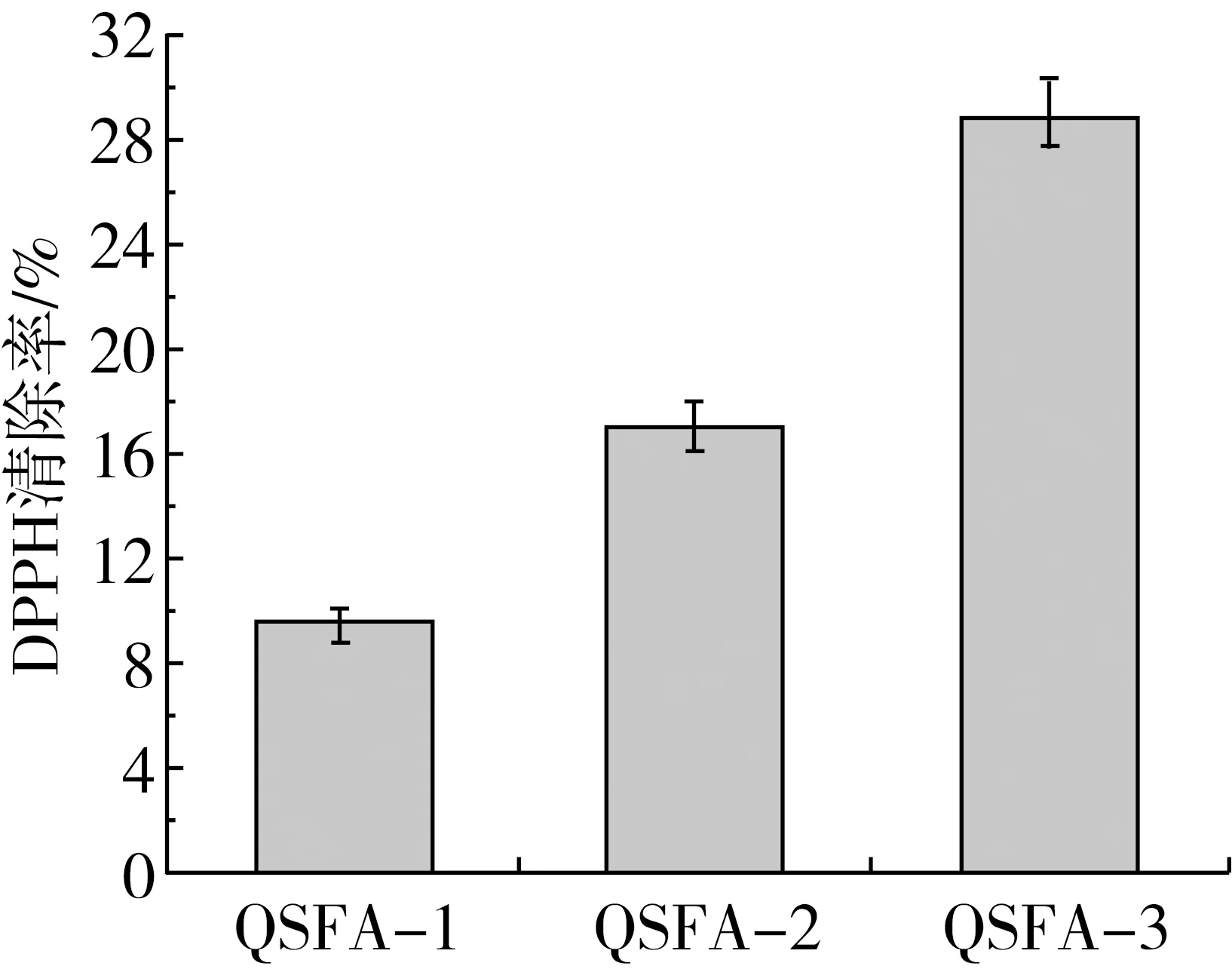
图6 原藜麦淀粉与不同条件制备的阿魏酸藜麦淀粉酯的DPPH自由基清除率
4 结论
实验采用非水相酶法制备阿魏酸藜麦淀粉酯,阿魏酸藜麦淀粉酯颗粒表面变粗糙,结构发生明显的变化。傅里叶红外光谱图证明了阿魏酸成功接到藜麦淀粉骨架上,阿魏酸藜麦淀粉酯的结晶度均比原藜麦淀粉的结晶度低,阿魏酸藜麦淀粉酯的无定型区增加。热特性测定表明阿魏酸藜麦淀粉酯出现两个吸热峰,第二个吸收峰为阿魏酸藜麦淀粉酯复合物的吸收峰。Novozym435脂肪酶对于催化合成阿魏酸藜麦淀粉酯的效果优于猪胰脂肪酶,其取代度为0.39%。阿魏酸藜麦淀粉酯具有较好的抗氧化特性,随着取代度的升高,DPPH清除率升高,抗氧化能力增强。
