自发性高血压大鼠左心室心肌组织骨形成蛋白和激活素的跨膜抑制剂、转化生长因子β1表达情况及其与室性心律失常易感性的关系研究
2020-05-25梁宇明何燕
梁宇明,何燕
骨形成蛋白和激活素的跨膜抑制剂(bone morphogenetic protein and activin membrane-bound inhibitor,BAMBI)是一种广泛存在于心肌细胞的跨膜蛋白,可参与调控转化生长因子β(TGF-β)的表达。既往研究表明,BAMBI可负反馈调节TGF-β信号通路,下调TGF-β表达并参与与TGF-β表达密切相关的生理病理过程[1]。TGF-β是分泌型多肽信号分子,在哺乳动物中存在多种亚型,其中TGF-β1亚型功能最为强大且分布最为广泛。既往研究表明,TGF-β可导致左心室心肌纤维化、心功能降低,进而参与左心室重构[2]。临床研究发现,人体心脏处于压力负荷状态时,心脏组织BAMBI表达升高[3]。动物实验发现,小鼠心脏处于压力负荷状态时,左心室BAMBI表达上调以对抗TGF-β1的致纤维化作用,进而抑制左心室重构,发挥心脏保护作用[3]。因此,BAMBI和TGF-β1均介导压力负荷下左心室心肌纤维化进程,参与左心室重构,而心肌纤维化又与室性心律失常(ventricular arrhythmias,VA)的发生密切相关[4]。本研究旨在分析自发性高血压大鼠左心室心肌组织BAMBI、TGF-β1表达情况及其与VA易感性的关系,现报道如下。
1 材料与方法
1.1 实验动物 2018年7月—2019年7月,选取6只14周龄雄性Wistar大鼠作为对照组,6只与Wistar大鼠同源的雄性自发性高血压大鼠作为实验组,两组大鼠均由北京维通利华实验动物技术有限公司提供,体质量300~340 g。所有大鼠饲养至22周龄,饲养环境:温度15~25 ℃,每笼3~5只大鼠,以普通干饲料喂养,不限饮水,光照-黑暗各12 h交替进行。每日固定时间通过鼠尾测压计检测大鼠心率、血压,以Wistar大鼠收缩压≤140 mm Hg(1 mm Hg=0.133 kPa)、自发性高血压大鼠收缩压≥160 mm Hg为满足实验要求。
1.2 主要试剂与仪器
1.2.1 主要试剂 无水乙醇和二甲苯购自国药集团化学试剂有限公司,柠檬酸(pH值为6.0)抗原修复液、磷酸盐缓冲液(PBS)、苏木素染液、苏木素分化液、苏木素返蓝液及DAB显色试剂购自武汉赛维尔生物科技有限公司,BAMBI一抗、TGF-β1一抗及山羊抗兔免疫球蛋白G(IgG)二抗购自Abcam公司,SYBR GREEN qPCR Super Mix购自Invitrogen公司,ImProm-ⅡTMReverse Transcription System、dNTP、Random Primer、M-MLV、DNAse、RNasin Ribonuclease Inhibitor购自美国Promega公司,BCA法蛋白含量检测试剂盒、磷酸酶抑制剂购自南京凯基生物发展有限公司,蛋白预染Marker购自Thermo公司,SDS、甘油、β-巯基乙醇、过硫酸铵购自北京鼎国生物技术有限责任公司,30%丙烯酰胺溶液购自上海申能博彩生物科技有限公司,显影粉购自天津市世纪奥博商贸有限公司。
1.2.2 主要仪器 智能无创血压计购自北京软隆生物技术有限公司(型号:BP-2010A),生物信号采集仪器购自安徽正华生物仪器设备有限公司(型号:MD3000),彩色多普勒B超仪购自意大利百胜公司(型号:MyLabSeven),脱水机(型号:JJ-12J)、包埋机(型号:JB-P5)购自武汉俊杰电子有限公司,病理切片机(型号:RM2016)购自上海徕卡仪器有限公司,脱色摇床(型号:TSY-B)、涡旋混合器(型号:MX-F)购自武汉赛维尔生物科技有限公司,免疫组化笔(型号:GT1001)购自Genetech公司,ABI 7500实时荧光定量PCR仪购自美国爱普拜斯公司,核酸蛋白测定仪(型号:22331 Hamburg)购自德国Eppendorf公司,垂直电泳槽(型号:VE180)、转移电泳槽(型号:VE186)购自上海天能科技有限公司,电泳仪(型号:BG-Power 600i)购自北京百晶生物技术有限公司。
1.3 实验方法
1.3.1 收缩压和心率检测方法 22周龄时采用鼠尾测压计检测两组大鼠收缩压及心率,每只大鼠在安静状态下检测3次并取平均值。
1.3.2 心脏彩超检查 两组大鼠均于22周龄时进行心脏彩超检查,具体操作如下:大鼠给予10%水合氯醛行腹腔注射诱导麻醉,后剔除大鼠胸壁毛,于大鼠左侧胸骨旁取左心长轴和左心室乳头肌短轴,采用彩色多普勒B超仪检测左心室舒张末期内径(LVEDD)、左心室收缩末期内径(LVESD)、左心室射血分数(LVEF)及左心室短轴缩短率(LVFS)。
1.3.3 VA诱发实验 两组大鼠均于心脏彩超检查完毕后进行VA诱发实验,具体操作如下:大鼠腹腔注射10%水合氯醛诱导麻醉,后固定于实验台,四肢皮下连接Ⅱ导联心电图(MD3000生物信号采集处理系统),之后将食管电极经食管插入至能捕获心室心电图的位置,电极尾端连接生物信号采集处理系统,通过刺激仪发出脉冲波以起搏左心室,脉冲波电压10 V,电流50 Hz,刺激时间60 s/次,重复两次,需要注意的是第2次电刺激前需确认大鼠心率已恢复至正常。以VA持续时间>2 s为VA诱发成功,VA持续时间>30 s为持续性VA[5]。
1.3.4 实时荧光定量聚合酶链式反应(RT-qPCR) 采用RT-qPCR检测两组大鼠22周龄时左心室心肌组织BAMBI、TGF-β1 mRNA相对表达量,具体操作如下:每组选取3只大鼠,安乐死后立即取出心脏,剪下左心室心肌组织约100 mg,加入1 ml预冷的Trizol并在冰上充分研磨,提取总RNA,后将提取的总RNA反转录为cDNA并置于-20 ℃冰箱中保存待测。采用Primer 5.0设计引物并由生工生物工程(上海)股份有限公司合成引物,采用SYBR GREEN qPCR Super Mix检测目的基因mRNA相对表达量,反应条件:50 ℃ 2 min,95 ℃2 min,95 ℃ 15 s,60 ℃ 32 s读板,共进行40个循环;融解曲线:温度65~95 ℃。以GAPDH为内参,按照2-ΔΔCt方法计算各目的基因mRNA相对表达量,实验重复3次并取平均值。BAMBI、TGF-β、GAPDH引物序列及大小见表1。
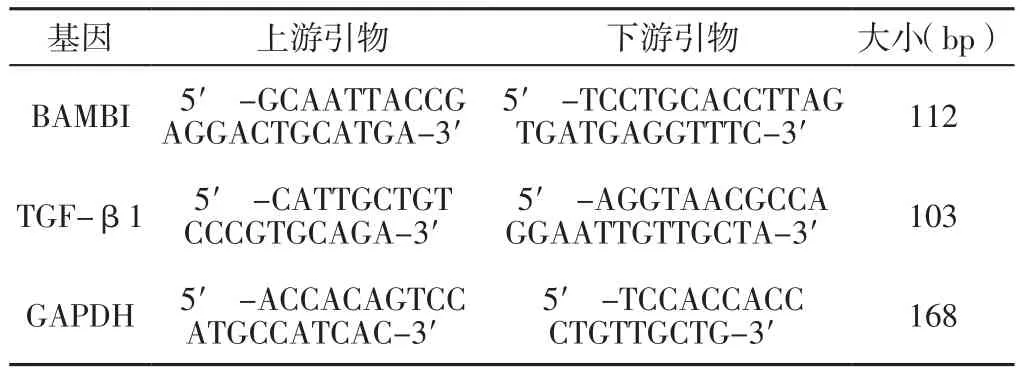
表1 BAMBI、TGF-β1、GAPDH引物序列及大小Table 1 Primer sequence and size of BAMBI,TGF-β1 and GAPDH
1.3.5 Western blotting 采用Western blotting检测两组大鼠22周龄时左心室心肌组织BAMBI、TGF-β1相对表达量,具体操作如下:每组选取3只大鼠,安乐死后立即取出心脏,将剪下的左心室心肌组织(约100 mg)剪碎并按照20 mg∶150~250 μl的比例加入裂解液,采用匀浆器匀浆直至其完全裂解。裂解后的样品于4 ℃环境下12 000×g离心15 min,取上清液进行蛋白质定量检测,然后置于-80 ℃冰箱中保存。采用12%聚丙烯酰胺凝胶电泳后将蛋白转移至PVDF膜上,置于5%脱脂奶粉中4 ℃过夜,分别加入一抗(1∶500稀释的BAMBI抗体和1∶2 000稀释的TGF-β1抗体)和1∶1 500稀释的β-actin抗体,4 ℃孵育过夜。采用TBST洗涤3次,后加入1∶1 500稀释的山羊抗兔IgG二抗并于室温下孵育1 h,然后采用TBST洗膜3次。将膜与ECL反应1~5 min后曝光于感光胶片上,显影、定影。BAMBI、TGF-β1相对表达量=目的蛋白灰度值/内参蛋白灰度值。
1.3.6 免疫组化染色法 将两组大鼠安乐死后剪下的左心室心肌组织用10%中性甲醛溶液固定,然后进行常规石蜡包埋,切片,厚度大约为4 μm,将石蜡切片常规脱蜡至水,采用免疫组化染色法定性观察左心室心肌组织中BAMBI、TGF-β1表达情况,具体如下:(1)抗原修复:将组织切片置于盛满柠檬酸抗原修复缓冲液的修复盒中,并置于微波炉内进行抗原修复,自然冷却后将玻片置于PBS(pH值为7.4)中,在脱色摇床上晃动洗涤3次,5 min/次。(2)阻断内源性过氧化物酶:切片放入3%双氧水溶液,室温避光孵育25 min,然后将玻片置于PBS中,在脱色摇床上晃动洗涤3次,5 min/次。(3)血清封闭:在组化圈内滴加3% BSA均匀覆盖组织,室温封闭30 min。(4)加一抗。(5)加二抗。(6)DAB显色:将玻片置于PBS中,在脱色摇床上晃动洗涤3次,5 min/次,切片稍甩干后在组化圈内滴加新鲜配制的DAB显色液,显微镜下控制显色时间,阳性为棕黄色,自来水冲洗切片终止显色。(7)复染细胞核:苏木素复染3 min左右,自来水冲洗,苏木素分化液分化数秒,自来水冲洗,苏木素返蓝液返蓝,流动水冲洗。(8)脱水封固。(9)显微镜镜检:图像采集分析。(10)苏木素复染:细胞核为蓝色,BAMBI、TGF-β1阳性表达为棕黄色。
1.4 统计学方法 采用SPSS 19.0统计软件进行数据处理。符合正态分布的计量资料以(± s)表示,组间比较采用两独立样本t检验;计数资料以相对数表示,组间比较采用χ2检验或Fisher's确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 收缩压、心率及心脏彩超检查结果 两组大鼠22周龄时心率和LVEDD比较,差异无统计学意义(P>0.05);实验组大鼠22周龄时收缩压高于对照组,LVESD大于对照组,LVEF和LVFS低于对照组,差异有统计学意义(P<0.05,见表2)。
2.2 VA诱发成功率 对照组大鼠22周龄时VA诱发成功率为16.7%(2/12);实验组大鼠22周龄时VA诱发成功率为66.7%(8/12),其中持续性VA诱发成功率为25.0%(2/8)。实验组大鼠22周龄时VA诱发成功率高于对照组,差异有统计学意义(χ2=4.286,P=0.038,见图1)。
2.3 BAMBI和TGF-β1 mRNA及其相对表达量 实验组大鼠22周龄时左心室心肌组织BAMBI、TGF-β1 mRNA及其相对表达量均高于对照组,差异有统计学意义(P<0.05,见表3、图2)。
2.4 免疫组化染色法结果 免疫组化染色法结果显示,BAMBI和TGF-β1主要在细胞质中表达,且实验组大鼠左心室心肌组织BAMBI和TGF-β1阳性表达多于对照组,见图3。
表2 两组大鼠22周龄时收缩压、心率及心脏彩超检查结果比较(± s)Table 2 Comparison of SBP,heart rate and color Doppler echocardiography examination results between the two groups at 22 weeks old
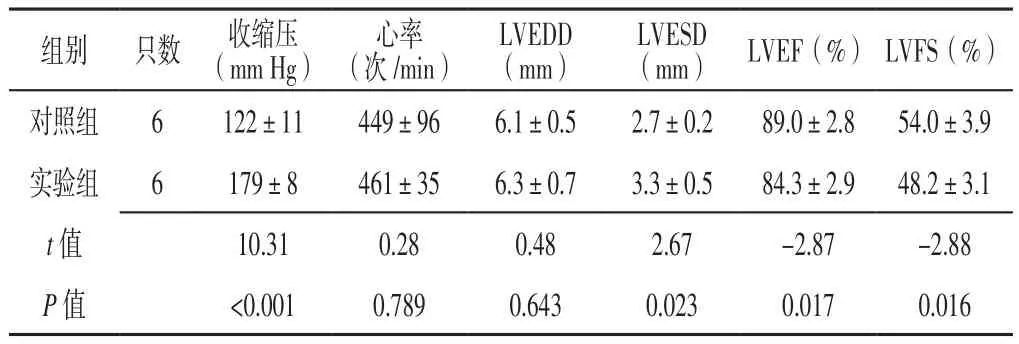
表2 两组大鼠22周龄时收缩压、心率及心脏彩超检查结果比较(± s)Table 2 Comparison of SBP,heart rate and color Doppler echocardiography examination results between the two groups at 22 weeks old
注:LVEDD=左心室舒张末期内径,LVESD=左心室收缩末期内径,LVEF=左心室射血分数,LVFS=左心室短轴缩短率
组别 只数 收缩压(mm Hg)心率(次/min)LVEDD(mm)LVESD(mm) LVEF(%) LVFS(%)对照组 6 122±11 449±96 6.1±0.5 2.7±0.2 89.0±2.8 54.0±3.9实验组 6 179±8 461±35 6.3±0.7 3.3±0.5 84.3±2.9 48.2±3.1 t值 10.31 0.28 0.48 2.67 -2.87 -2.88 P值 <0.001 0.789 0.643 0.023 0.017 0.016
表3 两组大鼠22周龄时左心室心肌组织BAMBI、TGF-β1 mRNA及其相对表达量比较(± s)Table 3 Comparison of BAMBI and TGF-β1 mRNA and their relative expression quantity in left ventricular myocardial tissue between the two groups at 22 weeks old
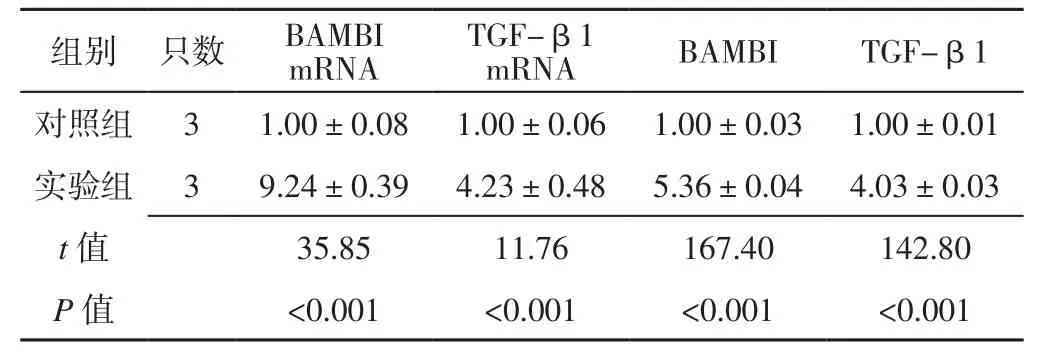
表3 两组大鼠22周龄时左心室心肌组织BAMBI、TGF-β1 mRNA及其相对表达量比较(± s)Table 3 Comparison of BAMBI and TGF-β1 mRNA and their relative expression quantity in left ventricular myocardial tissue between the two groups at 22 weeks old
m R N A T G F-β 1 m R N A B A M B I T G F-β 1对照组 3 1.0 0±0.0 8 1.0 0±0.0 6 1.0 0±0.0 3 1.0 0±0.0 1实验组 3 9.2 4±0.3 9 4.2 3±0.4 8 5.3 6±0.0 4 4.0 3±0.0 3 t值 3 5.8 5 1 1.7 6 1 6 7.4 0 1 4 2.8 0 P 值 <0.0 0 1 <0.0 0 1 <0.0 0 1 <0.0 0 1组别 只数 B A M B I
3 讨论
《中国心血管病报告2015》显示,我国高血压患者人数高达2.7亿,高血压患者数量庞大[6]。高血压与VA密切相关:高血压主要通过引起血流动力学改变、神经内分泌因素、心室重构(如心肌纤维化)等机制而引发VA[7];VA除引起血流动力学障碍外,还可导致高血压患者心脏机械功能恶化,加重高血压患者病情。因此,防治高血压患者发生VA尤为重要,而《高血压与心律失常2017年欧洲专家共识》曾指出,降低心肌纤维化是高血压合并VA治疗急需解决的问题之一[8]。
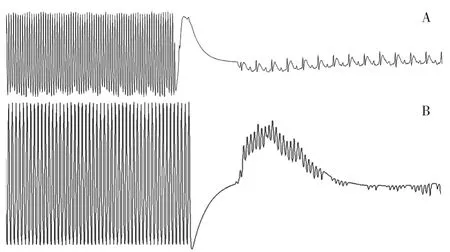
图1 VA诱发实验心电图表现Figure 1 ECG performance of VA induced experiment
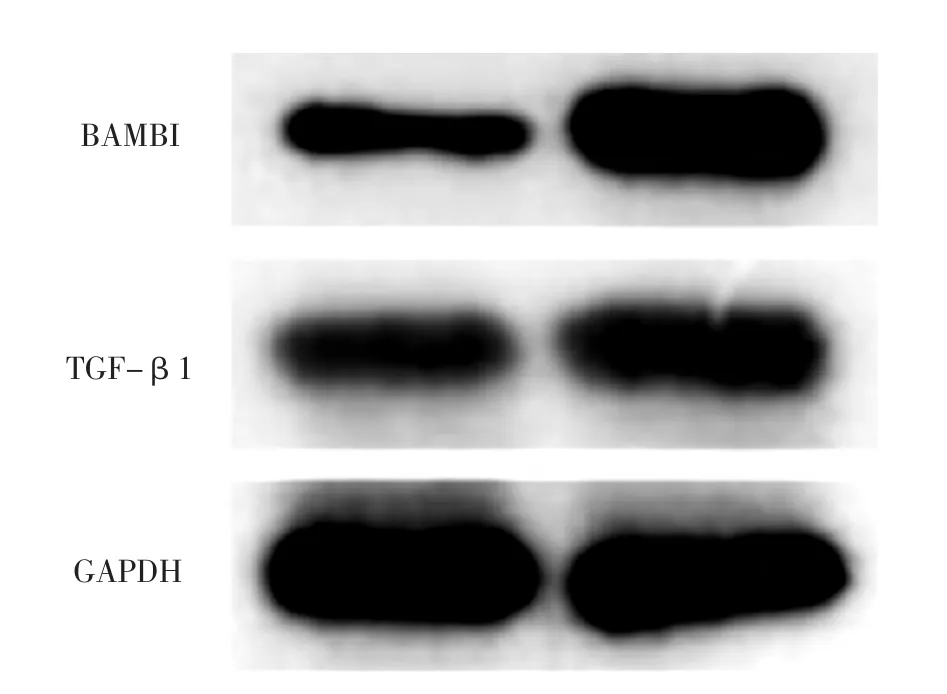
图2 两组大鼠22周龄时左心室心肌组织BAMBI、TGF-β1电泳图Figure 2 Electrophoretogram for BAMBI and TGF-β1 in left ventricular myocardial tissue in the two groups at 22 weeks old
目前研究表明,心脏压力超负荷状态下心肌组织BAMBI表达上调,并通过下调TGF-β1表达而对抗心肌纤维化,进而发生与当前血流动力负荷状况“平衡”的稳健重塑反应[3]。但目前BAMBI对高血压左心室重构的影响及其与高血压后VA的关系研究报道少见,本研究主要探讨了自发性高血压大鼠左心室心肌组织BAMBI、TGF-β1表达情况及其与VA易感性的关系,旨在为高血压后VA的防治工作提供新的思路。
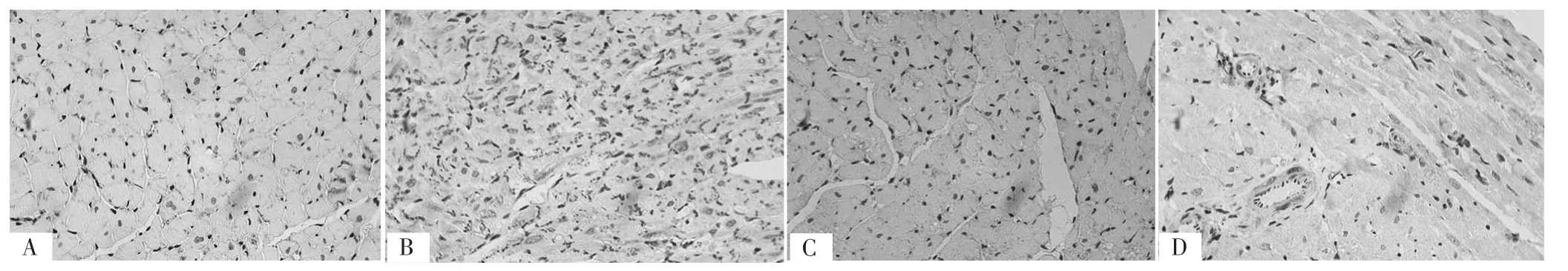
图3 两组大鼠22周龄时左心室心肌组织BAMBI、TGF-β1表达情况(免疫组化染色,×400,扫描本文首页OSID码可见高清彩图)Figure 3 Expressions of BAMBI and TGF-β1 in left ventricular myocardial tissue in the two groups at 22 weeks old
TGF-β是公认的器官纤维化因子,其在心脏组织中的表达水平与心肌纤维化程度呈正相关[9-10];BAMBI作为TGF-β家族信号传导的负调节因子,可通过调节TGF-β在各个组织中的表达而参与调节与TGF-β相关的器官纤维化病理进程[11-13]。本研究结果显示,实验组大鼠22周龄时左心室心肌组织TGF-β1 mRNA及其相对表达量均高于对照组,提示22周龄自发性高血压大鼠左心室心肌组织中TGF-β1表达上调。本研究结果还显示,实验组大鼠22周龄时LVESD大于对照组,LVEF和LVFS低于对照组,提示22周龄自发性高血压大鼠发生心室重构及心脏收缩功能下降,分析其原因可能为22周龄自发性高血压大鼠左心室心肌组织中TGF-β1表达上调引起左心室纤维化,进而导致心室重构及传导系统障碍,与既往研究结果相一致[14-15];但22周龄自发性高血压大鼠LVEF、LVFS在参考范围内,与LEGRICE等[16]研究结果一致,分析其原因可能与22周龄自发性高血压大鼠尚未进展到心脏功能失代偿期有关。本研究结果显示,实验组大鼠22周龄时VA诱发成功率高于对照组,提示22周龄自发性高血压大鼠VA易感性增加,分析其原因主要为TGF-β1表达上调增加心肌纤维化发生风险,而心肌纤维化又是VA发生的重要原因[17-19]。本研究结果还显示,实验组大鼠22周龄时左心室心肌组织BAMBI mRNA及其相对表达量均高于对照组,提示22周龄自发性高血压大鼠左心室心肌组织中BAMBI表达上调,与VILLAR等[3]研究结果一致,分析其原因主要为心脏压力负荷导致左心室心肌组织BAMBI表达上调,而BAMBI表达上调可在一定程度上对抗TGF-β1的致纤维化作用,具有心脏保护作用,因此BAMBI、TGF-β1均介导了自发性高血压大鼠左心室心肌纤维化,进而参与左心室重构;但BAMBI表达上调较TGF-β1表达上调更明显,具体原因尚需进一步探究。
综上所述,22周龄自发性高血压大鼠左心室心肌组织中BAMBI和TGF-β1表达上调可导致心肌纤维化加重、左心室重构,进而增加VA易感性,有望为高血压患者VA防治提供新的思路;但本实验动物数量较少,且未通过药物或病毒干预BAMBI表达而探究BAMBI对TGF-β信号通路的影响及其与VA的关系,这仍有待进一步研究。
作者贡献:梁宇明进行文章的构思与设计,研究的实施与可行性分析,数据收集、整理、分析,结果分析与解释,负责撰写论文,进行论文的修订;何燕负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
