白梨SPL转录因子在二次成花诱导中的响应
2020-05-25钟必凤邓家林李文贵张全军刘冬梅曲么日布
钟必凤,邓家林,李文贵,张全军*,刘冬梅,曲么日布
(1. 四川省农业科学院园艺研究所, 农业部西南地区园艺作物生物学及种质创制重点实验室, 四川 成都 610066;2. 江油市农业和畜牧局, 四川 江油 621700;3. 普格县农牧局 ,四川 普格 615300)
【研究意义】多年生木本植物,尤其是以生殖器官作为主要经济产出的果树类植物,成花发生情况直接关系到生产产品的产出和质量。高等植物的成花是由非常复杂的系统决定的,整合了自身遗传信息的表达信号以及外界条件的影响[1]。这一过程包括了细胞生理和形态分化两个过程。【前人研究进展】目前的研究表明,至少存在着光周期、春化反应、自主控制途径、赤霉素途径等多个不同的途径控制开花过程[2]。而这些过程可以彼此独立,也可以相互交错影响,将植物自身的发育信号与外界环境因子影响进行整合,共同决定营养生长到生殖生长的转变。SPL(SQUAMOSA promoter-binding protein like)是一类植物特有的转录因子,因其具有约80个氨基酸构成的SBP结构域,能结合到SQUAMOSA启动子上而得名[3]。研究表明,SPL蛋白在调控植物成花中起着重要的调控作用,参与了包括促进植物成年态转变[4]、调控GA信号转导[5]、连接光受体信号传递[2]、控制花器官形态发育[6]等一系列生理活动。通过整合miR156/157的调控功能,直接或间接影响成花有关蛋白[7]。【本研究切入点】在我国南方地区,梨正常花期在3-5月。但因为环境条件不适,如遭遇高温、干旱等胁迫,可以在当年8-10月再次开花(二次成花)。这一过程中,伴随着矿质养分、植物激素等多个水平的变化[8-9],同时也涉及到复杂的基因表达变化过程[10]。该现象的发生给成花机理研究提供良好的机会。课题组前期研究表明,在正常条件下,可以通过人工可控的摘叶过程模拟二次成花发生[10]。【拟解决的关键问题】本研究从梨全基因组的角度对SPL编码基因进行鉴定,同时关注其中在人工诱导二次成花过程中差异表达的成员,为继续深入研究SPL蛋白在花发育过程中的作用提供前期准备。
1 材料与方法
1.1 全基因组鉴定SPL蛋白编码基因
白梨基因组序列从梨基因组项目获得(南京农业大学)。从植物转录因子数据库(plantTFdb)下载已经鉴定的梨SPL蛋白家族成员序列。采用MAFFT软件(v7.27)进行序列比对,使用HMMER3.1构建隐马尔科夫模型。最后采用HMMSEARCH对全基因组进行SPL蛋白搜索(E<0.00001)。对搜索获得的候选SPL蛋白序列,提交NCBI保守结构域(CDD)数据库进行鉴定后进行人工校对。剔除候选蛋白中不含有SBP结构域的序列,同时也剔除编码基因中含有N的序列。
1.2 全基因组SPL蛋白的系统分类
对获得的SPL蛋白序列,采用MAFFT软件进行序列多重比对。采用IQTREE1.5.5软件进行系统发育树重建。其中氨基酸模型替代最优模型采用Modelfinder模块以贝叶斯信息指数为标准进行选择。对重建的系统发生树,采用fastbootstrap自展校验法评估单个进化分支拓扑结构的稳定性。
1.3 SPL的染色体定位
因目前没有完整的梨染色体水平基因组数据,因此选用了公开的scaffold水平白梨基因组[11]为参考,对SPL编码基因在每个scarfold上的物理排列进行绘图。
1.4 摘叶诱导二次成花转录组SPL编码基因差异表达分析
参考课题组前期工作[10],以容易出现二次花的梨品种‘丰水’为材料,在采收果实后人工摘除叶片诱导二次成花。分别于摘叶后7,17,27 d (DF7,DF17, DF27)采集花芽为材料提取总RNA和转录组文库构建和测序(由博奥生物有限公司完成)。同时以未进行成花诱导的相同时间点的芽为对照(C7, C17, C27)同样进行转录组分析。测序获得的原始数据,剔除含有N大于50 %,质量(Q-value)小于15的reads后,采用soap2软件()进行基因组回帖。每个编码基因对应回帖的reads数为基础,采用TPM算法进行单个基因表达量归一化。相同时间点的处理和对照组对应基因的表达量进行相对丰富度χ2检验。差异表达基因筛选标准为变异倍数大于2,且校正后的P-value小于0.001。
2 结果与分析
2.1 梨SPL全基因组鉴定
在植物转录因子数据库中,共包含了33个白梨SPL蛋白序列。以这些序列为特征,通过隐马尔科夫模型搜索,在整个基因组中共鉴定了36个候选SPL因子。人工校对过程中发现,1个候选因子不含有SBP结构域,1个候选因子编码基因中含有N,均予以剔除。最后全基因组鉴定的SPL蛋白编码基因如表1所示。这些蛋白分子量变化范围在11.5~128.1 kDa内。分子量最大的蛋白为Pbr041959.1。SPL蛋白等电点范围较广,其中Pbr026854.1达到了10.3,说明该蛋白带有较多带正电荷侧链,预示着其功能的特殊性。
2.2 SPL蛋白的系统分类分析
对获得的SPL蛋白序列,结合拟南芥SPL家族成员序列信息[12],采用IQTREE进行系统发育树重建。最优氨基酸替换模型JTT+F+R4构建的系统树如图1所示。总体上,SPL蛋白根据氨基酸相似序列一致性可以分为3个大的类群。其中类群I和II包含的蛋白最多,分别为16个和14个,而第III类中包含了2个梨SPL蛋白,与拟南芥SPL蛋白At1G02065.1起源于共同祖先基因。若进一步按进行类群划分,可以将34个梨SPL划分为8个小的进化支系,与Cai等[13]人对棉属植物SPL的划分一致。
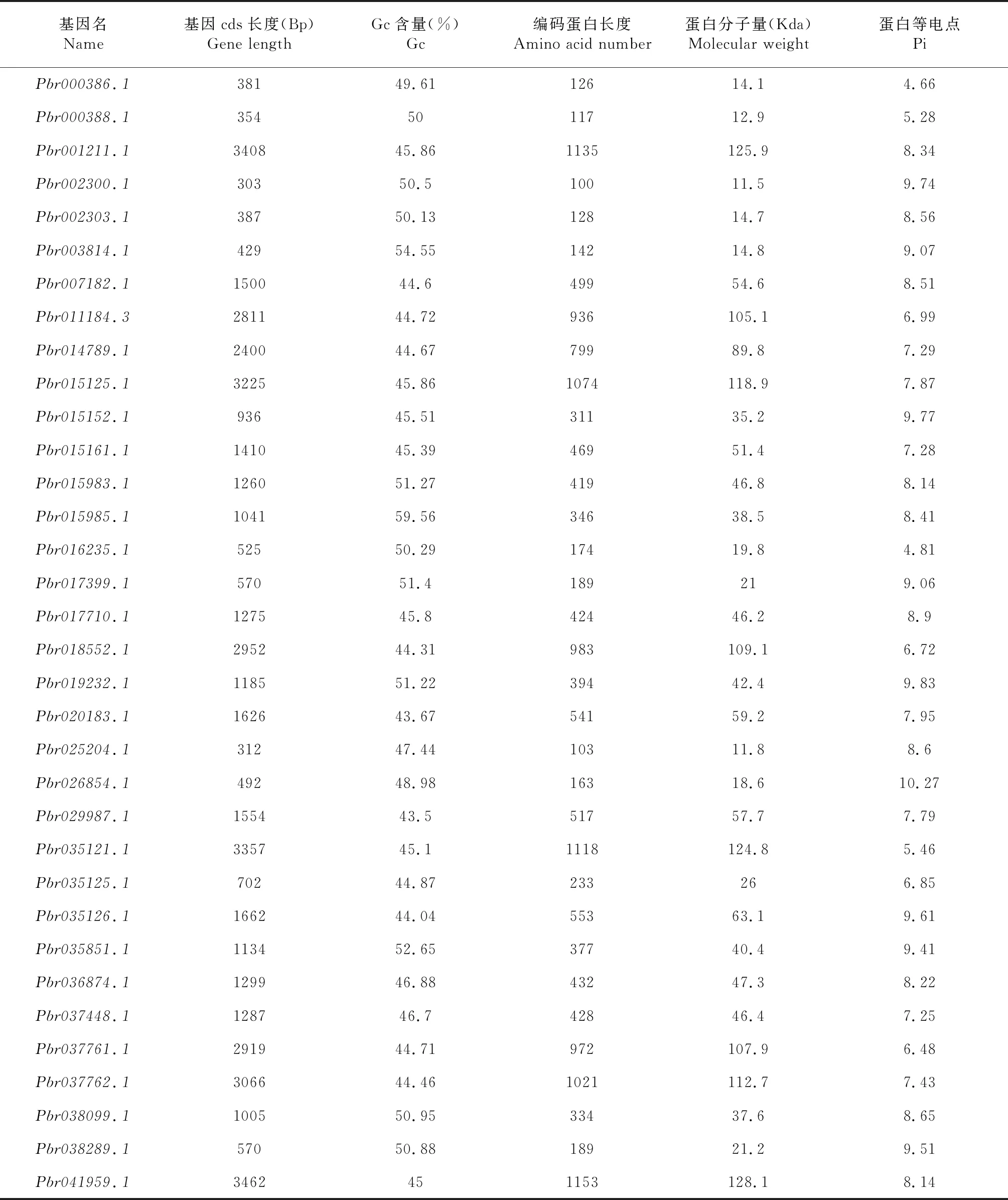
表1 梨全基因组SPL编码基因鉴定及其蛋白特征
2.3 SPL蛋白保守结构域分析
对获得的SPL编码蛋白序列,进一步进行保守蛋白结构域分析(图2)发现:绝大部分(29个)SPL蛋白仅含有该家族的特征结构域SBP位点。但少数SPL成员还拥有其他功能蛋白结构域,包括参与MYB-bHLH-WD40复合体的WD40结构域(Pbr011184.3),参与蛋白和蛋白互作的锚蛋白重复序列ANK(Pbr037762.1,Pbr015125.1,Pbr018552.1和Pbr037761.1)。这些典型的结构特征预示着他们可能与其他蛋白互作形成复合体行驶功能。
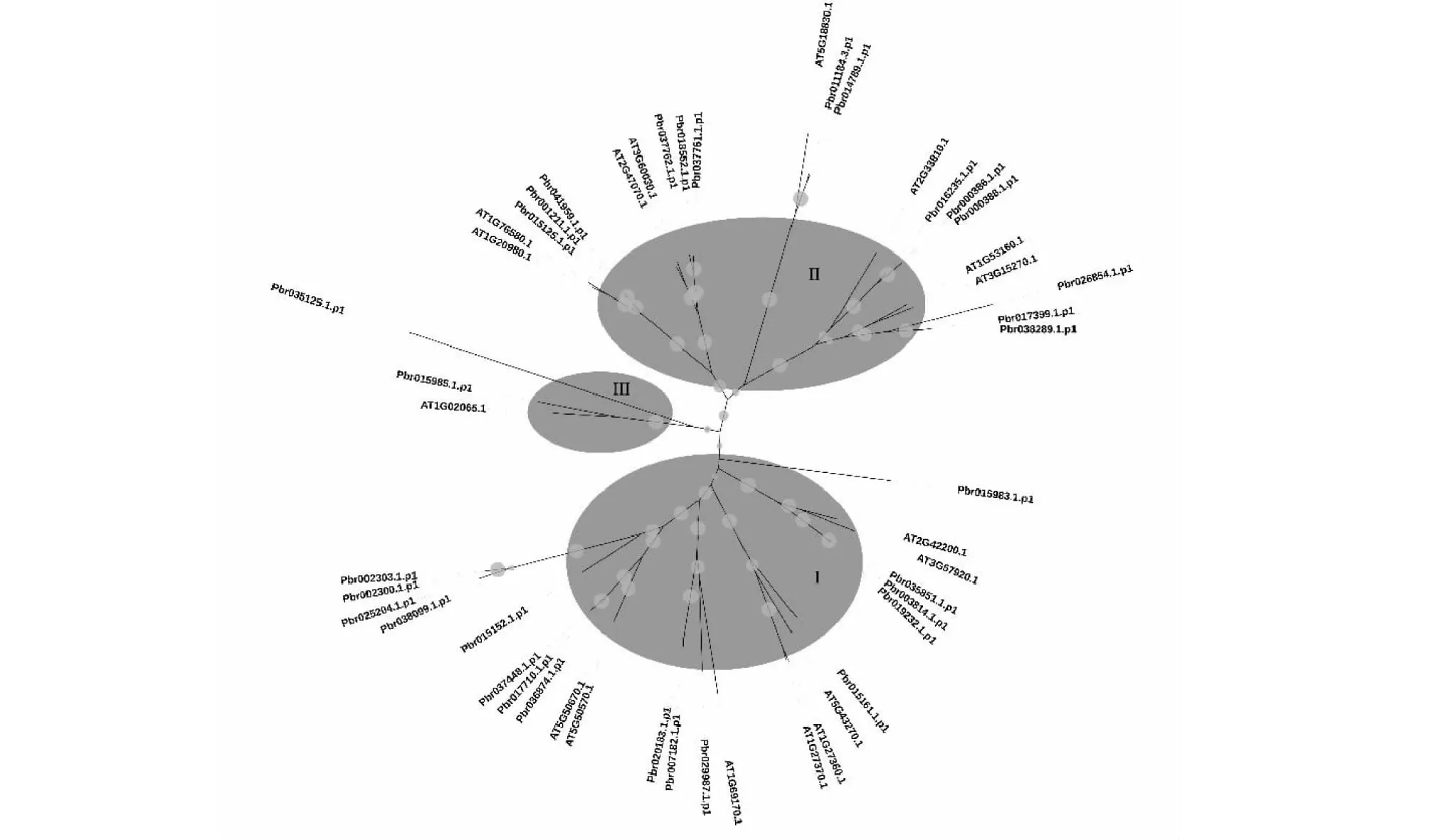
图1 基于SPL氨基酸序列的最大似然树

图2 SPL蛋白家族成员保守结构域分析
2.4 SPL编码基因的染色体定位情况分析
功能相关蛋白通常在染色体上集中排列[14]。以白梨公开的基因组序列为参考,34个鉴定的SPL编码基因分布在27个scaffold上(图3)。其中仅有scaffold67上串联排列了3个SPL编码基因,平均距离9088 bp。其余成簇排列的SPLs包括位于scaffold1上的Pbr000386.1和Pbr000388.1,scaffold1095上的Pbr002300.1和Pbr002303.1以及scaffold78上的Pbr037761.1和Pbr037762.1。有趣的是,这些成簇排列的SPLs一致性非常高,蛋白结构特征上仅含有少量差异。比如,Pbr03776.1仅比Pbr03762.1多1个ANK结构域。

图3 SPL编码基因在梨基因组scaffold上的分布情况
2.5 SPL基因在摘叶诱导二次花形成过程中的响应
在前期的研究中,已经发现通过人工摘叶处理,‘丰水‘梨可以在当年完成花芽分化,并在9月开花[9]。该结果证明了在摘叶处理后,芽经历了由营养生长到生殖细胞转变的生理分化和形态分化的完整过程。为了进一步挖掘可能参与了该过程的SPL转录因子,利用RNA-seq数据分析了34个SPL编码基因在成花诱导和未诱导条件下的差异表达情况。处理组合对照组在同一时间节点的比较发现,34个SPL编码基因表达模式明显可以归为两类(图4),21个SPL在整个观察时间段内表达量较高(TPM>4),其余的SPL基因为一类,在花芽中维持较低的表达水平。摘叶组和正常组基因差异表达分析仅鉴定出两个差异表达的基因(图4阴影高亮)。其中Pbr038289.1在摘叶处理27 d后被极显著诱导,而Pbr002303.1在摘叶处理初期被极显著抑制。在摘叶诱导成花中,27 d后花芽生理分化结束,形态分化已经非常明显,因此Pbr038289.1可能参与了花器官的发育过程或者配子育性的调控过程。而在成花诱导前期,Pbr002303.1可能在早期促花信号感应中起作用。
3 讨 论
现有的研究表明,SPL蛋白参与了植物胚胎发育、叶片、花和果实的发育,参与了赤霉素信号、光信号传递等多个生物性进程[15]。作为植物特有的转录因子家族,在不同的植物材料中包含的成员数有很大的差异。拟南芥的基因组中共鉴定出了17个SPL家族成员[12],烟草(Nicotianatabacum)基因组中包含有32个SPL编码基因[16],森林草莓基因组编码了14个SPL蛋白[17]。甚至在同属内,不同种的SPL数目也差异巨大。亚洲棉(Gossypiumarboreum)包含有29个编码基因,而陆地棉(G.hirsutum)则编码了59个SPL蛋白[13]。在本研究中,首次揭示了白梨基因组中的34个完整SPL蛋白编码基因。与拟南芥相比,数目激增。但不同物种中SPL蛋白进化类群数目较为接近,目前多数为8个亚类群[13, 17]。每个类群的扩张程度相较于拟南芥差异较大:如类群I中At5G50570.1所在的亚组中,拟南芥仅有两个成员,而梨中包含了8个成员。证明在进化过程中,SPL发生了显著的复制扩增,功能可能发生了分化。
尽管SPL蛋白家族成员氨基酸长度差异明显,但均包含高度保守的SBP结构域。在其他物种的研究中,除了SBP结构域以外,SPL成员可能还包括其他一至多个其他蛋白结构域。其中最为典型的是ALSLLS结构域,作为miRNA156调控的靶序列存在于SPL的C端[6]。在本研究中的34个成员中,有14个含有该位点(进化类群II的成员)。这些结构域的存在意味着他们在行驶生物性功能时能接受miRNA156的调控。在番茄中,超过半数的SPL基因都是miRNA156的调控靶标,其中CNR直接参与了花器官的发育过程[18]。除此以外,本研究还发现了一个包含WD40结构域的SPL蛋白。WD40蛋白通常情况下作为连接其它转录因子蛋白的中间体,蛋白不直接参与下游基因的转录激活过程[19],因此Pbr011184.3可能作为特定蛋白复合体中的一员参与了特定生物反应。

圆圈面积大小表示基因表达量高低(log2TPM), 差异表达的基因名用方框标出
Xiong等[17]在草莓SPL基因的组织和时空表达特性分析中发现,SPL基因表达情况差异较大。miRNA156靶向的SPL基因均表现出组织表达特异性,而其他均组成型表达。这表明,差异表达的SPL在特定时间发挥其作用。在本研究中,34个SPL编码基因在摘叶处理诱导成花过程中绝大部分表达变化不大。仅有2个差异表达的基因被鉴定出来(图4)。其中表达量较高的Pbr038289.1表达得到明显上调,进一步分析发现:该蛋白与苹果的SPL4蛋白一致性达到了97 %。在拟南芥中,SPL3/4/5蛋白能够整合发育信号,在miRNA156表达量下降的情况下转录水平明显上调,进而直接调控下游成花有关的蛋白如FD, LEAFY和FRUITFULL等编码基因的表达[20]。在摘叶诱导二次花形成的过程中,SPL基因Pbr038289.1表达量的上调是否受miRNA156的影响目前仍不清楚,有待进一步的研究确认。
4 结 论
本研究基于已有的白梨(PyrusbretschneideriRehd.)基因组数据,从全基因组范围对SPL转录因子编码基因进行了鉴定,共获得了34个典型的SPL蛋白家族成员,只有3个成员在目前的梨参考基因组上串联排列。系统进化分析将34个成员划归为8个进化类群,与其他物种SPL分类一致。结合前期二次花诱导过程的转录组数据分析发现:34个SPL蛋白编码基因中仅2个显著差异表达,其中Pbr038289.1显著上调表达,而Pbr002303.1表达量显著下降,这2个蛋白有望成为深入研究梨成花过程调控的重要靶点。
