薄膜分散法制备美洲大蠊提取物脂质体工艺研究
2020-05-25于永杰颜寅萍王旭吴俊珠
于永杰,颜寅萍,王旭,吴俊珠
(云南省昆虫生物医药研发重点实验室(大理大学),大理大学药学与化学学院,云南 大理)
0 引言
美洲大蠊为节肢动物门昆虫纲有翅亚纲蜚蠊目蜚蠊科大蠊属昆虫,民间俗称“蟑螂”,入药始载于《神农本草经》[1]。美洲大蠊提取物中所含的化学成分主要有尿嘧啶等核苷类、氨基酸类、多糖类、多肽等[2]。现代药理研究表明,美洲大蠊提取物具有促进组织修复、抗肝纤维化、提高免疫力、抗肿瘤、抗病毒、抗炎镇痛、改善微循环等作用[3]。近年来,对美洲大蠊提取物的研究和利用越来越多,上市制剂有康复新液、心脉隆注射液、肝龙胶囊、消癥益肝片等[4]。目前美洲大蠊提取物的剂型有胶囊、片剂、凝胶剂、软膏剂等剂型[5-6],关于美洲大蠊提取物脂质体的研究尚未见报道。脂质体是将药物包封于类脂双分子层中的超微型囊泡状药物载体,能够提高美洲大蠊提取物的滞留时间、增加病灶部位靶向性及掩盖药物的不良味道[7-8],本课题制备美洲大蠊提取物脂质体,以包封率为指标,通过正交实验优选处方及制备工艺,并考察最优工艺脂质体的外观、Zeta 电位、粒径等指标,为美洲大蠊提取物脂质体的制备和应用提供参考。
1 仪器与材料
1.1 仪器
CP224C 型分析天平(奥豪斯仪器有限公司);KQ5200DB 型超声波清洗器(昆山市超声仪器有限公司);Agilent1260 型高效液相色谱仪(G1315D 型DAD 检测器);RE-2000 型旋转蒸发器(上海亚荣生化仪器厂);TGL-20B 型数显高速离心机(上海安亭科学仪器厂);Tecnai-G20 型透射电镜(美国FEI 公司);ZS90 型纳米粒径电位分析仪(英国Malvern 公司)。
1.2 药物与试剂
美洲大蠊提取物(云南省昆虫生物医药研发重点实验室大理大学刘光明教授提供);尿嘧啶(中国食品药品检定研究院,批号100469-201302);大豆卵磷脂(国药集团化学试剂有限公司);胆固醇(国药集团化学试剂有限公司);三氯甲烷(天津利安隆博华医药化学有限公司);葡聚糖凝胶G-50(上海麦克林生化科技有限公司);乙腈(色谱纯,赛默飞世尔科技有限公司);其他试剂为分析纯。
2 方法与结果
2.1 美洲大蠊提取物脂质体的制备
分别称取适量大豆卵磷脂和胆固醇,置于茄型瓶中,用适量三氯甲烷使其充分溶解,减压抽滤旋转蒸发除去三氯甲烷,在瓶壁上形成均匀类脂薄膜。称取适量美洲大蠊提取物浸膏,用pH6.6 磷酸盐缓冲液( PBS)配成溶液,倒入上述茄形瓶10mL 含药PBS,常压旋转水化1.5h,经f0.45μm 微孔滤膜过滤,即得脂质体混悬液。
2.2 脂质体中指标成分含量测定
2.2.1 色谱条件
色 谱 柱:ZORBOX SB-C18 柱(250mm×4.6mm,5μm);检测波长254nm,流动相:水(A)-乙腈(B)梯度洗脱(0~2min,2%B;2~16min,7.3%B;16~20min,8%B;20~25min,2%B),流 速0.6mL·min-1,进样量20μL,柱温25℃。
2.2.2 供试品溶液的制备
精密吸取美洲大蠊提取物脂质体0.5mL 至10mL 容量瓶,用适量甲醇破乳,超声15min 后用pH6.6 PBS 定容,f0.22μm 微孔滤膜过滤,取续滤液,即得。于4℃保存,备用。
2.2.3 对照品溶液的制备
精密量取尿嘧啶标准品适量至容量瓶,超声溶解后用pH6.6 PBS 定容,即得。
2.2.4 专属性实验
取对照品与空白脂质体混合溶液,对照品溶液,空白脂质体溶液用适量甲醇处理后进样,结果证明脂质体辅料对含量测定无干扰。结果如图1。
2.2.5 标准曲线的建立
精密称取尿嘧啶标准品1.60mg,置于100mL 容量瓶中,用pH6.6 PBS 溶解,超声,待尿嘧啶完全溶解后定容,得16μg·mL-1贮备液,精密量取贮备液稀释成质量浓度分别为0.25,0.5,1,2,4,8,16μg·mL-1的系列标准溶液,按照2.2.1 项下色谱条件进行操作,测定色谱峰面积,以峰面积为纵坐标,以质量浓度为横坐标,绘制标准曲线,得到回归方程为Y=128.29X-12.193(R2=0.9999),尿嘧啶在0.25~16μg·mL-1范围内线性良好。
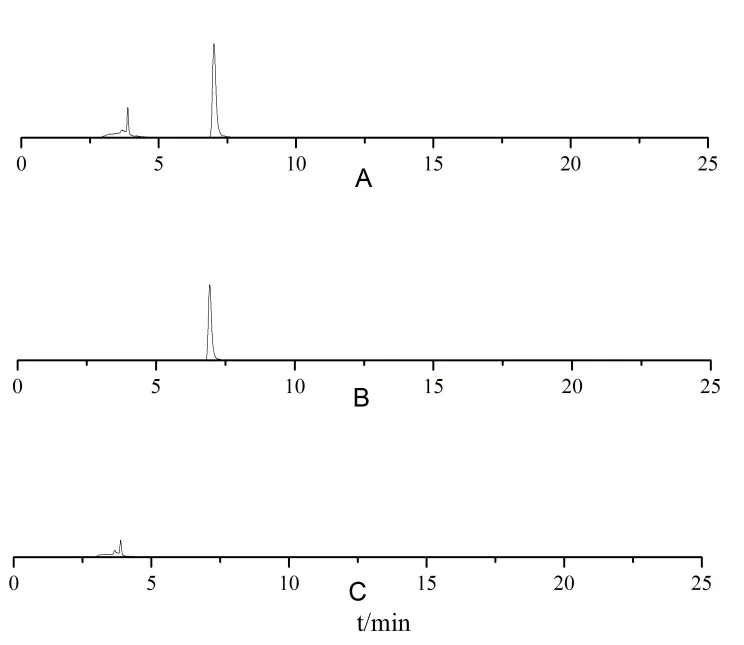
图1 专属性实验HPLC 色谱图
2.2.6 精密度实验
取对照品溶液,按2.2.1 项下色谱条件连续进样6 次,以尿嘧啶峰面积进行计算,RSD 为0.16%,表明仪器的精密度良好。
2.2.7 稳定性实验
取同一批供试品溶液,分别在0、2、4、6、8、10、12h 依次进样,以尿嘧啶峰面积进行计算,RSD 为1.6%,表明在12h 内供试品溶液稳定性良好。
2.2.8 重复性实验
平行制备6 份供试品溶液,按2.2.1 项下色谱条件分别进样6次,以尿嘧啶峰面积进行计算,RSD 为1.78%,表明该方法重复性良好。
2.2.9 加样回收率实验
精密吸取0.5mL 空白脂质体至10mL 容量瓶中,分别精密量取0.8、1.0、1.2mL 的16μg·mL-1的尿嘧啶对照品溶液,各平行3份,加入适量甲醇破乳,超声混匀后用PBS 定容至刻度,过滤后按2.2.1 项下色谱条件进样,得平均回收率为99.15%,RSD 为0.94%,表明此方法的加样回收率良好,结果见表1。
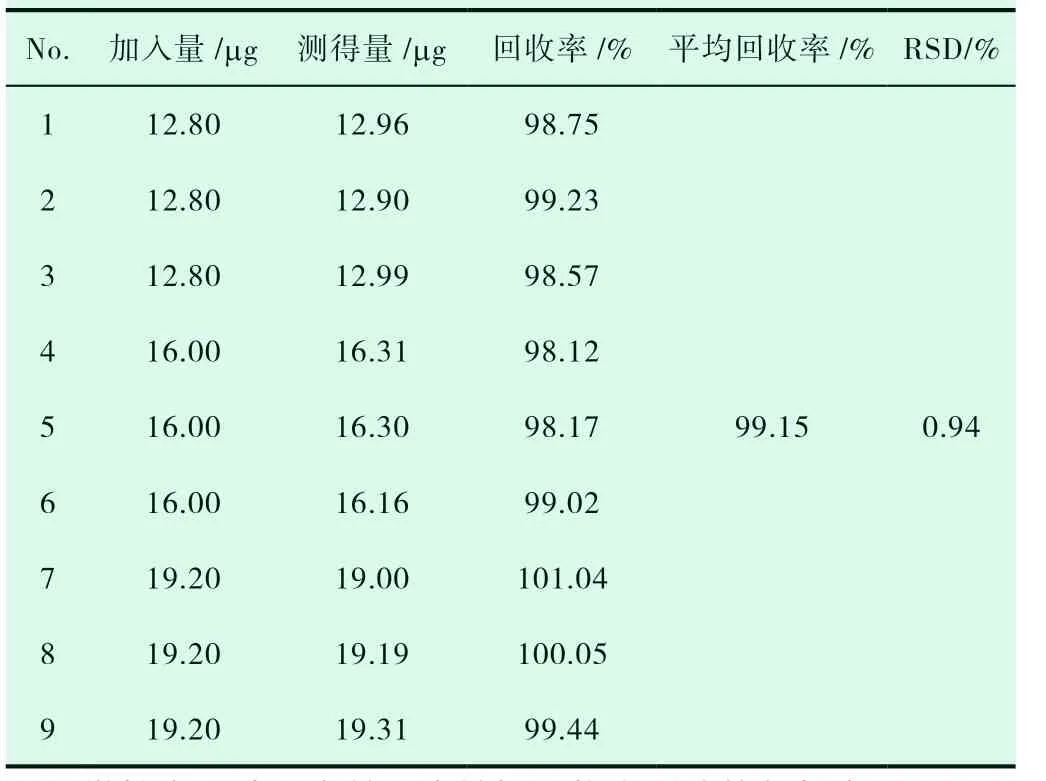
表1 加样回收实验结果(n=9)
2.3 微柱离心法测定美洲大蠊提取物脂质体的包封率
2.3.1 微柱的制备
取2.5mL 一次性注射器,将滤纸置于针筒管底防漏,然后倒入充分溶胀且除去气泡的葡聚糖凝胶G-50,4000r·min-1离心3min,除去多余PBS,即得微型柱,所得柱床高度与2.5mL 刻度线相平。
2.3.2 微柱离心法的洗脱条件
通过预实验,最终洗脱条件为:取0.5mL 脂质体混悬液缓慢添加于微柱的柱床上,4000r·min-1离心3min,得第一次滤液。然后加入0.5mL PBS,4000r·min-1离心3min,得第二次滤液。重复此操作三次,最后将以上五次滤液收集待测。
2.3.3 柱回收率实验
精密吸取空白脂质体0.5mL,缓慢添加于微柱的柱床上,按2.3.2 项下条件洗脱,将收集的滤液入10mL 容量瓶,用PBS 定容。以PBS 为空白对照,用紫外分光光度计检测500nm 波长处的吸光度(A1),另精密吸取空白脂质体0.5mL 入10mL 容量瓶,用PBS定容。同法测定500nm 波长处的吸光度(A2)。根据公式计算脂质体的柱回收率(%)=A1/A2×100%[9]。比较上柱前后吸光度的变化,结果见表2。

表2 空白脂质体柱回收率实验结果(n=3)
2.3.4 凝胶微柱对美洲大蠊提取物的吸附实验
精密吸取一定浓度的美洲大蠊提取物溶液0.5mL 加入到0.5mL 空白脂质体溶液中,将混合溶液缓慢添加于微柱的柱床上,按2.3.2 项下条件,将收集的滤液入10mL 容量瓶,破乳定容后经f0.22μm 微孔滤膜过滤,按2.2.1 项下色谱条件进样。另精密吸取同浓度美洲大蠊提取物溶液0.5mL 入10mL 容量瓶,同法进样检测。表明葡聚糖凝胶G-50 微柱可基本完全吸附游离药物。结果见表3。

表3 美洲大蠊提取物柱吸附实验结果(n=3)
2.3.5 包封率的测定
精密吸取美洲大蠊提取物脂质体混悬液0.5mL 缓慢添加于微柱的柱床上,按2.3.2 项下条件,收集滤液入10mL 容量瓶,加入适量甲醇破乳,超声15min 后用pH 6.6 PBS 定容,f0.22μm 微孔滤膜过滤,取续滤液按2.2.1 项下色谱条件进样。计算包封率(EE),EE(%)=( 上柱后脂质体中药物含量/上柱前脂质体中药物含量)× 100%[10]。
2.3.6 重复性试验
取同一批美洲大蠊提取物脂质体混悬液,按2.3.5 项下方法测定其包封率,重复3 次,结果分别为44.77%,45.63%,45.01%,RSD 为0.98%,符合测定要求。
2.4 制备工艺优化
在预实验基础上,选取大豆卵磷脂和胆固醇的质量比、卵磷脂和美洲大蠊提取物的质量比、有机溶剂体积、水化温度为考察因素,以美洲大蠊提取物中成分尿嘧啶的包封率为指标,通过正交实验优化美洲大蠊提取物脂质体的制备工艺,因素水平表见表4,正交试验安排及直观分析见表5,方差分析见表6。
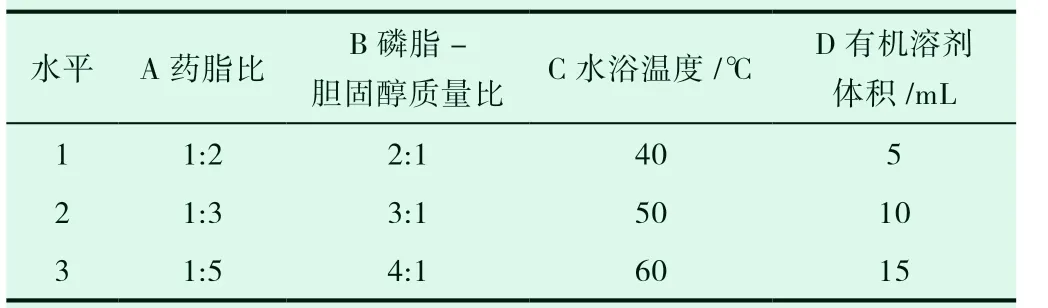
表4 美洲大蠊提取物脂质体制备工艺优化正交实验因素水平
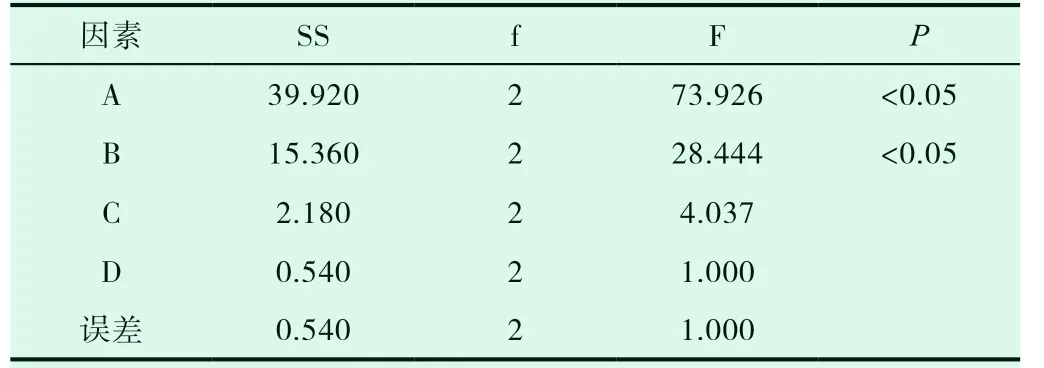
表6 方差分析
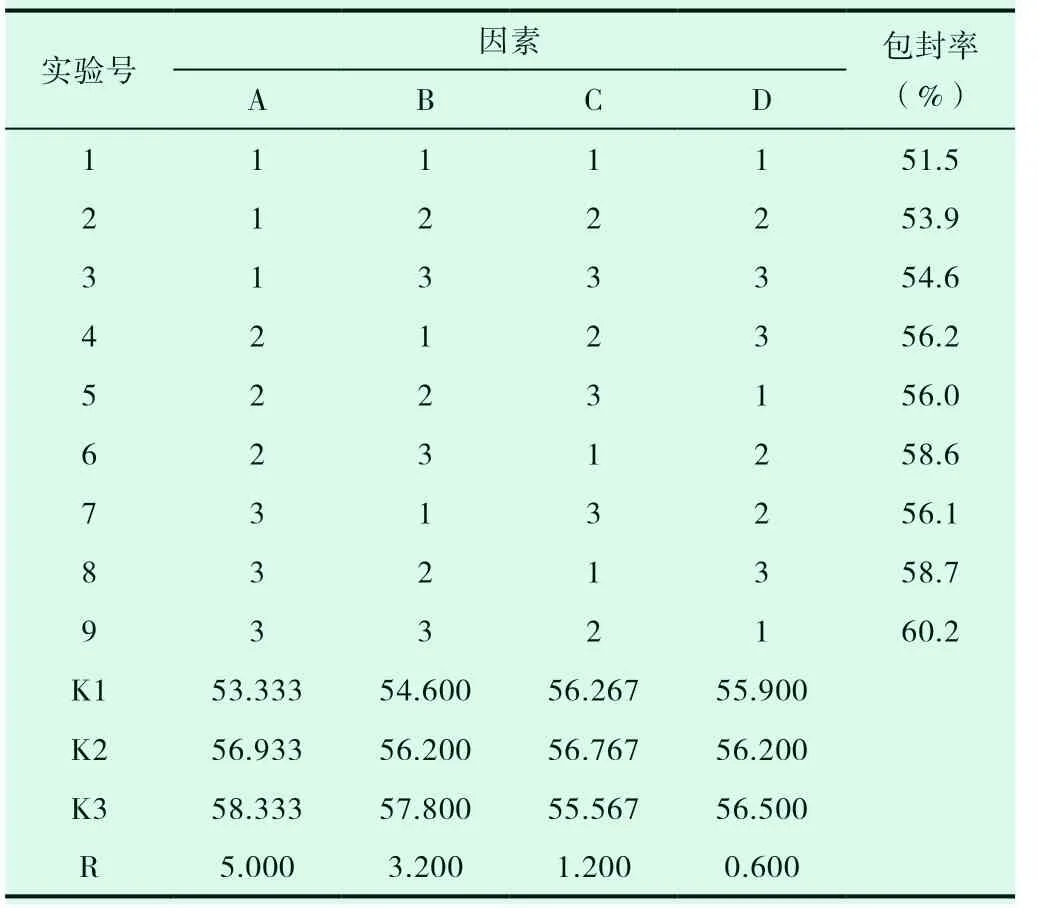
表5 美洲大蠊提取物脂质体工艺优化正交实验安排及直观分析
由直观分析可知,各因素对脂质体中尿嘧啶包封率的影响程度为A>B>C>D 。以极差最小的D 因素为误差项进行方差分析,结果发现因素A、B 具有显著性,最佳处方A3B3C2D2,即最佳处方为药脂比1:5,磷脂胆固醇质量比4:1,水浴温度50℃,有机溶剂体积10mL。
2.5 美洲大蠊提取物脂质体的体外性质表征
2.5.1 脂质体形态
取适量最佳工艺美洲大蠊提取物脂质体混悬液,用适量3%的磷钨酸负染,滴至铜网表面,待晾干后在透射电子显微镜下观察,结果显示脂质体外观接近球形,形态完整,粒径分布较为均匀,见图2。

图2 美洲大蠊提取物脂质体透射电镜图
2.5.2 粒径与Zeta 电位
取适量最佳处方美洲大蠊提取物脂质体混悬液稀释液,用纳米粒径电位分析仪检测,测得平均粒径233.7nm,多分散系数0.105,Zeta 电位为-28.3mV。
2.5.3 包封率
按最佳处方制备3 批美洲大蠊提取物脂质体,测定尿嘧啶包封率。所得包封率为(62.9±0.7)%,表明优选工艺所制备的脂质体包封率处于较稳定的水平。结果见表7。

表7 最佳处方包封率验证
3 讨论
美洲大蠊提取物中含有多种化学成分如核苷类、氨基酸类、多糖类、多肽类、油脂类等,核苷类物质是抗病毒、肿瘤等药物的中间体,有重要的生物活性[11]。故本实验选择了美洲大蠊提取物中含量较高的核苷类物质尿嘧啶作为包封率测定指标。本实验考察了甲醇、曲拉通X-100、氯仿等破乳剂对美洲大蠊提取物脂质体的破乳效果,结果证明破乳剂的量过大会使尿嘧啶的色谱峰分裂,最后选择甲醇作为破乳剂,加入量应少于样品10 倍量[12]。美洲大蠊提取物多为水溶性成分,故先尝试了逆相蒸发法制备脂质体,结果证明逆相蒸发法制备的脂质体包封率低且不稳定,后采用薄膜分散法制备美洲大蠊提取物脂质体。通过预实验及正交实验,确定了薄膜分散法制备美洲大蠊提取物脂质体的最佳工艺。最佳处方为药脂比1:5,磷脂胆固醇质量比4:1,水浴温度50℃,三氯甲烷体积10mL。用该方法制备美洲大蠊提取物脂质体简便可行,可为美洲大蠊提取物的制剂研究提供参考。
