超声提取藜麦β-蜕皮激素的工艺研究
2020-05-24郑雅莹马挺军
郑雅莹 马挺军
(北京农学院食品科学与工程学院,北京 102206)
藜麦(ChenopodiumquinoaWilld.)又名昆诺阿藜、南美藜等,为一年生藜科草本植物[1]。藜麦籽粒的营养价值丰富,蛋白质质量分数高达12.5%~16.7%,且必需氨基酸比例均衡,其中富含的组氨酸为婴幼儿所必需的氨基酸[2];藜麦中淀粉质量分数为58.1%~64.2%,但其血糖生成指数较低,适于糖尿病人食用[3];藜麦籽粒中矿物质含量高,Ca和Fe含量高于小麦、玉米等谷物[4]。藜麦中富含具有抗衰老作用的维生素C和维生素E[5]以及不饱和脂肪酸[6]。同时,藜麦籽粒中含有黄酮、皂苷、多酚、γ-氨基丁酸以及蜕皮激素[7-10]等具有生物活性的功能成分。因此藜麦具有降血糖、抗氧化以及抗癌等生理功能[11]。因而被誉为“营养黄金”[12]。
蜕皮激素是一类天然甾体化合物,既存在于昆虫体内为昆虫换羽激素,又存在于植物中为植物次生代谢产物—植物蜕皮激素,保护植物免受昆虫和线虫的侵害[13]。蜕皮激素对哺乳动物和人类具有多种药理作用,如抗氧化、促进核酸和蛋白质的合成、促进糖代谢和脂类代谢、预防骨质疏松、促进表皮细胞分化等作用[14,15]。蜕皮激素在植物中的含量远高于在动物体内的含量,且只有少数食用植物中存在蜕皮激素,包括菠菜、藜科以及薯蓣,其中藜麦中β-蜕皮激素含量为0.184~0.484 mg/g,是菠菜的4~12倍[16-19]。β-蜕皮激素(又称20-羟基蜕皮激素或蜕皮甾酮,20-hydroxyecdysone)是藜麦中最主要的蜕皮激素,还有一些微量单体,如罗汉松甾酮A、24-epi-罗汉松甾酮A、24(28)-dehydro-蜕皮甾酮A等[20],其结构式如图1所示。
β-蜕皮激素的提取方法有超声法、溶剂回流提取法和浸提法[21]。李红舟[22]研究超声法对露水草β-蜕皮激素的提取工艺,优化料液比、提取液体积分数、提取时间以及提取温度,得到β-蜕皮激素得率为1.9%;徐慧[23]研究蓝耳草β-蜕皮激素的提取工艺,通过对比超声提取和回流提取法,得到β-蜕皮激素得率分别为0.034%和0.041%。Graf等[24]采用浸提法提取藜麦β-蜕皮激素,在80 ℃下,用70%乙醇提取4 h,β-蜕皮激素的得率为0.031%。超声提取法较浸提法和溶剂回流提取法具有处理时间短、提取温度低等优势,且对甾体类化合物的提取效果较好,适合β-蜕皮激素的提取。
本实验以藜麦为原料,采用响应面法优化超声提取β-蜕皮激素的工艺条件,利用高效液相色谱法测定β-蜕皮激素含量,同时测定其体外抗氧化活性,为藜麦蜕皮激素类物质的进一步研究与开发利用提供参考。

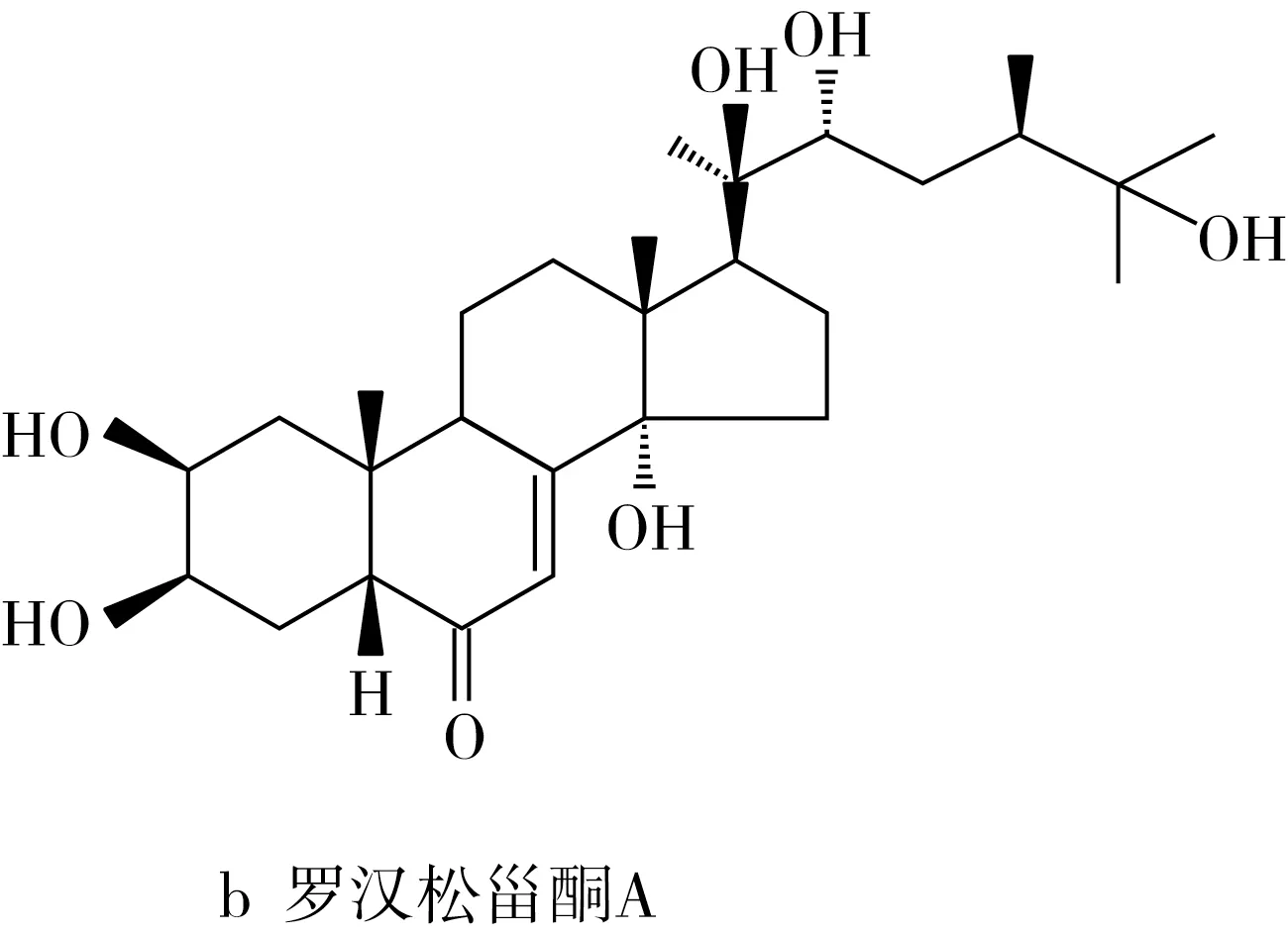

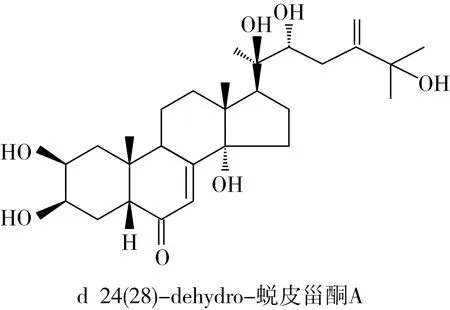
图1 藜麦中主要蜕皮激素化合物的结构
1 材料与方法
1.1 材料与试剂
“冀藜1号”藜麦:河北张家口农业科学院;β-蜕皮激素标准品、ABTS、甲醇(色谱纯)、超纯水、无水乙醇(分析纯)、磷酸二氢钾、磷酸氢二钠;维生素C 。
1.2 仪器与设备
KQ-700E型超声波清洗器;常规冷凝装置;SH B-Ⅲ循环水式多用真空泵;TDZ5M型台式低速离心机;DH-101型电热恒温鼓风干燥箱;德尔高速粉碎机;旋转蒸发器RE-2000;Shimadzu LC-20AD液相色谱。
1.3 方法
1.3.1 藜麦β-蜕皮激素的提取及其含量测定
准确称取藜麦粉1.0 g,按一定液料比加入乙醇溶液,30 ℃下于700 W、40 kHz下超声,4 000 r/min离心10 min,取上清液,旋蒸至干,加入甲醇重溶,过0.22 μm有机滤膜,待测。
色谱条件:色谱柱:TC-C18(150 mm×4.6 mm,5 μm);流动相:甲醇:水=40:60(V/V,%);流速:0.8 mL/min;检测波长:246 nm;柱温:31 ℃;进样量:10 μL。
1.3.2 β-蜕皮激素标准曲线的绘制
准确配制0.005、0.01、0.02、0.04、0.08 mg/mL的β-蜕皮激素标准溶液,根据色谱图中峰面积计算β-蜕皮激素含量,实验重复3次,计算平均值,以色谱图中峰面积为纵坐标y,以待测样品质量浓度为横坐标x绘制标准曲线,如图2所示。回归方程为y=2×107x+9075.5(R2=0.999 7),数据显示曲线拟合性良好。
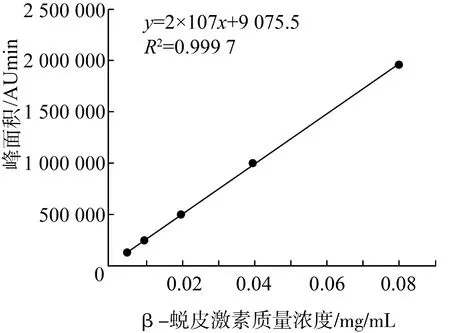
图2 β-蜕皮激素标准曲线
1.3.3 单因素实验
1.3.3.1 乙醇体积分数的选择
精确称取藜麦粉1.0 g于50 mL离心管中,分别加入50%、60%、70%、80%、90%乙醇水溶液10 mL,在30 ℃下超声提取30 min,离心取上清液,旋蒸至干,加入甲醇5 mL重溶,过0.22 μm有机滤膜,待测。
1.3.3.2 超声时间的选择
精确称取藜麦粉1.0 g于50 mL离心管中,加入60%乙醇水溶液10 mL,在30 ℃下分别超声提取10、20、30、40、50 min,离心取上清液,旋蒸至干,加入甲醇5 mL重溶,过0.22 μm有机滤膜,待测。
1.3.3.3 液料比的选择
精确称取藜麦粉1.0 g于50 mL离心管中,分别按照2∶1、6∶1、10∶1、14∶1、18∶1(mg/L)的液料比加入60%乙醇水溶液,在30 ℃下超声提取30 min,离心取上清液,旋蒸至干,加入甲醇5 mL重溶,过0.22 μm有机滤膜,待测。
1.3.4 Box-Behnken响应面优化设计
根据Box-Behnken实验设计原理进行三因素三水平实验设计,采用Design-Expert 8.0.6软件进行数据拟合,优化藜麦中β-蜕皮激素含量的工艺条件。在单因素实验的基础上,选择乙醇体积分数(A)、超声提取时间(B)、液料比(C)作为响应面优化的实验点,分别以-1、0、1对自变量的实验水平编码,共有17组实验,其中12组为析因点;5组为区域的中心零点。实验因素和水平见表1。

表1 Box-Behnken实验设计因素和水平
1.3.5 藜麦β-蜕皮激素体外抗氧化实验—ABTS自由基清除实验
根据宋思圆[25]的方法改进,过硫酸钾与ABTS溶液混合,室温避光反应12~16 h,制备得到ABTS储备液。用磷酸盐缓冲液(pH 7.4)稀释ABTS储备液,直至在734 nm的吸光度为0.70±0.02。取4 mL ABTS测定液,加入40 μL样品待测液,振荡30 s,避光反应30 min后测定734 nm处的吸光度值,平行测定3次,取平均值。

2 结果与分析
2.1 单因素实验结果
2.1.1 乙醇体积分数对藜麦中β-蜕皮激素含量的影响
由图3可知,藜麦中β-蜕皮激素提取量随着乙醇体积分数的升高,呈先上升后下降的趋势。当乙醇体积分数达到60%时,藜麦中β-蜕皮激素的提取效果相对较好,为0.358 7 mg/g。而当乙醇体积分数超过60%时,β-蜕皮激素的提取量逐渐下降。根据相似相溶原理,β-蜕皮激素为弱极性物质,易溶于乙醇,而其结构中含有6个羟基,能溶于水。因此得到乙醇体积分数为60%时,β-蜕皮激素提取量最大。
2.1.2 超声时间对藜麦中β-蜕皮激素含量的影响
如图3所示,超声时间在10~30 min内,随着超声时间的延长,β-蜕皮激素质量浓度呈上升趋势,达到30 min时β-蜕皮激素提取量最高,为0.324 6 mg/g。当超声时间大于30 min时,β-蜕皮激素提取量呈先下降后上升的趋势。这可能是超声时间过长导致β-蜕皮激素发生分子重排,使其在40 min时提取量降低;当超声时间延长至50 min时,在超声处理的作用下,β-蜕皮激素分子中负责分子重排的结构单元合成β-蜕皮激素类似物,使其提取量增加,但并未超过峰值[26]。因此,超声时间选择30 min左右。
2.1.3 料液比对藜麦中β-蜕皮激素含量的影响
如图3所示,乙醇体积分数为60%、超声时间为30 min时,液料比在2∶1~14∶1范围内,β-蜕皮激素提取量呈逐渐上升的趋势,当液料比达到14∶1时,β-蜕皮激素含量为0.376 6 mg/g。当液料比大于14∶1时,β-蜕皮激素提取量趋于平缓。这表明液料比继续增大时,对β-蜕皮激素质量浓度影响不显著。因此,将液料比确定为14∶1。
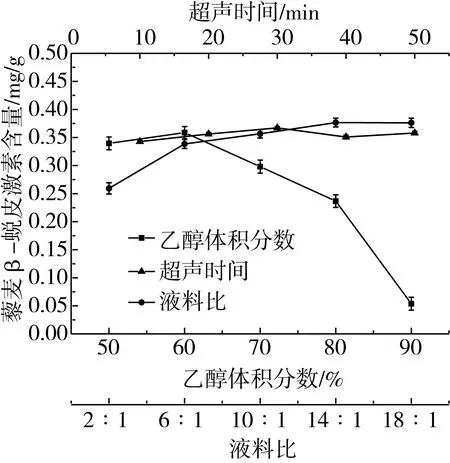
图3 超声时间、乙醇体积分数、液料比对藜麦β-蜕皮激素含量的影响
2.2 响应面实验结果
2.2.1 Box-Behnken实验设计及结果分析
综合单因素实验结果,以藜麦β-蜕皮激素质量浓度为响应值,考察乙醇体积分数(A)、超声时间(B)、液料比(C)三个因素对其影响,采用Design-Expert 8.0.6软件的Box-Behnken设计三因素三水平实验,实验设计方案及结果见表2。
2.2.2 回归模型的建立及显著性检验结果
利用Design-Expert 8.0.6软件对表2数据进行响应面回归分析,建立藜麦β-蜕皮激素含量(Y)的回归模型,拟合二次多项式方程:
Y=0.38-0.017A+0.012B+4.013×10-3C-4.975×10-3AB+0.016AC-4.075×10-3BC-0.051A2-0.048B2-0.034C2
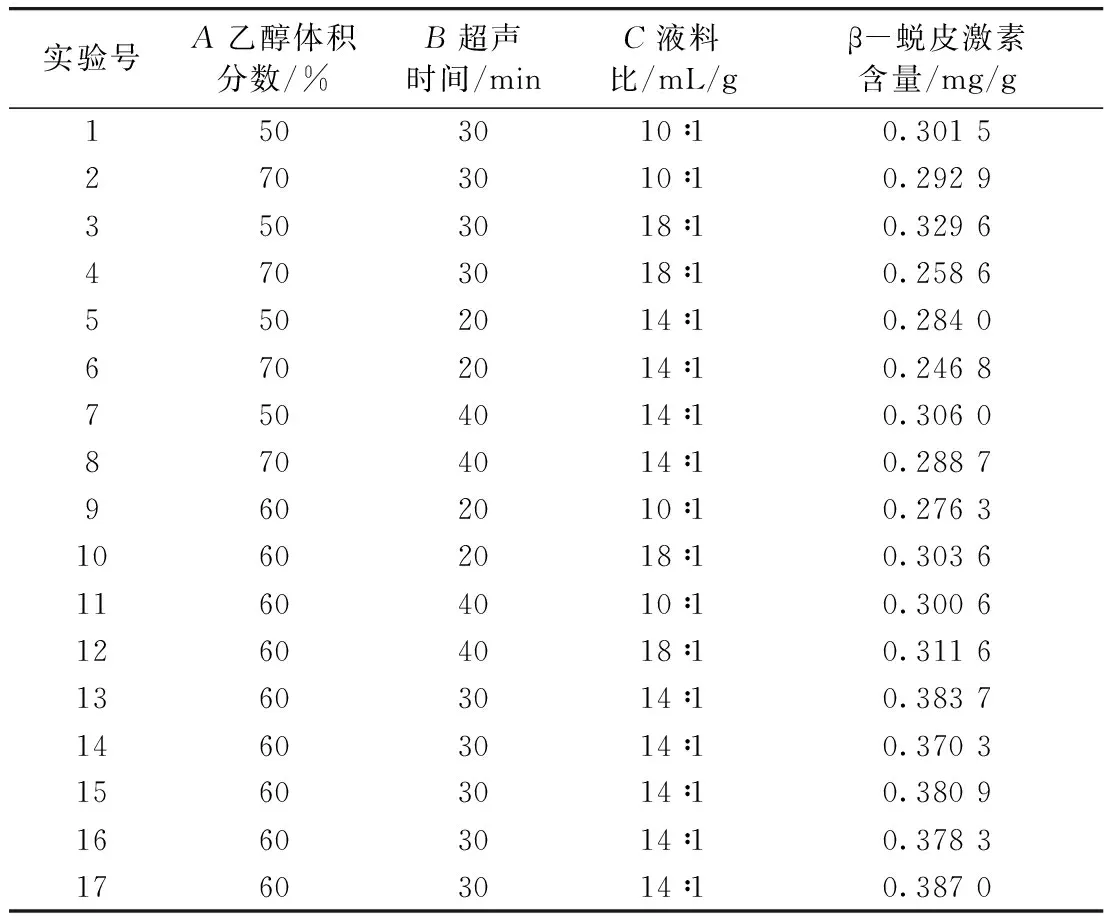
表2 响应面设计方案及实验结果
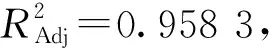
Y=0.38-0.017A+0.012B+0.016AC-0.051A2-0.048B2-0.034C2
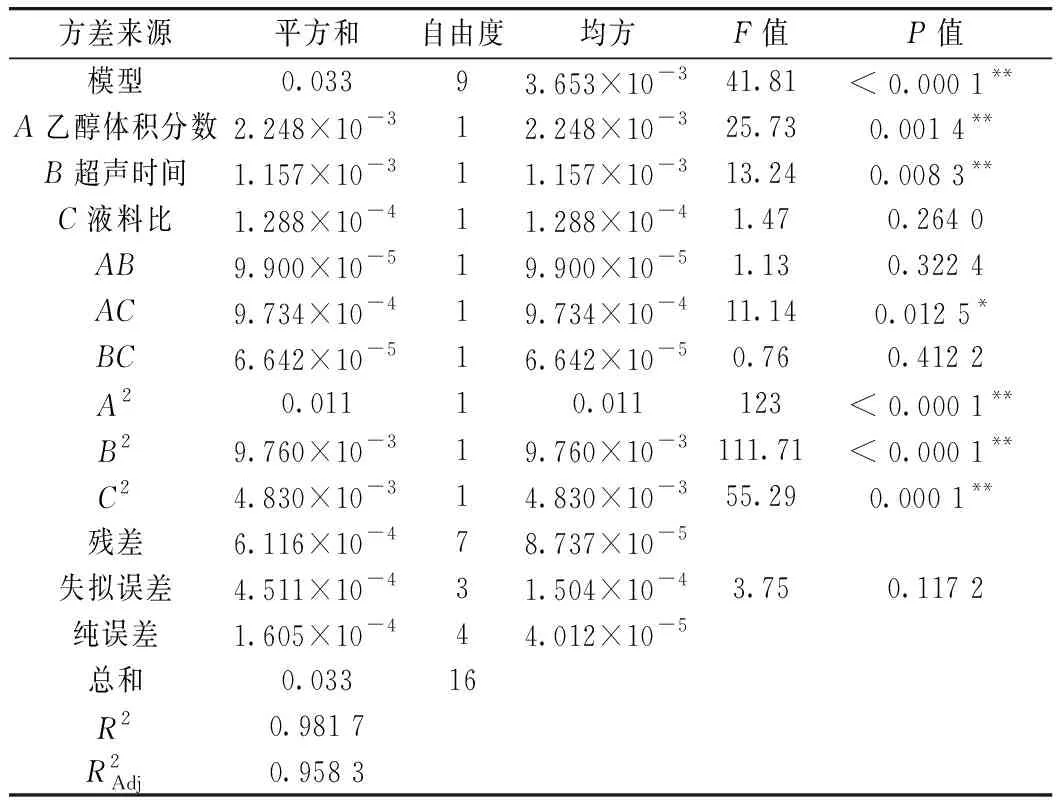
表3 回归模型显著性检验结果
注:**差异极显著(P<0.01);*差异显著(P<0.05)。
2.2.3 响应面分析
由图4a可知,在液料比为14∶1的条件下,乙醇体积分数与超声时间的交互作用较弱。当固定乙醇体积分数时,随着超声时间的延长,藜麦中β-蜕皮激素含量增大,但达到峰值后又呈下降趋势。图4b显示,在超声时间为30 min条件下,乙醇体积分数与液料比交互作用显著,在液料比较小时,β-蜕皮激素含量随乙醇体积分数的增加而增加,达到峰值逐渐下降。由图4c可知,在乙醇体积分数为60%时,超声时间和液料比的交互作用较弱。说明超声时间对β-蜕皮激素含量产生的影响与液料比的关系较小。
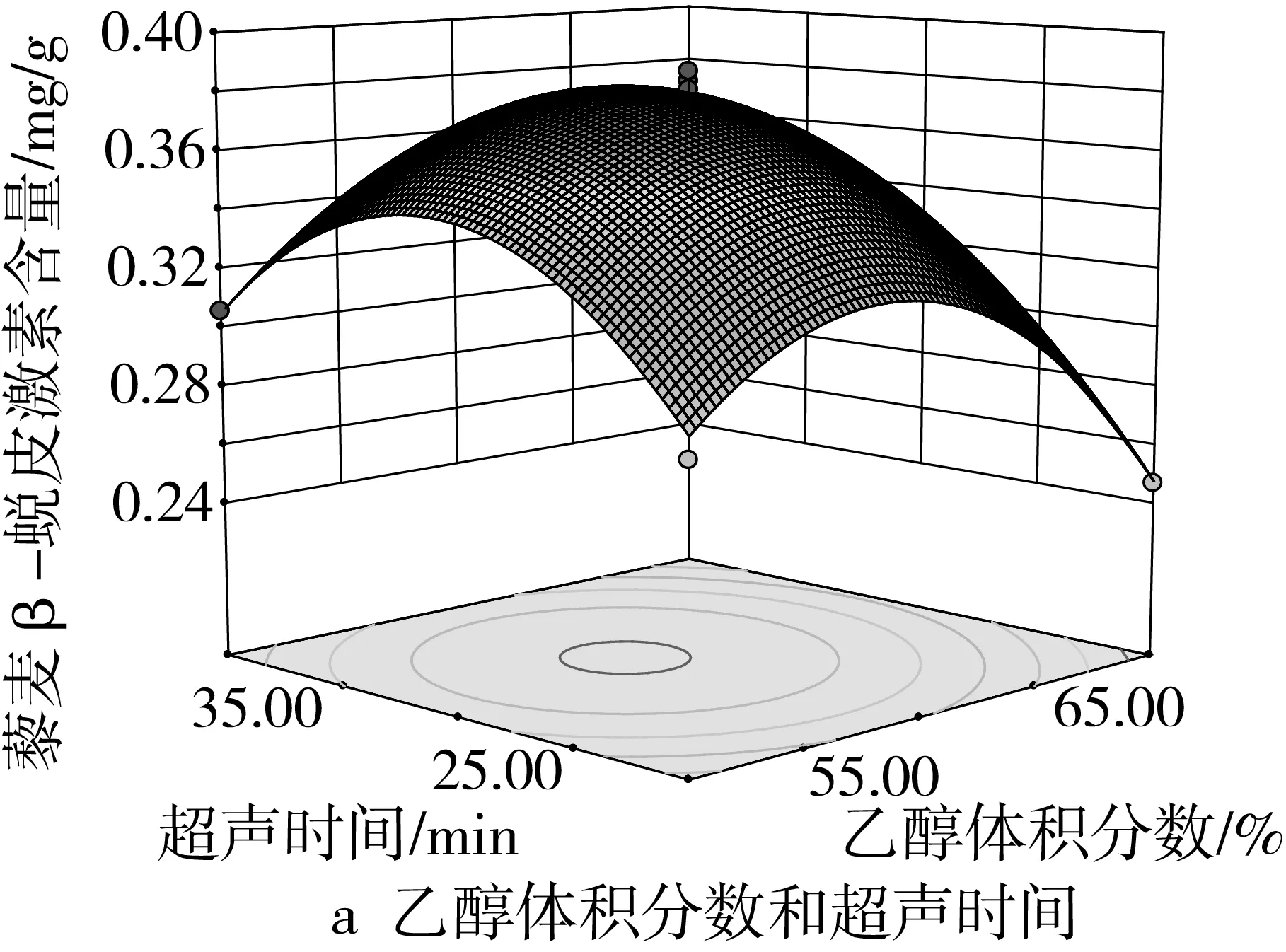
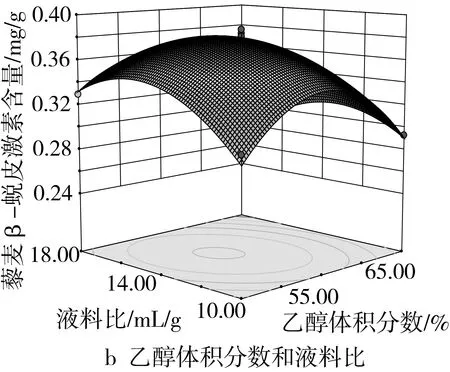

图4 各因素交互作用对β-蜕皮激素含量影响的响应面图
通过Design-Expert 8.0.6软件,并结合回归模型和响应面图分析得出提取藜麦β-蜕皮激素最佳条件为:乙醇体积分数58.25%、超声时间31.12 min、液料比14.37∶1。在此条件下,预测藜麦中β-蜕皮激素含量为0.382 4 mg/g。综合考虑实际情况,将工艺条件调整为乙醇体积分数60%、超声时间30 min、液料比14∶1,在此条件下重复3次,测得β-蜕皮激素含量的平均值为0.379 1 mg/g,与模型预测值基本相符,证明此模型有效可靠。最终优化的藜麦β-蜕皮激素的提取条件为乙醇体积分数60%、超声时间30 min、料液比14∶1,得到β-蜕皮激素含量为0.379 1 mg/g。
2.3 体外抗氧化活性测定结果
由图5可知,当β-蜕皮激素质量浓度为0~5 μg/mL时,对ABTS+·清除能力随β-蜕皮激素质量浓度的增加而提高,5 μg/mL β-蜕皮激素对ABTS+·的清除率为63.8%;当β-蜕皮激素质量浓度高于5 μg/mL时,其对ABTS+·的清除效果没有显著差异,抗氧化性强于VC。此外,可以得到β-蜕皮激素清除ABTS+·的IC50值为3.92 μg/mL。这可能由于β-蜕皮激素中具有多个羟基,可以与ABTS+·配对,从而使绿色的ABTS+·溶液褪色,反映其抗氧化能力[27]。Nsimba R Y等[28]采用DPPH自由基清除法和FRAP法对藜麦蜕皮激素抗氧化活性进行测定,得到β-蜕皮激素清除DPPH自由基的IC50值为3.8 μg/mL以及FRAP法测得的IC50为34.5 μg/mL,可以得出β-蜕皮激素具有一定的抗氧化活性,与本研究结果一致。但β-蜕皮激素对ABTS+·的清除作用机理有待进一步的研究。
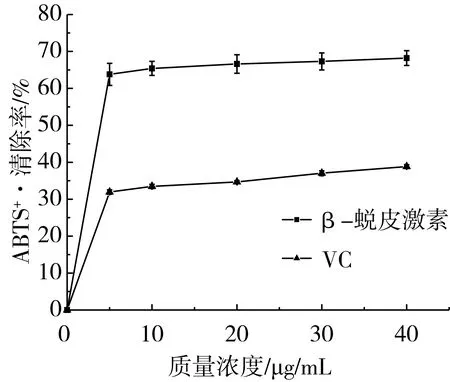
图5 藜麦β-蜕皮激素对ABTS+·的清除作用
4 结论
在单因素实验的基础上,采用Box-Behnken响应面法,以β-蜕皮激素含量为响应值,对提取藜麦中β-蜕皮激素的工艺条件进行优化,最佳的提取工艺条件为乙醇体积分数60%、超声时间30 min、液料比14∶1,在此条件下藜麦β-蜕皮激素含量为0.379 1 mg/mL。体外抗氧化实验表明:5 μg/mL的β-蜕皮激素对ABTS+·的清除率为63.8%,IC50值为3.92 μg/mL,说明β-蜕皮激素具有一定的抗氧化活性。本研究获得了一种简单的β-蜕皮激素提取工艺,可为后续开发β-蜕皮激素相关产品提供参考。
