藻际菌胶团的特征、调节机制与生态功能
2020-05-23王昭艺蔡中华曾艳华朱建明
王昭艺,蔡中华,曾艳华,朱建明,2,周 进
(1.清华大学深圳国际研究生院 海洋学部,广东 深圳 518055;2.哈尔滨工业大学 环境学院,黑龙江 哈尔滨 518055)
藻类是一种重要的浮游生物,在维持海洋初级生产力和生物地球化学循环方面发挥重要作用。作为初级生产者,藻类通过光合作用固定海洋中的碳并制造有机物,向全球输出高达40%~50%的初级生产力[1]。仅硅藻就为海洋初级生产力提供了40%的份额,贡献了全球固碳量的20%[2]。藻类在推动海洋碳循环的过程中扮演了“生物泵”的角色,将无机碳转化为有机碳。有机碳通常以溶解态和颗粒态的形式存在,前者随着营养级结构的递进而被循环利用,后者则与其他海洋碎屑形成絮凝体向深海沉降,为海洋碳的封存做出了重要贡献。
赤潮(HAB)是藻类爆发性增殖的一种现象,在这一生态事件中,藻菌关系非常重要[3]。细菌作为分解者为藻类生长提供必要的微量元素(如维生素)[4],而藻类分泌的胞外有机物可作为细菌的营养源[5]。除了互利关系,藻菌之间也存在竞争关系。当环境中的营养匮乏时,细菌和藻类会争夺营养物质,抑制对方的生长[6]。藻菌的拮抗作用可通过双方分泌特殊的化学物质得以实现;然而两者间的互作机制并不是绝对的,它受到细胞密度、营养物质、环境因子等多种因素的影响[6]。
微生物以多样性的形式调节宿主藻类的生态生理学过程,其中菌胶团(zoogloea consortium)是具有代表性的一种;类似于根际环境的土壤菌胶团,水体菌胶团也有不可忽略的作用。藻际菌胶团是指在藻菌交互作用下,微生物个体、胞外多糖以及各种营养物质交织而成的高度有序化的聚合体[5]。菌胶团的物质基础离不开藻菌分泌的胞外聚合物,这些功能多样、成分复杂的有机物吸引了大量的细菌进行定殖,形成的藻菌微环境被黏性基质裹附,稳定存在于海洋环境中。菌胶团中生物、有机质、颗粒碎屑之间时刻都在发生吸附-解吸、理化反应和生物转化等作用,这些生化过程的进行受多重因素的调节,而化学信号是其中重要的一类。研究发现,菌胶团生态位中存在着多样的化学信号,能调节微生物的群体行为并对环境做出响应[7]。最具代表性的一类为群体感应信号,它在菌胶团中具有促进细胞聚集、调节生物被膜形成以及调控胞外聚合物分泌的作用。
以往的研究证实了菌胶团的一些特性,包括其物质组成、与宿主藻类的关系以及对赤潮事件的潜在作用等。随着研究的深入,这种微小生态位的受关注度越来越高,重要性也日益凸显。为了更好地理解藻际菌胶团的生态生理学机制,笔者以近十年的文献为重点,总结了藻际菌胶团物质基础(基本组成、EPS类别和影响因素)、结构特征(生物被膜)、基于群体感应信号的调节机制以及菌胶团的生态功能(物质共享、抵御胁迫环境、维持生物多样性等),旨在梳理最新的进展,为更好地认识藻际环境中微生物的作用提供新的理论思路。
1 菌胶团的物质基础
1.1 基本组成
不同生境下菌胶团的物质成分各不相同,但基本组成具有相似之处。例如,土壤环境下的菌胶团中包含了多种微生物(细菌、真菌、病毒)、砂土等无机颗粒物质以及有机颗粒物(POM)[8];在生活污水中,菌胶团一般由微生物及其分泌的聚合物、污水中的营养物质、砂砾等无机悬浮颗粒物相互交织而成[9]。海洋中“海雪(marine snow)”是微生物胶团的一种,它由微生物群体、动植物碎屑以及无机物等多种颗粒组合而成[10],并嵌入溶解有机碳(DOC)和颗粒有机碳(POC)的黏性基质中[11]。“藻际菌胶团”是海洋环境中菌胶团的另一种存在形式,微藻作为结构中心不断向外分泌具有高度水合化特征的胞外聚合物,促进多种细菌聚集与黏附[3];以此为基础,形成生物被膜、菌席(microbial mat),并夹杂颗粒、絮凝体、有机质等形成有序结构的胶团类物质(图1)[12-13]。
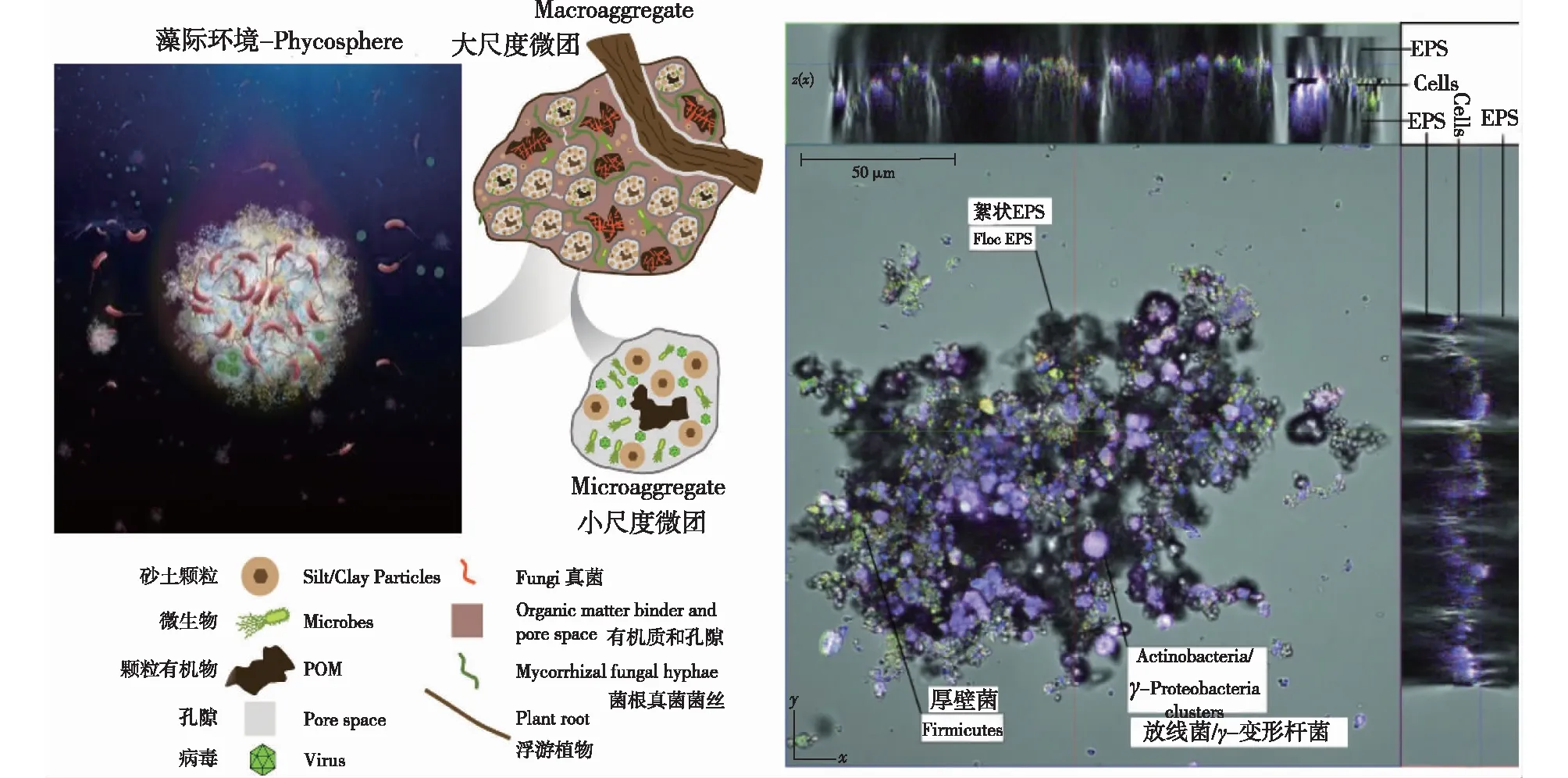
左图是藻际菌胶团的组成,且多个小尺度微团可组成大尺度微团;右图示一种菌胶团结构,放线菌(红色)和γ-变形杆菌(蓝色)聚集在一起,厚壁菌(绿色)集中在菌胶团结构外侧,絮状物直径介于50~250 μm,菌胶团中心具有清晰、紧密的团状结构且细胞数量较高,而外侧结构较为松散、不规则图1 微生物菌胶团组成及结构[8,13]Fig.1 Zoogloea consortium and its structure [8,13]
1.2 EPS的组成、影响因素与作用
藻际环境中微生物倾向于聚集成团而非以单细胞浮游态生长,成团过程中会分泌具有高黏性的聚合物,这些胞外聚合物被称为胞外多聚物(EPS)[14]。EPS具有较高的分子量和复杂的化学组成,主要包括多糖、蛋白质、核酸和脂质;也含有少量腐殖质、糖醛酸和无机质颗粒等。胞外多糖是EPS中含量最高的化学组分[14],包括直链或支链结构的均多糖和杂多糖,分子量为(0.5~2)×106[15]。多糖分子的结构多样性赋予了它一定的生态学意义,有些多糖含有带电荷的阴阳离子聚合物,这有助于微生物借助电荷作用进行黏附,以此形成菌胶团雏形[14]。多糖的化学组成因种属不同而异,螺旋藻(Arthrospirasp.)释放的多糖中包含半乳糖、葡萄糖、木糖、果糖、鼠李糖、阿拉伯糖和甘露糖[16];而褐藻产生的多糖以α-L-岩藻糖和硫酸酯作为主要成分。一些同种菌株分泌的多糖也存在显著的组成差异,例如溶藻弧菌(Vibrioalginolyticus)CNCM I-5034分泌的多糖为半乳糖、半乳糖醛酸、乙酰氨基葡萄糖和葡萄糖醛酸构成的四糖结构;而溶藻弧菌CNCM I-4151分泌的EPS由氨基酸构成[17]。另外,EPS中含有的酶可以将多糖水解。有研究发现糖苷水解酶对红藻多糖具有降解作用,其机制是通过切割糖苷键破坏红藻多糖结构[18]。此外,一些昆布多糖可在硫酸化作用下被降解为单体结构,使得EPS的成分具有高度多元化特征[19]。EPS丰富多样的组成满足了藻际细菌的营养需求,在菌胶团结构中充当了物质基础这一重要角色[20]。
EPS的化学组成及产量受到不同种属、菌株的影响,呈现出不同的特性。以盐假单胞菌(Pseudoalteromonasshioyasakiensis)、哈维氏弧菌(Vibrioharveyi)和产蛋白酶菌(Planomicrobiumsp.)这3种海洋细菌分泌的胞外聚合物为例,三者在EPS的多糖种类以及基质结构上存在较大差异,这也导致后续生物被膜的形成速度显著不同[21];不同藻类的EPS中胞外蛋白的组成也存在差异,绿藻中糖蛋白所占EPS的比例显著高于硅藻和红藻[14]。除了成分差异,不同亚种微藻的EPS产量也存在较大差距。例如,L型布朗葡萄球藻(Botryococcusbraunii)的EPS产量高达1 kg/m3,而A型、B型藻的EPS产量仅为它的1/4[22]。EPS的产量和组成也与营养条件紧密相关,例如,与营养缺乏的情况相比,硅藻属的新月细柱藻(Cylindrothecaclosterium)在营养充足时EPS产率明显要高,且多糖的比例显著降低;当营养源受到限制时,产率受到抑制,且缺少了鼠李糖和岩藻糖这2种多糖成分[23]。此外,环境因素(如温度和辐射)也影响EPS的产生速率:当辐射强度较低时,温度的变化并未对EPS产生明显作用;当辐射强度较高时,高温会显著抑制EPS产率[14]。
EPS作为一种致密有序的多层结构,有助于微生物群体抵抗外界胁迫环境。以毒性纳米颗粒(NPs)为例,EPS可将粒径超过50 nm的NPs有效隔绝,并使吸附NPs达到饱和状态的生物膜脱落释放,将有毒NPs外排到环境中[24]。除屏障机制以外,EPS具有许多重金属、有机物的吸附位点,其较高的络合能力与结合强度有利于形成多种配合物,这对于维持菌胶团的形态结构至关重要。EPS中种类丰富的官能团(如羟基、磷酸、硫氢基等)可与多种重金属络合[25],例如,EPS与钙镁等金属离子架桥联结产生的分子作用力对菌胶团的聚合结构具有重要影响[26]。其中,Ca2+与EPS结合后会明显改变菌胶团的结构和形态:高浓度Ca2+培养条件下的藻菌胶团呈现出致密、不透明的生理状态;而低浓度Ca2+培养条件下的藻菌胶团结构松散、颜色淡化[27]。EPS的另一个作用是帮助团聚絮凝,促进各种有机、无机颗粒的黏附,使菌胶团体积增长到一定程度(部分直径可达厘米级)[10]。此外,根据EPS与微生物群落结合的紧密程度可划分为松散型EPS(LB-EPS)和紧密型EPS(TB-EPS)[28],两种类型的EPS对菌胶团的结构形态作用效果迥异[27]。
2 菌胶团的结构特征
2.1 颗粒团聚态
菌胶团具有团聚态的特征,其尺寸形状与颗粒间相互作用、理化特性以及水流的剪切作用等因素有关。它絮凝成团的过程通常涉及颗粒间的物理碰撞与吸附团聚、电中和作用和物理场力等多种影响因素,这些胶体粒子的尺寸介于1 nm至几微米之间[9]。菌胶团在有机颗粒、无机颗粒相互碰撞的过程中逐渐絮凝成团,其形态结构的特性与颗粒的丰度、尺寸、黏性紧密相关。导致颗粒碰撞的物理机制主要包括差异沉降、湍流和布朗运动[10]。不同种类、尺寸的颗粒发生碰撞后,存在互补结构的物质会形成各种化学键,例如糖蛋白分子的亚基之间会形成分子共价键,多糖链之间会形成氢键,带有电荷的离子之间会形成离子键,具有特异性的分子结合使得菌胶团的结构更加牢固紧密。此外,黏附聚集的颗粒之间还会产生分子间范德华力、大分子的排序以及疏水作用,这些现象有助于塑造菌胶团的多变形态[9](图2)。
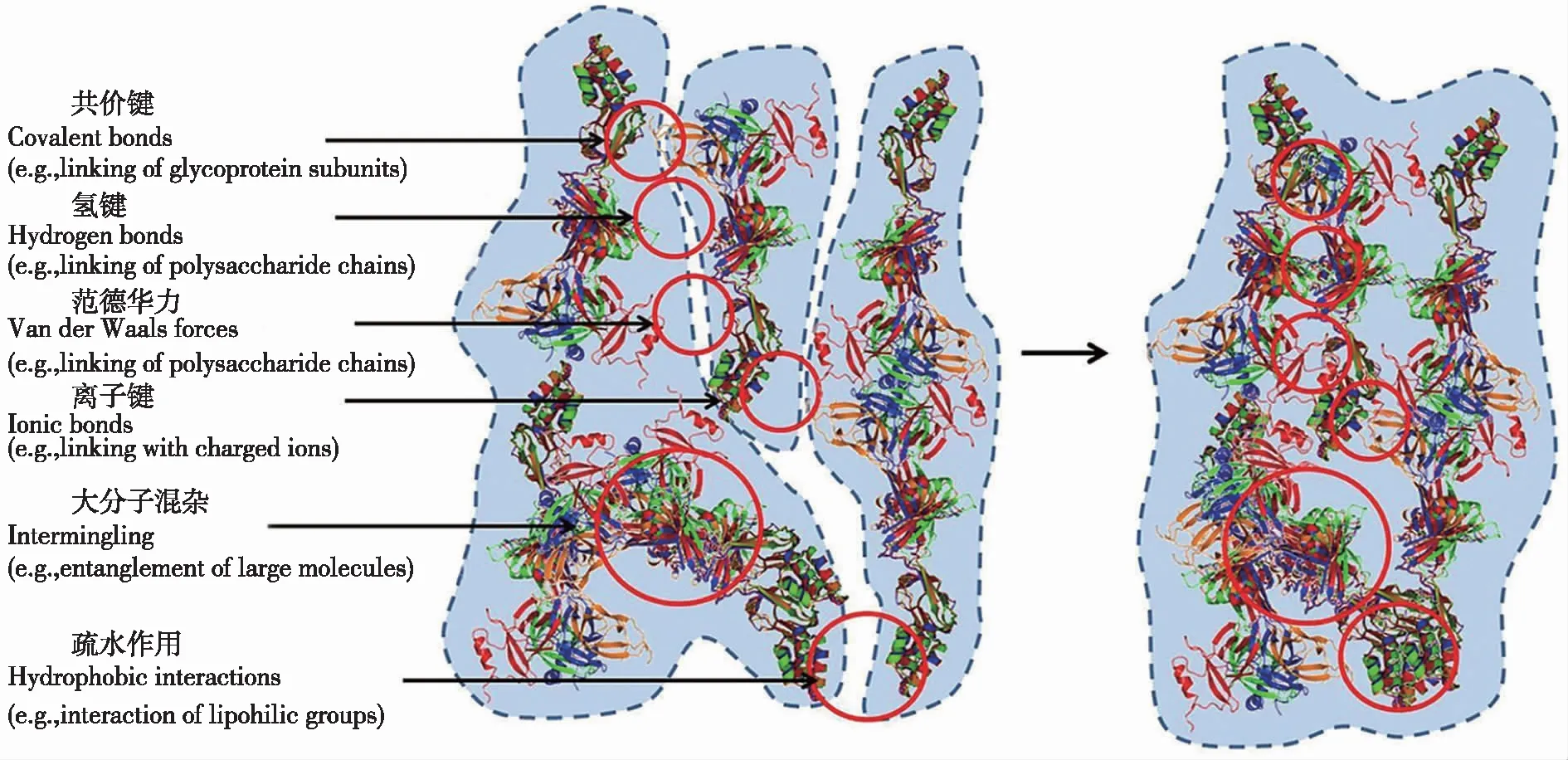
图2 菌胶团形成过程中产生分子排列和聚集的颗粒间相互作用机制[9]Fig.2 Particle-particle interaction mechanisms that result in molecular arrangements and aggregation during formation of hydrated bioflocs in aquatic environments[9]
2.2 菌胶团的生物多样性
藻际菌胶团具有多样的微生物组成,常见的藻际细菌包括黄杆菌 (Flavobacteria)、α-变形杆菌 (Alphaproteobacteria)(如玫瑰杆菌Roseobacters)、γ-变形杆菌 (Gammaproteobacteria)、厚壁菌(Firmicutes)和放线菌(Actinobacteria)等。Nelson等[29]研究发现黄杆菌和玫瑰杆菌在甲藻、硅藻和蓝藻中出现的频度较高。藻菌间的交互作用与微生物群落的组成有关,例如黄杆菌、γ变形菌、玫瑰杆菌的占比情况可反映其共生藻类的生理状态[30]。EPS的多糖结构是影响菌胶团生物多样性的重要因素之一。前期工作发现分子量较低、易被降解利用的糖类可为拟杆菌类的生存创造条件[7];而一些高分子的溶解性有机物因其结构复杂,需要不同细菌类群分泌多种水解酶(如碱性磷酸酶、氨基葡糖苷酶和几丁质酶)以进行协同降解利用[31]。Christie-Oleza等[32]研究发现分子链较长的多糖的降解依赖于玫瑰杆菌属、黄杆菌属以及γ变形菌三种菌群的交互作用,玫瑰杆菌增强胞外水解酶的活性,黄杆菌对几丁质进行降解,γ变形菌负责转化水解后的小分子物质。菌胶团的生物多样性有助于微生物群体更加高效地降解利用底物基质,很大程度上推动了物质运输和营养共享。
2.3 菌胶团的生物被膜特征
生物被膜(biofilm)是由微生物分泌的各种胞外聚合物(如多糖、核酸、蛋白质等)组合形成的膜状结构[33],是微生物主要的存在形式。能够生成被膜的微生物种类较为丰富,以变形杆菌门、拟杆菌门、厚壁菌门为主的细菌,以浮游植物为主的真核生物以及以海洋I型和II型为主的古菌都可以形成被膜结构[34]。生物被膜的形成可简要的分为4个阶段:①微生物通过鞭毛、菌丝以及膜蛋白与载体发生黏附作用[35],同时分泌EPS辅助增强黏附力;②微生物在黏附的基础上形成菌落,并逐渐扩大形成水凝胶状物质[36];③微生物在动态生长的过程中形成相对成熟的三维结构,发挥结构性、功能性作用;④外层生物被膜老化、脱落,开启下一轮微生物群落的新陈更替。
生物被膜的重要作用已被大量研究证实。与浮游细胞不同,生物被膜的三维结构可充当“脚手架”,将内部微生物的空间位置基本固定,使微生态群落在水环境中得以稳定存在[37]。除了提供“维稳”的作用之外,生物被膜的致密物理结构还能帮助微生物群落抵抗多种极端环境因子,大幅度提升了个体细胞的生存概率[38]。生物被膜的多层空间结构导致了微生物营养摄取及生长代谢速率的梯度变化。最外层的微生物占据地理优势首先摄取了周围环境中的氧气或者底物基质,相对于内层微生物呈现出较高的新陈代谢速率[39]。生物被膜内微生物间距紧密,有利于发生基因水平转移,为微生态群落中某些抗性基因的产生及生物多样性的形成提供了便利[40]。生物被膜内单细胞个体受到高密度依赖型信号分子的调控,交互激发群体表达出多种感应行为反过来促进了生物膜的形成[41]。研究表明生物被膜的形成机制与群体感应系统、环状双鸟苷酸和微小RNA(sRNA)有关[42]。
此外,生物被膜也为微生物间的合作与竞争提供了适宜的场所。研究发现,在藻菌共生关系中,细菌和宿主可通过交互作用促进生物被膜的生产速率[43]。两种单菌混合培养相比于单一菌株培养能够获得更高的被膜生物量[44],这是因为两种微生物通过共享公共物质(public goods)实现了合作共赢[45]。有实验将13种菌株进行相互间的混合培养,发现多菌株混合培养形成的膜具有更加多样的功能结构特征,表明微生物在生物被膜形成过程中存在协同合作关系[46]。膜内微生物间的竞争关系主要集中在对空间、营养、环境因子进行争夺,可通过分泌化学物质达到竞争目的。Nadell等[47]通过实验验证了铜绿假单胞菌(Pseudomonasaeruginosa)在膜形成的过程中争夺空间的现象,且这一竞争力取决于膜空间结构和微生物的分布排列。在藻际菌胶团中,澳大利亚红藻(Deliseapulchra)可通过分泌一种与酰基高丝氨酸内酯信号分子(AHLs)相似的化学信号分子-呋喃酮,对生物膜形成及共生菌活性造成抑制[48]。值得注意的是:这种合作-竞争的双重关系并不是割裂存在的,而是在共生过程中时刻发生相互转变。以海洋环境中的赫氏颗石藻(Emilianiahuxleyi)为例,生长初期与共生菌相互提供营养物质属于互利共生关系,当藻类处于衰亡期时会分泌一种触发细菌“溶藻”的化学物质,此时藻菌变为拮抗关系[49]。
2.4 群体感应信号对菌胶团的调节
群体感应信号(quorum sensing,QS)是微生物细胞间用于交流通讯的化学信号,当细胞密度超过某个阈值时,单个细胞会检测识别到微生物分泌的自体诱导物(auto-inducers,AIs),随后细胞间发生交流,启动相关基因的转录与表达,调控细胞密度、细胞聚集、EPS的合成以及生物荧光或毒素的分泌等[10]。QS信号通常被划分为三大类:第一类是用于革兰氏阴性菌的酰化高丝氨酸内酯(AHLs)和可扩散信号传导因子(DSF);第二类是用于革兰氏阳性菌的自诱导肽(AIP);第三类是用于微生物群落种间交流的自体诱导物(AI-2)和吲哚乙酸[50]。以AHLs信号分子为例,其作用机制:革兰氏阴性菌利用AHLs与LuxR(一种DNA结合蛋白)结合,调控相关基因的转录与表达[6]。
在藻际环境中,QS信号能加快微生物聚集形成菌胶团,促进藻菌微环境的快速构建。单细胞培养法证实通过对QS信号进行感知识别,细菌会启动生物膜的形成[42]。此外,多细胞环境下的实验也证实群体感应的确有助于细菌在以微藻为中心的周围区域形成生物膜结构,有利于藻菌进行物质共享[51]。信号调节下菌胶团的形成过程见图3:细菌依赖QS信号调节群落密度,达到一定密度后行使定殖、生物被膜产生、EPS释放以及“胶团样”结构形成的生物功能,这些级联过程受到分子间的逐级调控。QS信号对菌胶团的作用分为两种:正向调控和负向调控。在正向调节中,有研究表明假单胞菌接触过量的CeO2纳米毒性颗粒后,QS信号的作用强度随着细胞密度增加而提高,促进假单胞菌分泌大量的胞外多糖,强化群落结构,利于菌胶团的形成[52]。此外,在以硅藻为对象的研究中,发现菌胶团中存在某种硫酸杆菌可通过分泌吲哚乙酸信号分子显著增进硅藻细胞的分裂活动[7]。为了探究QS信号对菌胶团调节的分子机制,基因敲除实验提供了部分证据。敲除特定基因使霍乱弧菌(Vibriocholerae)细胞密度处于较高水平时,QS信号能够显著促进高密度细胞快速形成菌胶团[53]。此外,微生物菌落的形态也取决于QS信号,副溶血弧菌(Vibrioparahaemolyticus)QS调控基因组中某个基因的缺失会导致菌落形态呈现出显著变化:从“煎蛋”形状(中间厚且不透明,而边缘薄、半透明)变为菌落中心与边缘无明显差异的“薄饼”形状[54],这种形态的切换有利于维持渗透压、适应不同盐度的环境。然而,在负向调控的例子中,有研究发现当AHLs正常合成时,香茅草内生菌(Pantoeaananatis)SK-1菌株不能形成菌胶团;而AHLs合成受阻时反而发生明显的细胞聚集现象[55]。
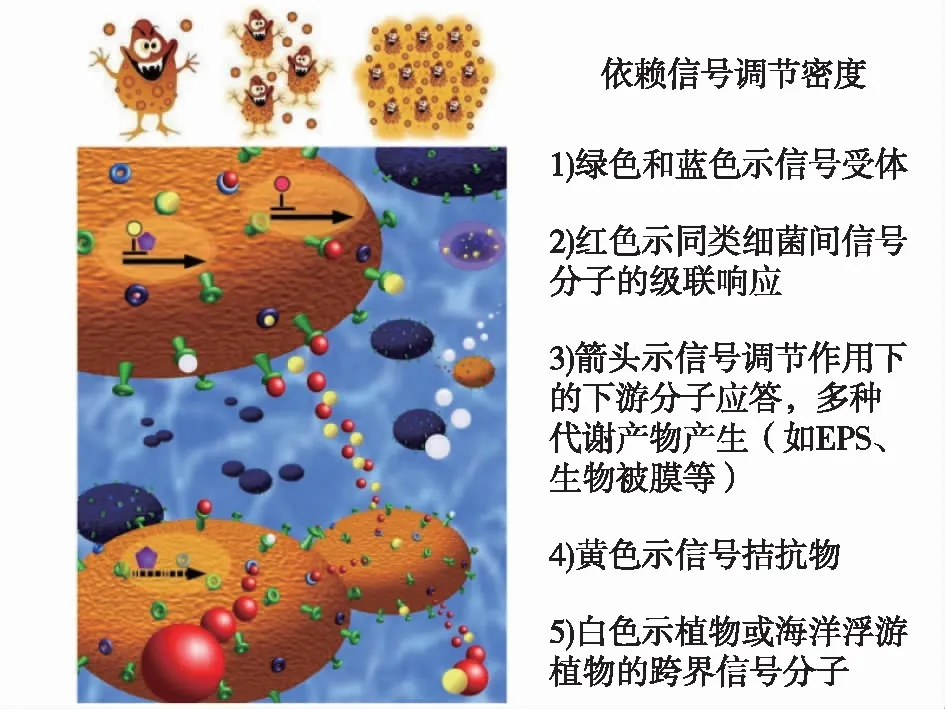
上图示密度调节,下图示分子响应图3 群体感应系统调节菌胶团的示意图[56]Fig.3 Simplified regulation of quorum sensing on zoogloea consortium[56]
除QS调节机制以外,胞外DNA(eDNA)与菌胶团的结构形态之间也存在着紧密的联系。eDNA是生物膜形成的必需成分,对生物膜的多种特性具有调控作用;eDNA与Dns和Xds两种胞外核酸酶共同影响细菌生物膜的结构组成、生长状态、营养获取和微生物定殖[57]。eDNA也调控着菌胶团的尺寸大小,其含量较高时菌胶团体积更大[53]。此外,基因水平转移也是促进微生物聚集的成因之一,这是因为菌胶团中含有的质粒携带了某些促进生物膜形成的基因[58]。
3 菌胶团的生态功能
3.1 营养共享
藻际菌胶团周围充斥着微藻、细菌等多种微生物及其代谢产物,复杂多样的化学物质形成了藻菌微环境依赖的物质基础。营养共享是藻菌通过合作共赢使双方利益最大化的例证之一,主要通过以下3种途径实现:①细菌可以将海洋环境中的大分子有机物质分解转化为小分子物质(如氨基酸)、矿化藻源物质释放出无机盐离子,为藻类的生理活动提供必备的营养源。Sandhya等[59]研究发现藻际菌胶团中细菌分泌的抗氧化剂、铁载体和吲哚-3-乙酸可能对藻类的生长代谢具有促进作用。②微藻通过光合作用固定海洋环境中的碳并分泌富含多糖的有机溶解物质,为细菌的增殖、定殖提供营养基质。研究发现,藻际菌胶团中的藻类可以为玫瑰杆菌的吸附定殖提供营养物质和基底环境[60]。③共生体系对外源环境中存在的营养物质具有更高的利用效率。Kishi等[61]分别向藻际菌胶团、细菌、藻类细胞的培养液中加入乙二醇,结果发现菌胶团中藻类和细菌的比生长速率与乙二醇降解率均大于细菌和藻类的单一培养体系,“物质共享”很好地诠释了藻菌共生关系建立的重要意义。
3.2 抵御胁迫环境
种类复杂的微生物聚集在菌胶团中,形成高度多样性的生物功能群落。物种间的交互作用赋予了微生物群体抵抗不良环境的功能特性,不同种类的菌胶团根据胁迫环境的类型做出应答。例如:蓝藻具有较高的胞外聚合物产量以及抵御紫外线长期辐射、低温的调控能力;血球菌对于紫外线辐射以及高盐度环境有显著抗性,这些特性缓解了胁迫环境对藻际菌胶团的损伤[62]。此外,菌胶团对低温、高温、酸碱性、高盐度以及毒性环境都有一定的耐受性。以有毒纳米粒子(IONP)为例,菌胶团能形成内外多层结构,在EPS的缓冲下,能抵御有毒纳米粒子的进入和富集,这是微生物群体在有毒环境下存活的一种策略(图4)[63]。

图4 菌胶团抵御纳米颗粒(NPs)的机制示意图[24]Fig.4 The front-line defense mechanism against nanoparticles (NPs) penetration in microbial aggregates[24]
菌胶团的防御机制与微生物分泌的各种代谢产物(例如渗透压剂、酶、肽、多糖等)紧密相关。与浮游细胞相比,菌胶团的形成显著延长了微生物的生存时间,增强了微生物对环境的适应性[64]。在众多代谢产物中,EPS对菌胶团抵御恶劣环境发挥了极其重要的结构性作用。Charies等[13]研究发现在pH高达13的强碱性环境中,菌胶团被富含甘露糖的胞外多糖包围,这层厚度达10 μm的保护膜显著降低了菌胶团内部的pH,使菌胶团的存活时间延长至两周。菌胶团抵御有毒纳米粒子侵害的主要机制有以下3种[65]:①官能团丰富的EPS在与IONP结合后显示出较高的生物吸附性,防止菌胶团内部微生物活性被破坏;②可溶性EPS增加了IONP的流体动力学直径,有助于促进IONP的聚集;③菌胶团接触IONP后分泌大量EPS,EPS的官能团、组成、结构并非一成不变而是与IONP交互发生变化,这种变化反过来增强了微生物群体对IONP的抵抗能力。
3.3 维持多样性(基因转移)
菌胶团的微生态环境与海洋环境之间存在的生态位差异会导致一些新基因或新物种的产生[66]。此外,基因水平转移(HGT)对于获取生物多样性具有重要意义。由于菌胶团中微生物之间联系紧密,微生物群落内携带的质粒帮助实现遗传物质的转移和传递,产生新的抗性基因。不同种类的微藻含有的共生菌基因多样性存在差异,这种差异对微生物群落的特定功能具有塑造作用。硅藻的基因组中检测到了多种共生菌基因,HGT可能有利于藻菌间的交互响应[67]。绿藻中的枯草蛋白酶基因SBT1-5源自共生菌,该基因负责调控绿藻的生长发育、免疫应答等多种功能[68]。基因转移使藻菌共生体在协同作用下进化出新的特性,是实现群体利益稳定化、最大化的重要途径之一。
3.4 代表性物种在菌胶团中的作用
玫瑰杆菌以及黄杆菌是菌胶团中2种较为常见的代表性物种。其中,玫瑰杆菌的基因组大小为6~8 Mb,且核苷酸数目相对较多,在生态环境中表现出显著的生存优势[69]。Koch等[70]研究发现玫瑰杆菌可能通过藻菌共生的方式作用于菌胶团,作用过程可能受到环境因子、营养基质、趋化性等多种因素的共同影响。组学鉴定结果表明玫瑰杆菌基因组中存在多种转运蛋白,这些基因与藻际菌胶团的组建机制有关[71]。此外,玫瑰杆菌的某些菌株中具有裂解二甲基巯基丙酸(DMSP)的功能基因(如DMSP裂解酶同源基因)[72],将一些特定的藻类(如定鞭藻Prymnesiophyte)分泌的DMSP进行转化[73],在促进藻际菌胶团物质转化的同时,加快了海洋环境中碳的循环。
另一种代表性物种黄杆菌通过降解大分子化合物的方式[19],尤其是对多糖、蛋白质等C源进行吸收利用[74],参与到菌胶团的物质转化过程中。研究发现,黄杆菌的丰度值与藻类多糖水解酶(如昆布多糖酶)的活性同时达到峰值[29],表明两者之间呈现出较高的正相关性。藻华爆发期间,黄杆菌中与水解多糖有关的转运蛋白表达显著上调[75]。黄杆菌功能强大的另一个原因在于其摄取能量的方式多样化,例如,黄杆菌可以利用藻类固氮释放的氢气进行供能[76]。除此之外,黄杆菌还具有调节N元素的功能,以及根据胞内具体条件加工S、Fe元素[7],对微生物群体所需的营养物质进行调控。
4 结论与展望
菌胶团是一个具有重要生态功能的微型生境,它建立在以多糖为主要成分的胞外聚合物EPS之上。菌胶团增强了微生态环境的结构稳定性、生物多样性和物质转化能力,且其动力学过程和功能受群体感应信号的调节。这种微小生境下的生态场所让菌胶团在物质共享、元素循环、环境应答和多样性维持方面具有重要作用,可作为揭示生态系统的形成以及生态事件发生机制的窗口。
得益于高通量测序技术与信息技术的发展,有关菌胶团作用机制的研究也越来越深入。针对目前的研究现状,除了前文中叙述的进展,未来的工作可在以下方面深入拓展:①借助组学技术和单细胞测序手段在宏观和微观尺度上对菌胶团的空间结构、种群变化进行精细分析,以更加明确地了解微生物交互作用对菌胶团的调控机制[77];②借助稳定同位素技术和Nano质谱方法,进一步发掘藻际关系中藻类、细菌、古菌、病毒间的网络关系,厘清交互作用对菌胶团的调控机制;③探究藻际菌胶团的形成过程、生态作用与赤潮事件之间的相关性或因果关系,为赤潮的形成机制和防控提供新的理论思路。
