壳聚糖包覆多孔碳骨架的可控制备及其电催化性能
2020-05-22钱庆仁韩三灿
钱庆仁,朱 敏,韩三灿
(上海理工大学 材料科学与工程学院,上海 200093)
目前气候问题成为了各个国家密切关注的问题。在2015年,《巴黎协定》要求温室气体减排,促使各个国家采取相应的措施应对气候问题,主要方法是通过降低化石能源的使用量,以再生能源替代不可再生能源,提高能源转换效率等手段来控制CO2的排放,达到抑制全球变暖的目的[1]。这些情况刺激了新型储能转换装置(燃料电池、金属-空气电池及超级电容器)的发展,其中燃料电池因其潜在的发展前景而备受关注[2-3]。现阶段制约燃料电池发展最主要的因素在于阴极氧还原(oxygen reduction reaction,ORR)所使用的铂基催化剂,因其成本昂贵,资源稀缺,在很大程度上制约了燃料电池的应用。而过渡金属氮掺杂碳催化剂由于价格低廉和其优异的电催化性能受到众多学者关注[4]。21世纪初,碳纳米管[5](carbon nanotubes,CNTs)和石墨烯[6]的出现对燃料电池的发展产生了显著的影响,但是因成本问题也没能大规模应用。而来源丰富,价格低廉的生物质材料作为碳基替代物得到了研究者们的青睐,全球每年有1 400多亿吨的生物质废弃物产生。因此,将生物质材料作为主要的新能源材料成为了研究学者越来越关注的方向[7]。
到目前为止,学者们以生物质材料为原材料通过多种方法制备的ORR催化剂种类丰富且具有优异的ORR性能。这是由于生物质材料中含有大量的元素及键合,经过高温热解后易于与金属离子形成金属氮-碳化物、吡啶氮及吡咯氮等主要的活性位点[8-10]。其中壳聚糖作为虾、蟹等节肢动物的壳及外骨骼的主要成分,含量丰富且价格低廉[11]。有研究表明,壳聚糖与某些金属离子有很强的配位性的特性,在医药、食品及净化水资源领域已有突出的贡献,而对于ORR来说,壳聚糖可与铁、钴等ORR活性较高的金属离子发生配位反应,所以在用于制备电催化剂时更易与金属离子形成金属氮-碳化物主要活性位点[12-13]。有学者发现壳聚糖制备的氮掺杂纳米碳具有可逆的ORR活性[14]。利用壳聚糖制备的电催化材料在将来有望替代贵金属基电催化材料。
采用水热法制备出了铁掺杂壳聚糖包覆多孔氮掺杂碳骨架材料(Fe-HPC@CTS-a-1 000),其特点在于用分层多孔氮掺杂碳骨架(hierarchically porous nitrogen-doped carbon,HPC)材料作为载体,利用水热反应将铁离子掺杂其中,并用壳聚糖进行封装。壳聚糖制备的催化剂具有很好的催化活性,但是单一使用壳聚糖制备催化剂其分散性差、比表面积小,导致了催化活性有限,不能满足要求。因此HPC的加入即增加了催化剂的比表面积又提供了良好的导电基底,这样一来有利于活性位点的暴露,并使内部电子传输更加快速,从而提高了电化学活性。结果表明Fe-HPC@CTS-a-1 000系列催化剂具有优异的ORR催化性能。
1 试 验
1.1 HPC的制备
HPC通过一步碳化制成,具体步骤[15]如下:将2 g面粉、2 g尿素、2 g KOH在50 mL去离子水中充分溶解并搅拌1 h,将所得到的粘稠状混合物放入60 ℃烘箱中干燥。随后利用热解法,将干燥好的混合物放入石英坩埚内并置入管式炉中在氮气气氛下以3 ℃·min-1的速率升温至800 ℃保温2 h,待冷却至室温用体积分数为5%的稀盐酸与去离子水各洗涤4次,经干燥研磨后得到HPC。
1.2 Fe-HPC@CTS-a-1 000的制备
分别取275,375和475 mg壳聚糖分散在50 mL烧杯中,分别加入 100 mg HPC,100 mg FeCl3·9H2O,50 mL去离子水(壳聚糖与HPC质量比a分别为 2.75,3.75,4.75),在室温下搅拌 6 h。将得到的混合物放入100 mL聚四氟乙烯反应釜中,在200 ℃条件下水热12 h,洗涤干燥后得到Fe-HPC@CTS-a,最后将干燥得到的深褐色粉末在氮气气氛下以5 ℃·min-1的速率升温至1 000 ℃并保温2 h,待自然冷却至室温,研磨后得到Fe-HPC@CTS-a-1 000催化剂。
1.3 材料表征
在 X-射线衍射仪(X-ray diffractometer,XRD)上,对制备得到的催化剂进行晶型结构分析,Cu靶Kα 射线(λ=0.15405 a),扫描速率 7(°)·min-1,扫描区间20°~80°,获得宽角X射线衍射谱图。FEI公司Quanta 450场发射扫描电子显微镜(scanning electron microscope,SEM)和加压速率为300 kV的Tecnai G2 F30透射电子显微镜(transmission electron microscope,TEM)对样品的形貌和结构进行表征。
电化学测试:所有的电化学测试都是在美国PINE公司的AFCBP1型旋转圆环圆盘电极装置进行。墨水的配置:将5 mg催化剂超声分散在500 μL去离子水、500 μL乙醇和 30 μL体积分数为 5%Nafion溶液的混合液中制备得到催化剂墨水。然后,将20 μL墨水分2次滴在工作电极(玻碳电极)上并在室温下干燥。所有样品的催化剂负载量为0.2 mg·cm-2。以铂片作为对电极(辅助电极),饱和甘汞电极作为参比电极与工作电极形成三电极体系,在测试前通30 min高纯氧,测试时在液面上方通高纯氧作为保护气体,测试用电解质为0.1 mol·L-1的 KOH溶液。根据(1)式,可将甘汞电极电位(ESCE)转化为标准氢电极电位(ERHE)。

式中,ESCE为甘汞电极为参比电极的电势;ERHE为标准氢电极电势;室温下为0.241 V。因此,在0.1 mol·L-1的 KOH 溶液中,ERHE=ESCE+ 1.00。
ORR反应机制:氧还原反应是一个相当复杂的过程,涉及到多电子转移过程。Wroblowa[16]提出了如图1所示的ORR反应机制:溶液中的氧气向催化剂表面扩散并吸附在其表面,使氧分子处于活化吸附态;活化吸附态的氧分子与反应物进行反应变成吸附态产物。O2,ad表示溶液中的溶解氧,k为反应速率常数。在直接四电子转移机制中,O2可直接被还原为水;而在间接二电子反应机制中,会产生H2O2中间产物,从而增加能量消耗,降低转换效率。通过研究表明直接四电子反应途径是ORR过程中最有效、最直接的方式[17]。采用旋转环盘电极可测得电子转移率与过氧化氢产率,计算方程如下:
式中:Id为圆盘电流;Ir为环盘电流;N为收集效率(≈0.24~0.50)。
2 结果与分析
2.1 Fe-HPC@CTS-3.75-1 000与HPC的表面形貌
图2为本试验的流程图,以面粉为碳源,尿素为氮源,KOH为造孔剂,制备出HPC材料,HPC作为基底,拥有比表面积大、导电性好、N-C结构丰富等优点。壳聚糖包覆HPC可以有效提高催化剂的比表面积,能增加反应活性位点的数目;并且HPC具有良好的导电性能。HPC为Fe-HPC@CTS-a-1 000催化剂的电子提供了高效的传输通道,降低了能耗,提高了电化学性能;碳膜的包覆可减少活性位点直接与电解液的接触,减缓了催化剂的腐蚀,提高了催化剂的耐蚀性。
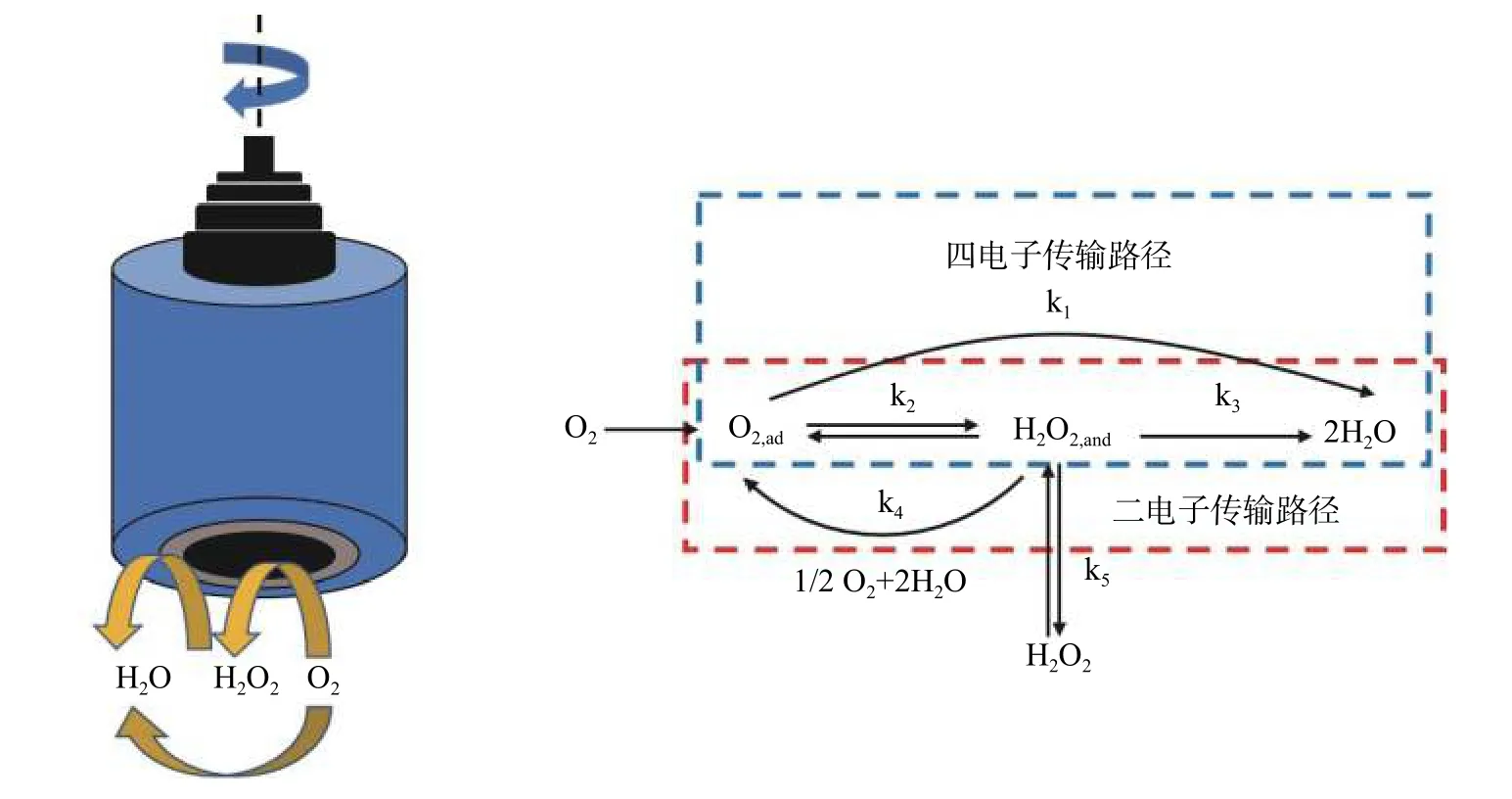
图1 电极上氧还原反应的Wroblowa过程图Fig.1 Wroblowa process of oxygen reduction reaction on electrode
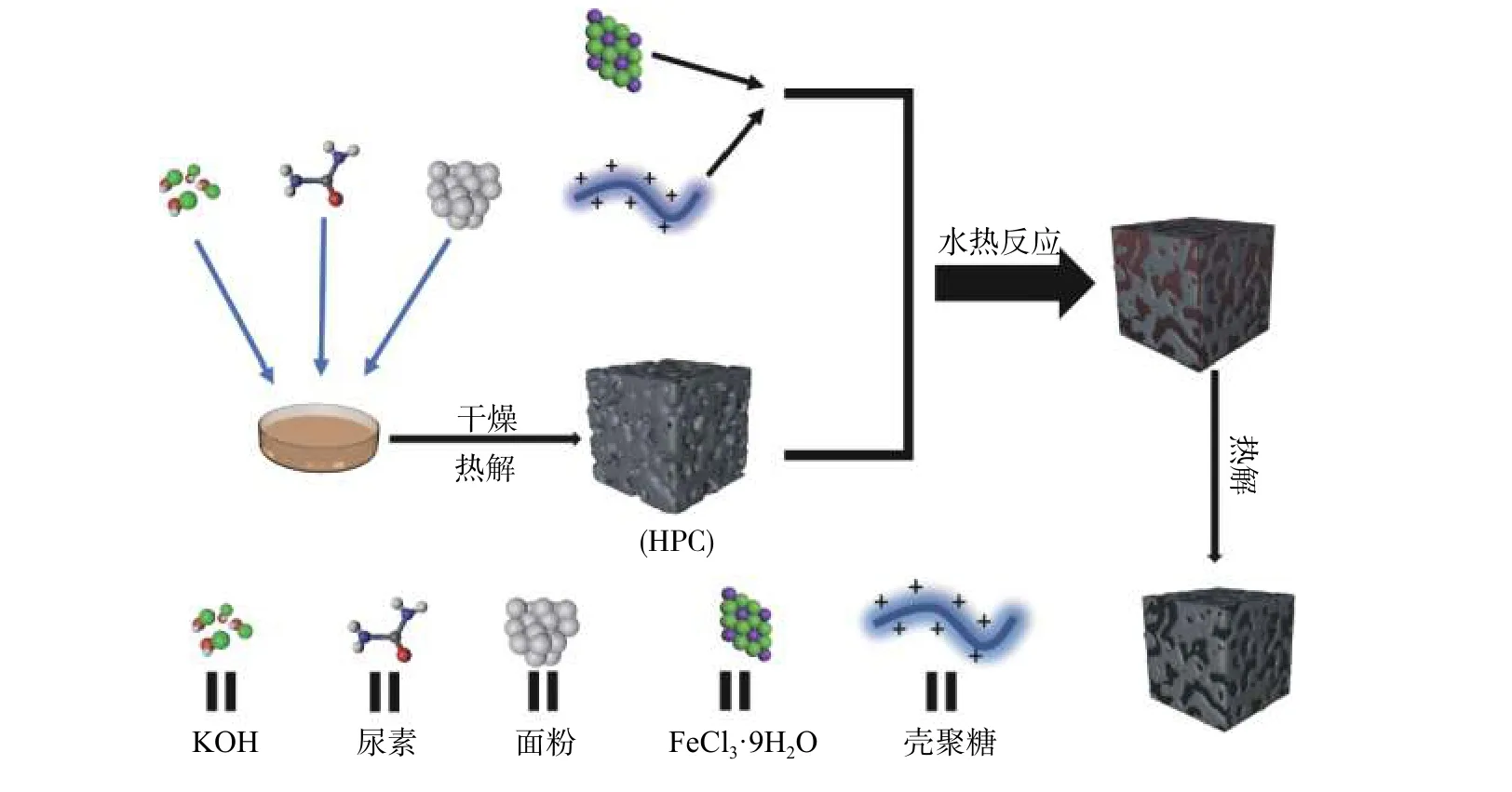
图2 Fe-HPC@CTS-a-1 000电催化剂的合成示意图Fig.2 Schematic diagram for the synthesis of Fe-HPC@CTS-a-1 000 electrocatalyst
为了研究该材料表面结构及包覆情况,对其进行SEM表征。图3是HPC与Fe-HPC@CTS-3.75-1 000的 SEM图,从图 3(a)中可以清晰的看出HPC孔径在700 nm左右;氮掺杂碳骨架拥有较高的电导率,其中包含大量的氮掺杂位点,为催化剂提供了电子传输途径与活性位点载体。图3(b)中可以清晰的看出在孔洞上方有一层薄薄的碳膜,证明壳聚糖成功的包覆在碳骨架上;金属氮碳化合物极易受到电解液及外界物质的腐蚀,碳膜隔绝了外界物质,提高了催化剂的耐蚀性。
2.2 Fe-HPC@CTS-3.75-1 000的结构与元素分析
如图4所示,通过氮气吸附-脱附等温曲线对铁掺杂壳聚糖催化剂(Fe-CTS)与HPC的比表面积和孔径进行分析。HPC的比表面积达到877.7 m2·g-1,而Fe-CTS比表面积仅有7.9 m2·g-1,由此看出将HPC作为基底,能有效的提高催化剂的比表面积,弥补了单用壳聚糖制备催化剂分散性差、比表面积小及电导率低的不足。壳聚糖的包覆与铁的掺杂也增加了体系中活性位点的数量,三者共同作用可使电催化性能有巨大的提升[18]。
XRD谱如图5所示,图为不同比例的壳聚糖包覆的催化剂。XRD谱图中仅有碳的2个宽峰,没有出现其他晶体的衍射峰,证明催化剂中没有明显的金属纳米颗粒及其他晶体的产生,同时证明了金属离子有效的分散性。

图3 Fe-HPC@CTS-3.75-1 000与HPC的SEM图Fig.3 SEM images of Fe-HPC@CTS-3.75-1 000 and HPC
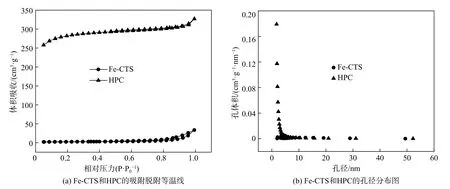
图4 Fe-CTS与HPC的氮气吸附-脱附曲线与孔径分布Fig.4 N2 adsorption-desorption curves and pore size distributions of Fe-CTS and HPC
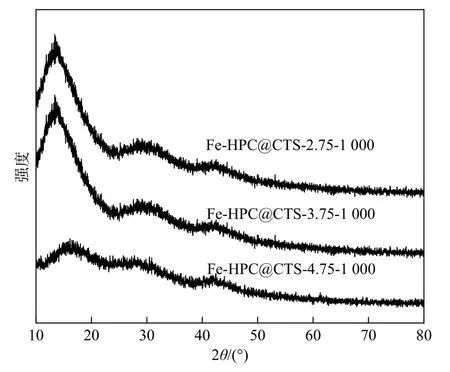
图5 Fe-HPC@CTS-a-1 000的XRD谱图Fig.5 XRD patterns of Fe-HPC@CTS-a-1 000
图6是Fe-HPC@CTS-3.75-1 000的TEM图,从图6(a)中可以清晰的看出,在薄薄的碳膜下分布着大小均一的孔洞,说明壳聚糖成功的包覆在HPC上,且没有将孔洞填埋,而是犹如薄膜般覆盖在上面,通过控制壳聚糖的掺入量可以有效减少壳聚糖自身的团聚现象的发生,使得在薄膜上分布更多的活性位点。对该位置进行元素扫描分析,结果如图6(c)所示,局部元素分布表明,Fe,N,C,O元素在催化剂内部分布均匀,共同掺杂在Fe-HPC@CTS-3.75-1 000催化剂中。
2.3 电化学性能测试
图7为Fe-HPC@CTS系列催化剂采用旋转圆盘电极测得的ORR电催化性能。图7(a)中表示的是不同比例壳聚糖包覆量与20% Pt/C催化剂的LSV曲线,从图中可以看出,包覆了壳聚糖的样品的ORR性能与HPC及Fe-CTS的ORR性能相比有明显的提高,是由于HPC骨架提供了一个良好电子传输体,且较大的比表面积可使活性位点均匀的分布在催化剂中并能够暴露出更多的活性位点。随着壳聚糖的包覆量的增加,ORR性能呈现出先提高后降低的趋势。这是因为过低的包覆量不能使HPC完全的包覆;而加入过多的壳聚糖则会使孔洞填埋,从而团聚于此,影响ORR性能。Fe-HPC@CTS-3.75-1 000催化剂在此系列中性能最为优秀,它的半波电位达到了0.80 V,仅比20% Pt/C电极的半波电位低了20 mV(20% Pt/C的半波电位为0.82 V),而其极限电流密度达到了6.50 mA·cm-2,要高于20% Pt/C 的电流密度(6.10 mA·cm-2)。图 7(b)为Fe-HPC@CTS-3.75-1 000与20% Pt/C电极的塔菲尔斜率,从图中可以看出,Fe-HPC@CTS-3.75-1 000催化剂的塔菲尔斜率要小于Pt/C催化剂。通过环盘测试发现,如图 7(c)和图 7(d),Fe-HPC@CTS-3.75-1 000的产氢率低于2%,较低的产氢率有利于提高燃料电池体系能量转换效率。而其电子转移数均高于3.6,略低于20% Pt/C电极。
对Fe-HPC@CTS-3.75-1 000与20% Pt/C催化剂进行了稳定性性测试,结果如图8(a)所示。由图8(a)可知,在 0.8 V的恒电压下,随着时间的推移,Fe-HPC@CTS-3.75-1 000催化剂的变化明显小于20%Pt/C催化剂,在测试时间为20 000 s时的保持率为80%,而20% Pt/C催化剂仅有68%,这说明Fe-HPC@CTS-3.75-1 000催化剂具有良好的稳定性,随着催化剂使用时间的增加引起的功率损失较小。图8(b)为Fe-HPC@CTS-3.75-1 000与20% Pt/C催化剂在0.8 V恒电压下,加入5 mL甲醇进行的抗甲醇性能测试,从图中可以看出Fe-HPC@CTS-3.75-1 000材料具有更优秀的耐甲醇性。

图6 Fe-HPC@CTS-3.75-1 000的TEM与元素分布Fig.6 TEM and elemental distribution of Fe-HPC@CTS-3.75-1 000
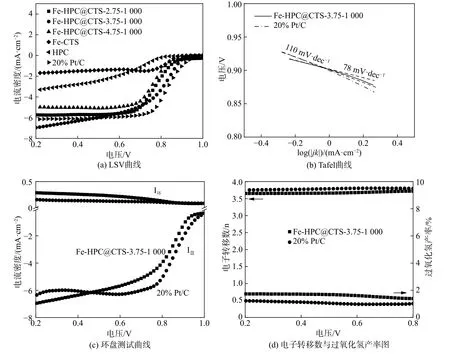
图7 样品Fe-HPC@CTS-a-1 000与20% Pt/C的电化学曲线Fig.7 Electrochemical curves of Fe-HPC@CTS-a-1 000 and 20% Pt/C
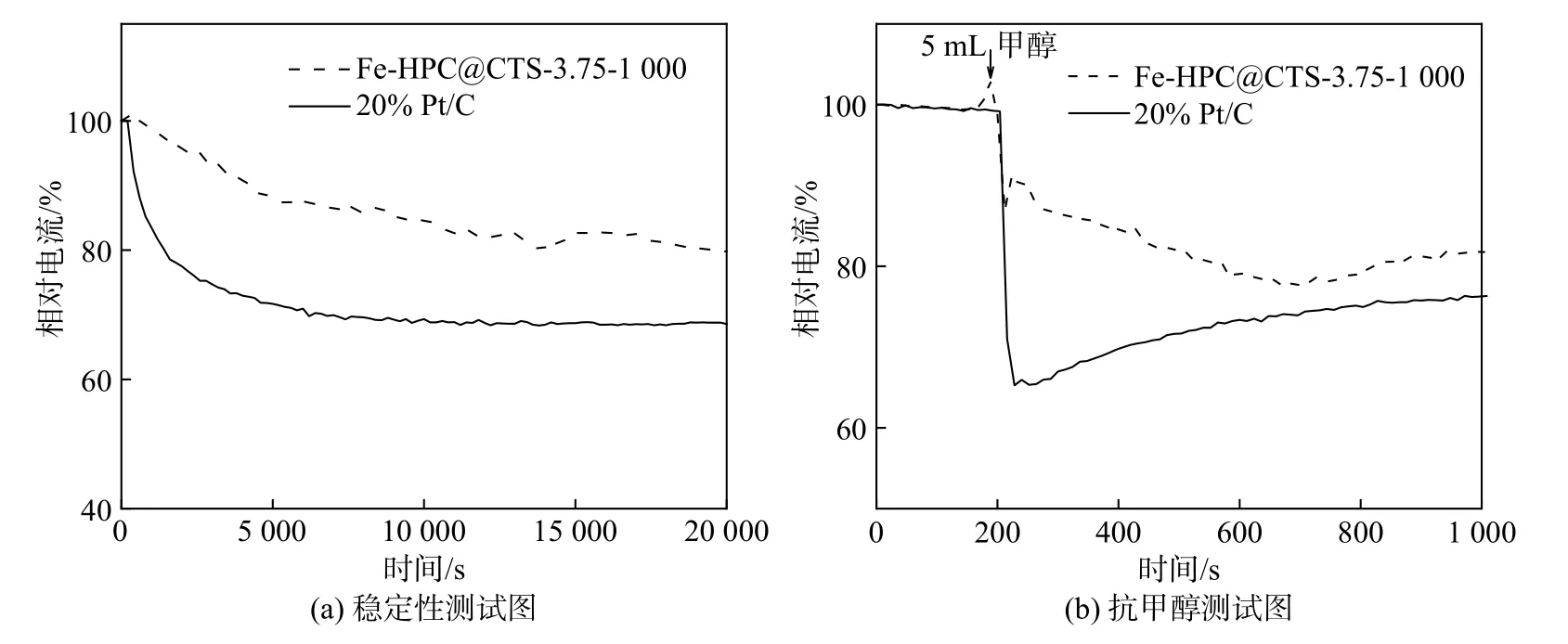
图8 Fe-HPC@CTS-3.75-1 000与20% Pt/C的稳定性测试曲线Fig.8 Stability test curves of Fe-HPC@CTS-3.75-1 000 and 20% Pt/C
3 结 论
选取HPC作为载体,通过水热反应可形成壳聚糖包覆层,这样的包覆层一方面避免内部活性位点直接与电解液接触,提高了催化材料的耐蚀性;另一方面,铁元素的掺杂,增加了活性位点数,与壳聚糖包覆层协同进行催化作用,提高了电化学性能。结果表明Fe-HPC@CTS-3.75-1 000催化剂在该系列中具有最好的催化性能,半波电位为0.80 V,极限电流密度高达6.50 mA·cm-2,甚至高于20% Pt/C催化剂(6.10 mA·cm-2)。通过抗甲醇性能的测试说明Fe-HPC@CTS-3.75-1 000催化剂的抗甲醇性能要优于20% Pt/C催化剂。
