NaBH4还原改性TiO2(B)及光催化性能研究
2020-05-22宜周翔王现英张加加
宜周翔,王现英,张加加
(上海理工大学 材料科学与工程学院,上海 200093)
自20世纪70年代日本学者Fujishima等[1]发现在紫外光照射下TiO2电极会析出氢气以来,光催化分解水制氢的相关研究迅速成为全世界关注的焦点[2]。TiO2作为传统的光催化材料,仅可利用占太阳光能量4%的紫外光用于光催化反应,无法利用到丰富的可见光[3]。拥有可见光活性的光催化材料的研究是当务之急。
自20世纪80年代Marchand等[4]首次制备出单斜相二氧化钛[TiO2(B)]后,由于其与常见TiO2结构的差异所导致的性能不同,使人们开始将关注点转移到TiO2(B)上。TiO2(B)是以TiO6八面体为基础,通过共用边和共顶点形成的多晶[5],是一种n型半导体,带隙为3.00~3.22 eV[6]。研究发现 , TiO2(B)具有独特的电化学和催化特性,是一种选择性和活性很高的催化载体[7]。
虽然TiO2(B)具有独特的性能,但仍然无法利用可见光进行光催化反应。有研究表明[8],通过对TiO2还原处理,使其内部含有Ti3+与氧空位可以改善其能带结构,提高光催化性能[9]。本文通过NaBH4还原改性TiO2(B),制备出含有Ti3+的TiO2(B)样品,成功将吸收光谱扩展到可见光区域,实现对可见光的吸收;并且测试了可见光光催化产氢效率与降解效率。
1 试 验
1.1 材料制备
采用水热法制备TiO2(B),1 mL TiCl4溶解于30 mL(CH2OH)2溶液中后加入1 mL去离子水,充分搅拌均匀,150 ℃下水热反应6 h(从升温到150 ℃开始计时),反应结束后随炉冷至室温,用去离子水和乙醇分别洗涤样品4次,再将样品置于80 ℃烘箱中干燥12 h,得到原始TiO2(B)样品[10]。
将 200 mg TiO2(B)样品与不同质量 NaBH4(1,2,3和4 g)分别置于双温区管式炉双区中,NaBH4焙烧温度为500 ℃,通过NaBH4气化后产生的还原性气体还原TiO2(B)样品,TiO2(B)焙烧温度为200 ℃,并在氩气气氛中保温1 h。待样品冷却至室温后使用去离子水与酒精分别清洗样品4次,去除残留NaBH4,并在80 ℃烘箱中干燥 12 h,得到 TiO2(B)-NaBH4X(X=1,2,3,4)样品。
1.2 催化剂表征
样品的晶体结构分析使用PANalytical MPD X 射线衍射仪(X-ray diffraction,XRD),Cu 靶,40 kV,30 mA,扫描区间 20°~70°;样品的拉曼光谱测试(Raman spectroscopy)使用 LabRAM HR Evolution型激光共聚焦拉曼光谱仪,激发波长为532 nm;样品的紫外-可见漫反射分析(UV-visible diffuse reflectance spectrum,UV-DRS)使用Lambda750 PE紫外可见分光光度计,选取波长为(300~800 nm)范围进行检测;样品的X射线光电子能谱分析(X-ray photoelectron spectroscopy,XPS)使 用 Thermo ESCALAB 250XI仪,采用C 1s(284.6 eV)矫正结合能。
1.3 光催化性能测试
光催化分解水测试在自制光催化反应系统中进行,本系统由8个气密石英反应器和500 W中压汞灯(汞灯配有滤光片以过滤420 nm以下的光线)组成,并配有循环水冷却装置并由气相色谱仪测定反应产生的气体。试验前,在30 mL体积分数为10%的甲醇水溶液中加入30 mg光催化剂,经10 min超声分散,使催化剂分散均匀,再加入质量分数为0.03%的助催化剂铑(Rh)。在进行光照之前,气密石英反应器使用高纯氮冲洗用于除去空气。随着反应进行,每间隔1 h采集气体样品进行H2定量分析。
光催化降解染料测试采用与光催化分解水测试同样的设备进行试验,在10 mg·L-1甲基橙(methyl orange,MO)染料溶液 50 mL 中加入 10 mg催化剂后在黑暗中达到吸附-脱附平衡。每小时测定溶液吸光度以确定降解速率。
2 结果与讨论
2.1 表征
图1为原始 TiO2(B)样品与改性 TiO2(B) -NaBH4X样品的XRD谱图。经与PDF卡片仔细对比发现,TiO2(B)样品的XRD谱图与TiO2(B)的标准PDF卡片JCPDS No.74-1940一致,3个强衍射峰分别对应 TiO2(B)位于 24.979°,28.596°和 48.634°的(110),(002)和(020)晶面[11]。根据文献报道,TiO2(B)由于其特殊的晶体结构,易于向锐钛矿TiO2转变,而在TiO2(B)样品XRD谱图上并未发现属于锐钛矿TiO2的衍射峰,并且与TiO2(B)衍射峰对应良好,没有额外的杂峰,说明经水热法生产的TiO2(B)为纯相,没有额外的杂相存在。TiO2(B)-NaBH4X样品与TiO2(B)样品峰形基本保持一致,表明通过NaBH4还原后样品并未发生相变。
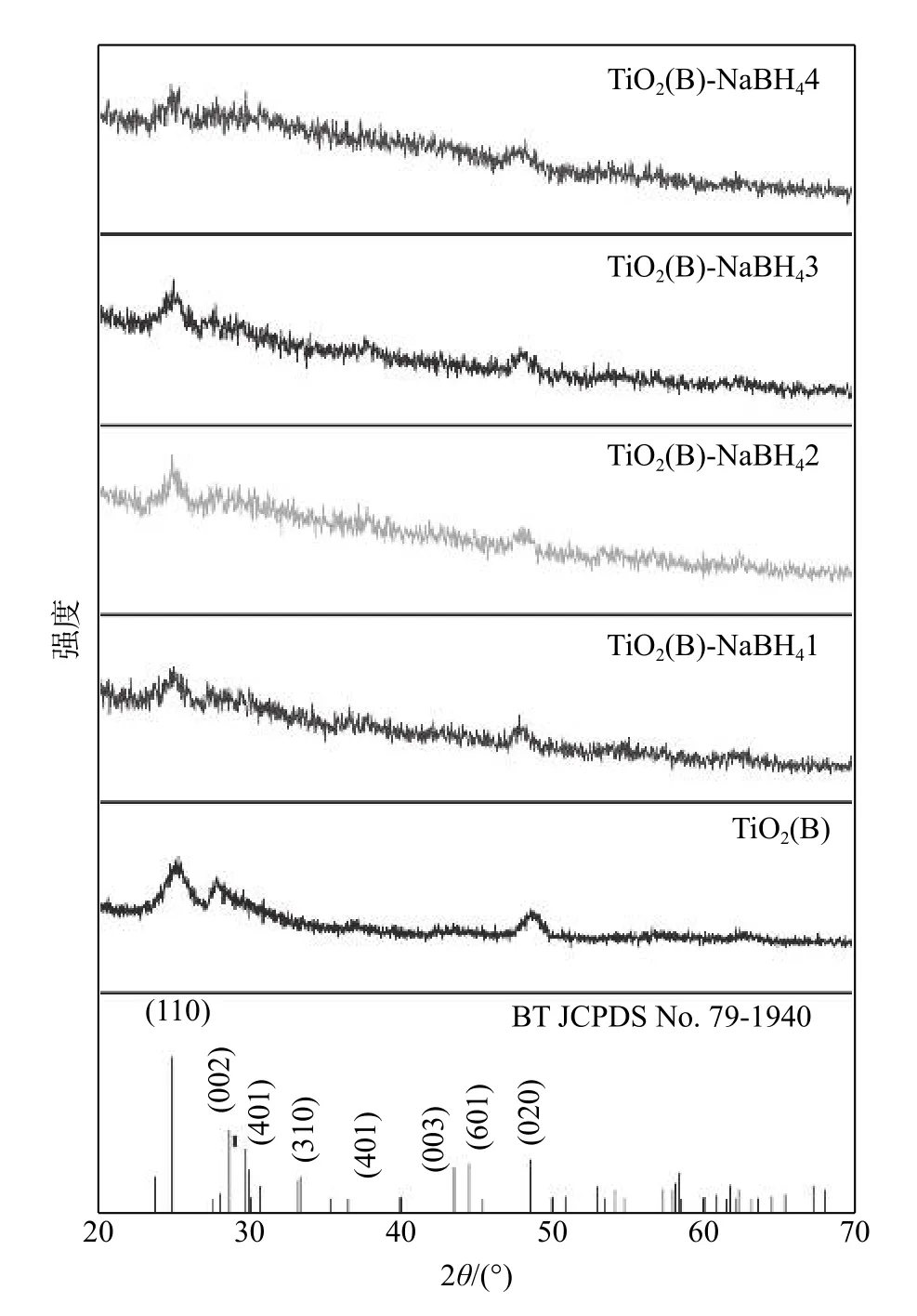
图1 TiO2(B)-NaBH4X样品XRD谱图Fig.1 XRD patterns of TiO2(B)-NaBH4X
图2为系列样品的拉曼光谱,TiO2(B)样品的拉曼特征峰位于 256,376,422,477,551,633 和 827 cm-1处,与文献[12]报道一致,且没有额外的杂峰出现,说明为TiO2(B)纯相。TiO2(B)-NaBH4X的特征峰位置相较于TiO2(B)样品并未产生变化,说明依旧保持TiO2(B)的晶体结构,并没有发生相变。而相较于TiO2(B)样品,TiO2(B)-NaBH4X样品存在特征峰强度变化,随着NaBH4使用量的增加,峰强度逐步下降,说明在反应过程中,TiO2(B)-NaBH4X样品的结晶度发生下降。

图2 TiO2(B)-NaBH4X样品拉曼谱图Fig.2 Raman spectra of TiO2(B)-NaBH4X
图3为系列样品的UV-DRS光谱图。从图中可以看出,TiO2(B)样品只能吸收波长小于400 nm的紫外光,并无可见光吸收。而随着NaBH4使用量的增加,样品的吸收光谱向可见光区域扩展,并在400~600 nm之间的可见光吸收逐步增强。通过Kubelka-Munk函数计算带隙,原始TiO2(B)样品的带隙约为3.15 eV,与文献[6]报道一致。合成的 TiO2(B)-NaBH4X样品中,TiO2(B)-NaBH44能带间隙变化最大,减小到约2.82 eV。与原始TiO2(B)相比,TiO2(B)-NaBH4X的能带改变导致其吸收光谱扩展到可见光区域,这对改善其光催化性能十分重要。

图3 TiO2(B)-NaBH4X样品UV-DRS谱图Fig.3 UV-DRS spectra of TiO2(B)-NaBH4X samples
图4为 TiO2(B)-NaBH43与原始 TiO2(B)样品Ti的2p轨道高分辨XPS谱图,其中位于458.4 eV与464.1 eV处的峰对应于Ti4+的2p3/2和2p1/2轨道[13-14]。这两个峰保持高度对称,且以458.4 eV与464.1 eV为对称中心,表明了Ti4+的绝对配位,说明只有Ti4+的存在,不存在Ti3+。而TiO2(B)-NaBH43的XPS去卷积峰在457.6 eV和463.3 eV处出现了属于Ti3+的2p3/2和2p1/2轨道的峰[15],说明TiO2(B)-NaBH43中出现了Ti3+,Ti3+在能带中会产生杂质能级,是引起TiO2(B)-NaBH4X能带改变的根本原因。

图4 TiO2(B)-NaBH43与TiO2(B)样品Ti的2p高分辨XPS谱图Fig.4 High-resolution XPS spectra of Ti 2p of TiO2(B)-NaBH43 and TiO2(B)
2.2 材料光催化性能研究
图5为制备的TiO2(B)-NaBH4X的可见光催化分解水产氢性能-时间曲线,在间歇可见光照射下每小时检测一次,与TiO2(B)样品对比。其中,原始TiO2(B)样品不具有可见光光催化分解水产氢性能,而通过NaBH4还原后实现了可见光条件下催化产氢。随着NaBH4使用量的增加,可见光催化分解水产氢性能出现了先增后减的趋势,这说明虽然NaBH4还原能够提高TiO2(B)的可见光光催化活性,但并不是添加越多越好,存在一个最佳使用量[16]。当使用 NaBH4质量为 3 g时,TiO2(B)-NaBH43样品具有最好的可见光光催化分解水产氢性能,约达0.58 μmol·h-1·g-1(见图 5b),约为 TiO2(B)-NaBH41的2倍。通过1 h的间歇照射,可以发现反应过程中H2的释放是稳定且连续的,说明TiO2(B)-NaBH4X样品在光催化过程中是稳定的。

图5 TiO2(B)-NaBH4X可见光催化分解水产氢性能Fig.5 Performance of TiO2(B)-NaBH4X for visible light catalytic water decompositing hydrogen production
为了进一步探究TiO2(B)-NaBH4X样品的光催化性能,选用没有染料敏化现象的MO作为染料探究TiO2(B)-NaBH4X样品的可见光降解性能。降解曲线如图6所示,其中TiO2(B)-NaBH43对于MO有最好的降解性能,与光催化分解水制氢性能趋势一致。而TiO2(B)样品在可见光下对MO几乎没有降解性能,也可以印证对于TiO2(B),MO没有染料敏化现象。图6(b)为降解动力学常数图,符合降解一阶动力学方程,TiO2(B)-NaBH43反应动力学常数最高,表明其可见光降解性能最好。

图6 TiO2(B)-NaBH4X可见光降解MO性能Fig.6 Performance of TiO2(B)-NaBH4X for visible light degrading MO
3 结 论
本文使用水热法制备TiO2(B)并使用NaBH4对其进行还原改性,对TiO2(B)-NaBH4X的晶体结构,光学性质,光催化性能进行了研究。
(1)TiO2(B)经 NaBH4改性后得到的 TiO2(B)-NaBH4X依旧保持原有的晶体结构,没有发生相变,仅有结晶度的变化。
(2)使用 NaBH4将 Ti4+还原为 Ti3+,扩展了材料的吸收光谱,将带隙由3.15 eV降低至2.82 eV,吸收光谱从400 nm扩展到600 nm,成功实现可见光吸收与可见光催化。
(3)试验证明使用3 gNaBH4还原的TiO2(B)-NaBH43样品具有最佳的可见光光催化分解水产氢性能,达 0.58 μmol·h-1·g-1,同时拥有最佳可见光催化降解活性,对MO在6 h时降解率约达40%。说明TiO2(B)-NaBH43样品拥有最好的可见光光催化活性。
