城镇污水处理工艺中溶解性微生物产物的光谱学特性
2020-05-21孟倩倩李明润丁祥伟
孟倩倩,李明润,丁祥伟,闫 涛,魏 东,2
(1. 济南大学 水利与环境学院,山东 济南 2500222; 2. 安徽国祯环保节能科技股份有限公司,安徽 合肥 230088)
活性污泥法是利用微生物的新陈代谢功能,将污水中的污染物转化为无害物质,使水质得到净化,已成为目前城镇污水和工业废水处理的主要手段之一[1]。污水处理厂常用的工艺和方法主要是厌氧/缺氧/好氧(A2/O)工艺、氧化沟工艺和间歇式活性污泥法(sequencing batch reacter,SBR)、生物膜法等。其中A2/O工艺具有较好的同步脱氮除磷的功能,是目前我国城镇污水处理项目建设中的主要工艺[2]。
研究发现,在废水生化处理过程中,出水中除了含有进水中的底物以及生物降解产生的中间产物和最终产物外,溶解性微生物产物(soluble microbial products,SMP)是出水有机物的重要组分。SMP是指微生物正常代谢活动及衰亡过程中所释放出的溶解性有机物[3],其组成较为复杂,目前已知的成分包括富里酸、腐殖质、多糖、核酸、蛋白质等[4]。由于SMP中的某些组分不易甚至难以生物降解[1],同时SMP分子结构容易发生电子诱导和共轭效应,与生物分子作用后毒性增强,对污泥具有生物毒性[5],而且SMP是废水生物处理出水的有机物的主要成分,提高了出水有机物含量,影响出水水质,因此对废水的生物处理及其尾水的深度处理效果产生不利的影响。
近年来,SMP的光谱学表征手段引起了人们的广泛关注,常用的表征方法有荧光光谱法、紫外-可见光谱法、傅里叶变换红外光谱(FTIR)法和核磁共振法等。其中荧光光谱技术中的三维荧光光谱(3D-EEM)技术不会破坏样品的结构,且灵敏度较高,选择性较好[6],能够对水中有机物的指纹性特征进行识别[7]。Wang等[8]使用三维荧光光谱评价了压力作用下SMP的产生释放情况,结果发现在激发波长、发射波长分别为230、330 nm处出现了微生物产物荧光峰。此外,FTIR法也被广泛地应用于研究有机物的组成结构与官能团性质。李磊等[9]运用 FTIR技术分析了养猪场废水室内处理过程中溶解性有机物的化学组分,鉴别了有机物的腐殖化程度和生物优先利用性。
本文中选取某污水处理厂A2/O工艺作为研究对象,利用3D-EEM、FTIR、分子量(molecular weight,MW)分布测定等手段,分析废水处理过程SMP的产生情况及光谱学特性,为今后水中SMP的控制研究提供参考。
1 实验
1.1 取样地点
以某城镇污水处理厂A2/O工艺为研究对象,其采用“进水—粗格栅—细格栅—A2/O(曝气阶段采用移动床生物膜反应器(MBBR)工艺)—二沉池—混凝沉淀—滤布滤池—最终出水”的处理工艺流程。在水处理工艺沿程设置11处采样点,分别为进水1处、厌氧段2处、缺氧段3处、好氧段4处、二沉池1处,对所取水样进行水质、荧光光谱特性、FTIR表征及分子量测定,分析水处理沿程SMP的产生特性。
1.2 试剂与仪器
实验用试剂包括: 磷酸,天津市大茂化学试剂厂; 4-氨基苯磺酰胺、N-(1-萘基)-乙二胺二盐酸盐,国药集团化学试剂有限公司; 酒石酸钾钠,天津市科密欧化学试剂有限公司; 盐酸,山东莱阳经济技术开发区精细化工厂; 氨基磺酸,天津市北联精细化学品开发有限公司。以上试剂均为分析纯。
实验用仪器主要包括:TU-1901型紫外可见分光光度计,北京普析通用仪器有限责任公司;LS-55型荧光光度计,美国PerkinElmer公司;FTS-165型红外光谱分析仪,美国Perkin Elmer公司;1260型凝胶色谱分析仪,美国安捷伦科技公司。
1.3 分析方法
1.3.1 水质测定方法
1.3.2 3D-EEM
3D-EEM的测定参数设置如下: 激发波长为200~400 nm,增量为10 nm; 发射波长为280~550 nm,增量为0.5 nm,扫描速度为1 200 nm/min。
1.3.3 FTIR
采用FTIR仪对样品进行测试,测试前,SMP水样置于冷冻干燥机中,在-60 ℃温度下冷冻干燥48 h。
1.3.4 MW分布测定
MW分布是SMP的一项重要研究内容[10],本文中使用凝胶色谱柱进行分子量测定。
2 结果与讨论
2.1 A2/O水质分析

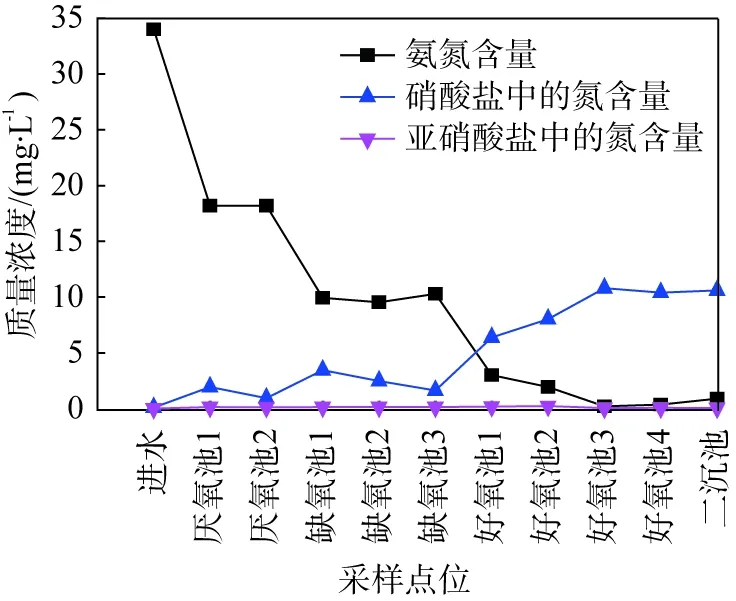
图1 城镇污水处理工艺中水质的沿程变化
2.2 3D-EEM
图2所示为城镇污水处理A2/O工艺中各个阶段水样中SMP的3D-EEM。由图可以看出,SMP的图谱中有3个主要的峰: 出现于激发波长和发射波长分别为230、350 nm处的特征峰与芳香族蛋白质类物质有关,在激发波长和发射波长分别为240、440~450 nm处的特征峰与富里酸类物质的存在有关,出现于激发波长和发射波长分别为330、430 nm处的特征峰与腐殖酸类物质有关[11]。
由图2(a)、(b)中可以看出,在2个厌氧池SMP水样中3个特征峰没有明显变化,图2(c)—(i)显示,在缺氧池和好氧池水样中3个峰发生了明显的变化。在缺氧池水样中,芳香族蛋白质类物质的相对荧光强度从150.94增大到177.91,这可能与在缺氧池1中添加液体碳源有关。此外,芳香族蛋白质类物质的相对荧光强度在好氧池1—4的出水中从150.01减小到124.30,可能是类蛋白类物质在好氧条件下很容易发生生物降解所致[12]。同时,腐殖酸类物质的相对荧光强度在好氧池1—4出水中无明显变化。之前也有相关文献[13]报道认为,腐殖酸类物质很难进行生物降解。富里类酸物质的相对荧光强度从153.35先增大到180.25后再减小到160.09,表明在缺氧池水样中SMP所含富里类酸物质先得到富集,然后很快被降解,具有很好的降解性能。由于没有明显的微生物代谢行为,二沉池水样(图2(j))中上述3类物质的荧光强度和位置与好氧池出水中的相比变化不大。

(a)厌氧池1进水(b)厌氧池2出水(c)缺氧池1(d)缺氧池2(e)缺氧池3(f)好氧池1
2.3 FTIR

图3 城镇污水处理不同阶段水样中溶解性微生物产物的红外光谱
利用FTIR对厌氧池2、缺氧池3和好氧池4出水中的SMP进行分析,可以表征A2/O工艺不同阶段SMP的官能团变化,如图3所示。由图可以看出,不同阶段水样中SMP的官能团组成相似,并且变化很小。3 351~3 369 cm-1左右的吸收峰与多糖的O—H基团和蛋白质的氨基有关[14],同时发现缺氧池中该峰消失,说明在缺氧环境下SMP中的多糖和蛋白质的结构发生了变化。1 640 cm-1的吸收峰归因于蛋白质中C—O键和C—N键的拉伸振动,好氧池中的蛋白质吸收峰的酰胺Ⅱ基团从1 646 cm-1移动至1 639 cm-1,这可能与大分子被分解成小片段有关[15]。1 404~1 410 cm-1附近的吸收峰与甲基中C—H键的变形振动有关[16]。1 102~1 133 cm-1处的吸收峰归属于多糖的对称C—O基团或C—O—C基团的伸缩振动。860 cm-1处的吸收峰证明C—H基团的存在,表明好氧池、缺氧池和厌氧池中均有碳水化合物的存在。
2.4 分子量分布
通过高效凝胶过滤色谱来测定不同分子量物质在波长为254 nm时的吸光度,进而得到A2/O工艺中不同阶段水样中SMP的分子量分布,如图4所示。

图4 城镇污水处理不同阶段水样中溶解性微生物产物的分子量分布
在城镇污水处理A2/O工艺中,SMP的分子量主要分布在小分子区域(0~1 000 Da)[17],分别为80、320、620、900 Da,分子量为80 Da的物质主要是小分子的氨基酸,其在进水中的含量明显要低于处理过程中的,原因是在污水处理过程中,氨基酸类物质被大量释放,其含量随着反应的进行也逐渐降低,说明氨基酸类物质被微生物降解。分子量为320、620、900 Da的物质含量变化不明显,这部分物质大都是蛋白质分解产生的小分子有机酸和氨基酸类物质[18]。由于有机酸和含氮化合物含量相对较低,微生物的生命活动不活跃,对蛋白质类物质的利用不充分,因此其降解产物变化不明显。
3 结论
本文中利用3D-EEM技术和FTIR法对城镇污水处理A2/O工艺不同阶段水样中的SMP进行测定,并结合高效凝胶过滤色谱的分子量分布测定及水质检测结果对SMP进行分析,得出如下结论:

2)3D-EEM结果显示,SMP主要成分为芳香族蛋白类物质、富里酸类物质及腐殖酸类物质,这些物质的相对荧光强度随着运行参数的改变而发生变化。
3)FTIR分析表明,在厌氧池2、缺氧池3及好氧池4出水中,SMP存在相似的官能团(蛋白质、多糖和碳水化合物),且在缺氧阶段的SMP中的多糖和蛋白质的结构发生了变化。
4)分子量分布测定结果表明: SMP的分子量主要分布在小分子区域(0~1 000 Da),分子量为80 Da的物质的含量在进水中明显要低于处理过程中的浓度,小分子有机酸和氨基酸的浓度沿程变化较小。
