茶多酚对H9C2大鼠心肌细胞缺氧/复氧损伤的保护作用机制
2020-05-21陈立慧李璐璐
陈立慧,李璐璐
0 引 言
缺血性心肌病在临床上高发,而溶栓或介入等再灌注治疗是目前治疗缺血性心肌病的最佳方法,但缺血的心肌细胞在恢复血供后仍会发生心肌细胞损伤加重甚至死亡的缺血再灌注损伤(ischemia reperfusion injury, IRI),导致患者心功能障碍甚至是致死性心律失常[1]。虽然导致心肌细胞IRI的机制复杂,但是氧化应激和炎症反应在心肌IRI发生和发展中发挥重要作用。茶多酚是一类从茶叶中提取的多酚类复合物,由于其来源广泛,且使用安全,引起了越来越多的关注和研究[2]。多项研究证实,茶多酚具有强大的抗氧化和抗炎能力,目前已有报道其在降压、降脂等保护心血管方面具有很好的作用[3],另有研究表明,茶多酚具有改善胰岛素抵抗、抗辐射、抗病毒、抑菌及抗病毒等药理学作用[4-5]。
本实验开展时间为2017年12月至2019年3月,我们利用缺氧孵箱和常规孵箱交替模拟缺血再灌注环境培养H9C2大鼠心肌细胞,观察茶多酚处理后缺氧/复氧损伤细胞的细胞活性,丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等氧化还原指标和髓过氧化物酶(myeloperoxidase, MPO)、白介素-1β(interleukin-1β, IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和白介素-6(interleukin-6, IL-6)等炎症指标含量变化和丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)和核因子κB(nuclear factor-κB, NF-κB)通路中p38、c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)、细胞外调节蛋白激酶(extracellular signal-regulated kinases 1/2, ERK1/2)和p65表达情况,研究其对心肌缺氧/复氧损伤的保护作用,为心肌IRI的防治提供更多的实验依据。
1 材料与方法
1.1 材料茶多酚(中国上海源叶生物科技有限公司),DMEM培养基(美国Gibco)、胰蛋白酶(美国Gibco)、胎牛血清(美国Gibco),CCK-8(美国Sigma),MDA试剂盒、SOD试剂盒、CAT试剂盒、GSH-Px试剂盒、MPO试剂盒、IL-1β试剂盒、TNF-α试剂盒和IL-6试剂盒均为南京建成生物工程研究所产品,辣根过氧化物酶标记的二抗购自美国Jackson公司,抗P-P38抗体、抗P38抗体、抗P-ERK抗体、抗ERK1/2抗体、抗P-JNK抗体、抗JNK 抗体、抗P65抗体和抗β-actin抗体购自美国Abcam公司;缺氧孵箱(德国贺氏),分光光度计(中国苏州威福光电)。
1.2 方法
1.2.1 细胞培养H9C2大鼠心肌细胞购自中科院上海生命科学研究院,选择3~8代细胞用做实验。用含10%胎牛血清的DMEM培养基在37 ℃的常氧细胞培养箱中培养H9C2大鼠心肌细胞,隔天换液。细胞生长至80%时用以实验[6]。
1.2.2 实验分组及给药按照随机数表法将细胞分为对照组、缺氧/复氧组、低浓度茶多酚组和高浓度茶多酚组。经过0.5 mg/mL、1 mg/mL、2 mg/mL、4 mg/mL和8 mg/mL这5个浓度梯度茶多酚的作用,检测细胞活性发现2 mg/mL和4 mg/mL的茶多酚对H9C2大鼠心肌细胞活性无显著影响,这与文献[4-5,7]报道一致。对照组予以上述细胞培养方法,常规孵箱培养H9C2大鼠心肌细胞;缺氧/复氧组利用缺氧孵箱和常规孵箱交替模拟缺血再灌注环境培养H9C2大鼠心肌细胞,具体为:利用缺氧孵箱(氧浓度为3%)培养细胞4 h(模拟细胞缺血状态)后放入常规孵箱(氧浓度为21%)继续培养4 h(模拟细胞缺血后再灌注状态),以此方法建立IRI细胞模型[8-10]。低浓度和高浓度茶多酚组处理H9C2大鼠心肌细胞时,在缺氧孵箱培养H9C2大鼠心肌细胞4 h后,分别更换为含有2 mg/mL和4 mg/mL茶多酚的培养基,放入常规孵箱继续培养。
1.2.3 CCK-8法检测细胞活性将H9C2大鼠心肌细胞培养在96孔板中,加入CCK-8反应48 h后用酶标仪检测各孔吸光度。以对照组的吸光度均值为100%,计算其余各组细胞活性[11]。
1.2.4 氧化应激指标和炎症指标的检测按照上述各试剂盒说明,在培养48 h后取各组细胞培养上清或细胞裂解液,加入反应试剂后利用酶标仪检测不同波长下各样本的吸光度,以此计算MDA、SOD、CAT、GSH-Px、MPO、IL-1β、TNF-α和IL-6等指标的含量[7]。
1.2.5 免疫印迹检测蛋白含量按照上述分组在6孔板中培养H9C2大鼠心肌细胞,待到细胞融合度在80%左右时,每孔加入50 μL含有蛋白酶抑制剂的放射免疫沉淀(radio immunoprecipitation assay, RIPA)裂解液裂解培养的H9C2大鼠心肌细胞,收集裂解液于离心管中,15 000 r/min低温离心15 min(有效离心半径为10 cm),利用蛋白浓度检测试剂盒检测所提取蛋白的浓度,按照1∶3比例混合上样缓冲液和蛋白,煮沸上述蛋白样本后进行电泳;每个孔上样40 μg上述煮沸后的蛋白样本,以90 V电压进行电泳,保持30 min后改为120 V,90 min后电泳结束后以250 mA恒流转膜2 h,随后利用盐水缓冲液稀释的5%的脱脂奶粉封闭液(5 g/100 mL)封闭,随后按照相应的浓度配制抗体(P-P38、P38、P-ERK1/2、ERK1/2、P-JNK、JNK、P65和β-actin)对醋酸纤维素膜分别进行4 ℃过夜孵育,利用盐水缓冲液洗膜5 min×3次后利用1∶10 000浓度的辣根过氧化物酶标记的二抗室温孵育1 h后进行发光检测[11]。
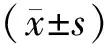
2 结 果
2.1 茶多酚对缺氧/复氧损伤H9C2大鼠心肌细胞活性的影响与对照组相比,缺氧/复氧组、低浓度茶多酚组和高浓度茶多酚组细胞活性减弱(P<0.05);与缺氧/复氧组相比,茶多酚组细胞活性增强(P<0.05),但未恢复到对照组水平(P<0.05);高浓度茶多酚组和低浓度茶多酚组差异无统计学意义(P>0.05),但茶多酚作用效果具有一定的浓度依赖性。见图1。

1:对照组;2:缺氧/复氧组;3:低浓度茶多酚组;4:高浓度茶多酚组与对照组比较,*P<0.05;与缺氧/复氧组比较,#P<0.05图1 利用CCK-8法检测茶多酚对缺氧/复氧后H9C2大鼠心肌细胞活性的影响
2.2 茶多酚对缺氧/复氧损伤H9C2大鼠心肌细胞氧化应激的影响与对照组相比,缺氧/复氧组、低浓度茶多酚组和高浓度茶多酚组细胞MDA含量增加(P<0.05),而SOD、CAT和GSH-Px含量均降低(P<0.05);与缺氧/复氧组相比,茶多酚组细胞MDA含量降低(P<0.05),SOD、CAT和GSH-Px含量增加(P<0.05), 但均未恢复到对照组水平(P<0.05);高浓度茶多酚组和低浓度茶多酚组差异无统计学意义(P>0.05),但茶多酚作用效果具有一定的浓度依赖性。见图2。

1:对照组;2:缺氧/复氧组;3:低浓度茶多酚组;4:高浓度茶多酚组与对照组比较,*P<0.05;与缺氧/复氧组比较,#P<0.05图2 茶多酚对缺氧/复氧损伤H9C2大鼠心肌细胞氧化应激的影响
2.3 茶多酚对缺氧/复氧损伤H9C2大鼠心肌细胞炎症因子的影响与对照组相比,缺氧/复氧组、低浓度茶多酚组和高浓度茶多酚组细胞MPO、IL-1β、TNF-α和IL-6含量均增加(P<0.05);与缺氧/复氧组相比,茶多酚组细胞MPO、IL-1β、TNF-α和IL-6含量减少(P<0.05), 但均未恢复到对照组水平(P<0.05);高浓度茶多酚组和低浓度茶多酚组差异无统计学意义(P>0.05),但茶多酚作用效果具有一定的浓度依赖性。见图3。
1:对照组;2:缺氧/复氧组;3:低浓度茶多酚组;4:高浓度茶多酚组与对照组比较,*P<0.05;与缺氧/复氧组比较,#P<0.05图3 茶多酚对缺氧/复氧损伤H9C2大鼠心肌细胞炎症因子的影响
2.4 茶多酚对缺氧/复氧损伤H9C2大鼠心肌细胞MAPK/NF-κB通路相关蛋白的影响与对照组相比,缺氧/复氧组、低浓度茶多酚组和高浓度茶多酚组细胞P-P38、P-ERK、P-JNK和P65表达均增加(P<0.05);与缺氧/复氧组相比,茶多酚组细胞P-P38、P-ERK、P-JNK和P65表达减少(P<0.05), 但均未恢复到对照组水平(P<0.05);高浓度茶多酚组和低浓度茶多酚组差异无统计学意义(P>0.05),但茶多酚作用效果具有一定的浓度依赖性。见图4、图5。
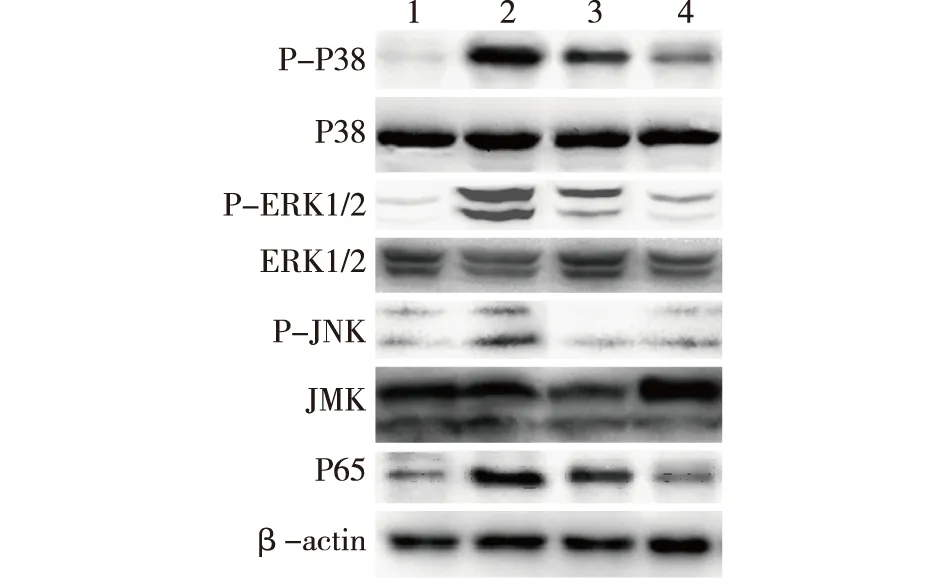
1:对照组;2:缺氧/复氧组;3:低浓度茶多酚组;4:高浓度茶多酚组图4 茶多酚对缺氧/复氧损伤H9C2大鼠心肌细胞MAPK/NF-κB通路相关蛋白的表达

1:对照组;2:缺氧/复氧组;3:低浓度茶多酚组;4:高浓度茶多酚组对照组比较,*P<0.05、**P<0.01;与缺氧/复氧组比较,#P<0.05,##P<0.01图5 茶多酚对缺氧/复氧损伤H9C2大鼠心肌细胞MAPK/NF-κB通路相关蛋白的影响
3 讨 论
目前IRI的细胞模型主要是利用耗氧剂连二亚硫酸钠除去培养液中氧,模拟组织细胞缺血缺氧。现有的IRI细胞模型利用含有连二亚硫酸钠培养基培养模拟缺血和再灌注的方法处理H9C2大鼠心肌
细胞,但虑到连二亚硫酸钠作用时只是部分模拟组织细胞的缺氧状态,并不是真正状态下的组织细胞缺氧,而是通过抑制细胞内部分呼吸酶模拟缺氧效果,且连二亚硫酸钠对细胞的毒性作用较强,对细胞活性影响较大[12]。相反,通过缺氧孵箱来模拟缺血再灌注模型可以完全避免上述问题,其通过控制培养细胞过程中的氧气含量,很好的模拟了缺血状态对细胞的生物学影响,而且其浓度恒定,操作简单,容易控制[13]。
IRI能够激活生物膜的脂质过氧化作用,而MDA可被作为是氧化应激程度的指标;正常情况下,组织内CAT、SOD和GSH-Px发挥着防止细胞过氧化的重要作用,当心肌细胞发生IRI时,氧自由基产生增加,CAT、SOD和GSH-Px等物质和产生的自由基迅速结合而含量急剧减少,故此时细胞的抗氧化能力下降,使得细胞膜等结构发生过氧化损伤,最终导致细胞损伤不可逆,直至细胞死亡,因而CAT、SOD和GSH-Px的活性可以反映细胞清除自由基的能力[14-15]。本实验结果表明茶多酚能够降低IRI诱导的H9C2大鼠心肌细胞中MDA含量及增加CAT、SOD和GSH-Px的活性减。本研究和其他一些茶多酚抗氧化的研究相似,Wang等[16]的研究表明茶多酚能够通过抗氧化作用减轻四氯化碳造成的小鼠肝损伤。Qian等[17]发现茶多酚可以通过其抗氧化作用减轻乙醇造成的胃黏膜损伤。Cong等[18]证实茶多酚可通过其抗氧化及抗凋亡作用抑制原代培养皮层神经元的谷氨酸兴奋性毒性。
心肌发生IRI时能够促进心肌细胞产生和释放多种炎性介质,包括MPO、IL-1β、TNF-α和IL-6等[14-18],本实验结果表明茶多酚能够降低H9C2大鼠心肌细胞中MPO、IL-1β、TNF-α和IL-6等炎症因子的含量。本研究和其他一些茶多酚抗炎的研究相似,潘妍霓等[19]研究表明,茶多酚能够通过TNF-α、NF-κB、IL-1β的表达发挥对四氯化碳致小鼠肝损伤的保护作用。沈海涛等[20]发现,茶多酚干预可通过减轻肾脏中氧化应激及炎症反应对百草枯中毒大鼠肾脏有保护作用。王晓芹等[21]发现,茶多酚可以通过减轻炎症反应和增强机体抗氧化能力改善大鼠胰岛素抵抗。
在组织发生氧化应激及炎症反应过程中NF-κB和MAPK信号通路可被激活,多种IRI中都已发现p38、JNK、ERK1/2和p65通路激活[22-23]。本实验中也观察到相似现象,我们发现H9C2大鼠心肌细胞发生IRI时p38、JNK、ERK1/2和p65通路被激活,而茶多酚能够有效抑制这些通路的活化,从而发挥抗氧化及抗炎作用,进而发挥对H9C2大鼠心肌细胞IRI的保护作用。
本实验虽在离体细胞学实验上观察到了茶多酚对H9C2大鼠心肌细胞IRI的保护作用,但是尚未进行在体实验,下一步我们将在体继续研究茶多酚对心肌IRI的保护作用,为进一步研究心肌IRI的防治提供更为确切的实验基础。
