基于MRI特征的脑胶质瘤异柠檬酸脱氢酶1表达预测研究
2020-05-21夏晓亮夏云宝陈利华向定朝耿承军
夏晓亮,夏云宝,陈利华,向定朝,耿承军
0 引 言
起源于胶质细胞的胶质瘤是中枢神经系统最常见的恶性肿瘤,约占原发颅内肿瘤的65%,近年来,胶质瘤的发病率在全球范围内急剧上升[1-3]。由于胶质瘤具有侵袭性生长、预后差、致死率高的特点,寻找早期诊断、预后评估的标志物成为目前研究的热点。异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)是三羧酸循环的关键限速酶,在代谢、细胞分化及血管生成方面发挥着重要的作用。IDH基因突变通常发生于Ⅱ级、Ⅲ级和继发性胶质母细胞瘤,在2016世界卫生组织分类中,将Ⅱ、Ⅲ及Ⅳ级胶质瘤分为IDH突变型及IDH野生型[4-6]。近年多项研究显示,尤其是IDH1突变的胶质瘤意味着更好的预后及更长的生存期,使IDH1成为了预测胶质瘤预后的重要靶点,但目前对于IDH1突变检测仍旧依赖于术后病理标本。MRI作为一种非侵入性检查,在胶质瘤诊断、复发、及治疗后评估中得到了广泛的应用。由于其具有无创、多参数、多平面成像及组织分辨率高等诸多优点,在临床中有很大的应用前景。本研究旨在利用MRI特征及临床检查数据建立术前检测IDH1突变的预测模型,为胶质瘤患者的临床治疗提供更多的参考。
1 资料与方法
1.1 研究对象回顾性分析2014年5月至2017年9月在我院就诊并术后病理诊断为胶质瘤的76例患者临床资料。其中男41例,女35例,年龄17~76岁,平均年龄(47.4±17.4)岁。纳入标准:①经术后病理证实为胶质瘤。②有术前完整MRI平扫及增强数据。③有完整的临床及实验室检查资料。④术前未行化疗、放疗。排除标准:合并颅内感染等。
1.2 MRI扫描方案MRI扫描采用GE Signa HDxt 3.0T MR超导型扫描仪,8通道头部专用线圈。扫描参数如下:①平扫轴位FSE T1WI:TR=195 ms,TE=7 ms,SL=5.0 mm,FOV=25 cm×25 cm,MATRIX=512×512;②平扫轴位FSE T2WI:TR=4500 ms,TE=92 ms,SL=5.0 mm,FOV=25 cm×25 cm,MATRIX=512×512;③轴位FLAIR:TR=8700 ms,TE=85 ms,SL=5.0 mm,FOV=25 cm×25 cm,MATRIX=512×512;④轴位DWI:TR=3000 ms,TE=79 ms,SL=5.0 mm,FOV=25 cm×25 cm,MATRIX=512×512;⑤增强对比剂采用钆喷酸葡胺(广州康臣),剂量为0.2 mmol/kg,流速为2.5 mL/s,延迟30 s扫描,包括轴位、矢状位及冠状位,扫描参数同平扫T1WI。
1.3 图像数据处理所有患者术前MRI图像分析全部在医院图像存储与传输系统(picture archiving and communication system,PACS)工作站完成,由2名工作8年和10年的神经系统放射科医师分别行双盲法独立分析,统计的特征包括:肿瘤最大直径、肿瘤部位、强化程度、边界是否清楚、是否累及多个脑叶、是否累及深部白质、周围水肿情况、肿瘤内出血、肿瘤内坏死囊变、表观扩散系数(apparent diffusion coefficient,ADC)值(取最大层面肿瘤实性部分,随机选取3个面积1 mm2感兴趣区测值,并取平均值)。对于分类变量数据,如有争议,由1名工作20年的神经系统放射科医师作出最终结论,对于连续变量数据,取2名观察者的平均值。本研究前所有观察者对影像特征的分类均参考美国国家癌症研究所肿瘤影像档案库(https://wiki.cancerimagingarchive.net/display/Public/VASARI+Research+Project)的影像特征描述准则,并参加为期2周的培训。
1.4 临床及实验室检查资料临床资料包括患者年龄、性别、癫痫发作病史、头痛病史、行为认知障碍、运动障碍、语言障碍,由神经外科医师提供。实验室检查包括血清C反应蛋白(C-reactive protein,CRP)、血清胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)、红细胞沉降率(erythrocyte sedimentation rate,ESR)。
1.5 术后标本病理及免疫组化检测术后标本病理分级及分类参照2016世界卫生组织中枢神经系统分级分类标准[7]。免疫组化染色采用EnVision 法,标本常规甲醛固定及石蜡包埋后行3 μm薄层切片,一抗、二抗孵育后二氨基联苯胺(DAB)显色,苏木精复染,中性树脂封固。阴性对照以磷酸盐缓冲液(PBS)代替一抗孵育。IDH1表达于细胞质,以细胞胞质内有棕黄色或棕褐色颗粒判为阳性细胞,光镜下随机观察10个高倍视野,以阳性细胞超过5%定义为IDH1突变阳性。根据IDH1突变结果将所有病例中IDH1突变阳性的划分为IDH突变组,反之则划分为IDH野生型组。
1.6 统计学分析所有数据使用R软件(version 3.4.4)进行统计学分析,比较2名观察者对影像特征的一致性,分类变量采用kappa一致性检验,连续变量采用组内相关系数(intraclass correlation coefficient,ICC)一致性检验。IDH野生型组与IDH突变组间影像及临床数据单变量分析,连续变量采用独立样本t检验,分类变量采用Chi-squared检验或Fisher’s精确检验,以P≤0.05为差异有统计学意义。对有统计学意义的指标行多变量logistic回归及10折交叉验证并建模,作列线图,通过影像特征对应的分数相加得出总分,通过总分可以得出IDH1突变概率。并采用受试者工作曲线(receiver operating characteristic,ROC)、校准曲线及决策曲线对模型进行评价。
2 结 果
2.1 一致性检验2名观察者对11项影像学特征的评估见图1。ICC/kappa值为0.86~0.98,显示了2名观察者间较高的一致性。

图1 胶质瘤患者MRI影像特征一致性分析结果
2.2 影像特征及临床资料单变量分析76例胶质瘤,术后病理及免疫组化显示,其中血管中心型胶质瘤2例,毛细胞星形细胞瘤5例,弥漫性星形细胞瘤21例,少突胶质细胞瘤7例,混合性少突-胶质细胞瘤16例,胶质母细胞瘤25例。WHO Ⅰ级7例,Ⅱ级22例,Ⅲ级26例,Ⅳ级21例。2例典型IDH1突变型和野生型的MRI图像、病理及免疫组化图片见图2、图3。入组对象中34例表现为IDH1突变型,42例表现为IDH1野生型。IDH1突变型组年龄为(46.38±18.49)岁,IDH1野生型组年龄为(48.14±16.74)岁,差异无统计学意义(P>0.05)。2组之间影像及临床单变量分析显示6个影像特征(肿瘤强化、肿瘤边界、肿瘤累及脑叶、肿瘤累及深部白质、瘤周水肿、瘤内坏死或囊变)差异有统计学意义(P<0.05),其余变量差异均无统计学意义(P>0.05),见表1、表2。
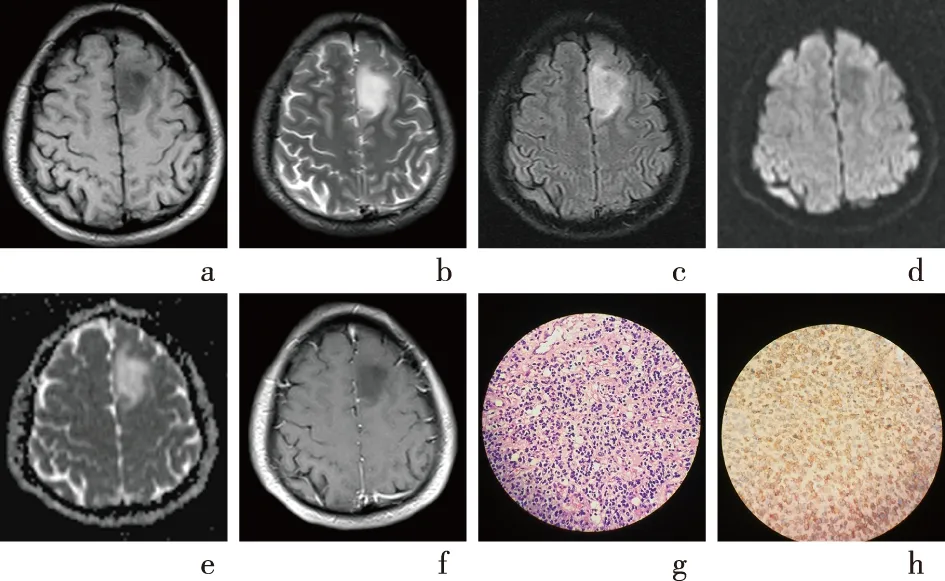
a-f:分别为T1WI、T2WI、FLAIR、DWI、ADC、增强T1WI图像;g-h:分别为HE染色及IDH1免疫组化(×400)图2 IDH1突变型脑胶质瘤MRI图像及术后病理图像

a-f:分别为T1WI、T2WI、Flair、DWI、ADC、增强T1WI图像;g-h:分别为HE染色及IDH1免疫组化(×400)图3 IDH1野生型脑胶质瘤MRI图像及术后病理图像
2.3 多因素logistic回归分析并建模对单变量分析中有统计学意义的6个变量行多变量logistic回归分析(逐步回归)及10折交叉验证并建模显示,肿瘤边界、肿瘤累及脑叶、肿瘤累及深部白质、瘤周水肿4个变量进入最终模型,见表3。对模型结果作列线图,见图4。采用ROC曲线对模型进行评价,曲线下面积(AUC)为0.92(95%CI:0.85~0.98),显示了模型较好的预测能力。模型校准曲线也显示了预测值和实测值之间较高的一致性。决策曲线显示阈值在>2%及<90%之间时,本模型均优于全或无简单模型,见图5。
表1 IDH1突变型组与IDH1野生型组脑胶质瘤患者MRI特征单变量分析结果

变量IDH1突变型组(n=34)IDH1野生型组(n=42)肿瘤部位(幕上/幕下,n)29/534/8肿瘤部位(左半球/右半球,n)20/1423/19肿瘤强化(轻度/明显,n)22/1213/29∗肿瘤边界(清楚/模糊,n)25/912/30∗肿瘤累及脑叶(单个/多个,n)23/1111/31∗肿瘤累及深部白质(是/否,n)8/2632/10∗瘤周水肿(轻度/广泛,n)25/98/34∗瘤内出血(不明显/明显,n)25/931/11瘤内坏死或囊变(不明显/明显,n)24/1013/29∗肿瘤直径(x±s,cm)5.47±1.825.04±1.61肿瘤ADC(x±s)0.96±0.120.97±0.13 与IDH1突变型组比较,∗P<0.05

a:ROC曲线;b:校准曲线(虚线为理想模型,实线为本预测模型);c:决策曲线图5 脑胶质瘤患者IDH1突变预测模型评价
表2 IDH1突变型组与IDH1野生型组脑胶质瘤患者临床资料单变量分析结果(n)
变量IDH1突变型组(n=34)IDH1野生型组(n=42)性别(男/女)18/1623/19癫痫(无/有)15/1920/22头痛(无/有)23/1127/15行为认知障碍(无/有)25/934/8运动障碍(无/有)29/535/7语言障碍(无/有)28/637/5CRP(<5/≥5 mg/L)11/2317/25IGF-1(<180/≥180 mg/L)10/2415/27ESR(<15/≥15 mm/h)13/2119/23肿瘤分级(Ⅰ+Ⅱ/Ⅲ+Ⅳ)15/1914/28
表3 IDH1突变结果多变量逐步logistic回归分析

变量βSEWaldOR值(95%CI)P值肿瘤边界-1.6440.7275.1160.193(0.047~0.803)0.024肿瘤累及脑叶-1.8100.7465.8900.164(0.038~0.706)0.015肿瘤累及深部白质3.9400.95017.12651.401(0.034~0.584)0.000瘤周水肿-2.4450.75010.6150.087(0.020~0.377)0.001

图4 基于脑胶质瘤患者MRI图像4个影像特征建立模型的列线图
3 讨 论
IDH是三羧酸循环中的关键限速酶,其可催化异柠檬酸形成α-酮戊二酸(α-Ketoglutarate,α-KG)、CO2和烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide-adenine dinucleotide phosphate,NADPH)[8]。2008年首次报道了在低级别胶质瘤及继发性胶质母细胞瘤中的IDH突变,研究发现IDH突变为胶质瘤的相对特异性突变,可能是胶质瘤发生早期的重要肿瘤驱动因素[9-10]。IDH家族有三种同工酶:IDH1、IDH2及IDH3,IDH1主要位于胞质和过氧化物酶体内,IDH2和IDH3主要位于线粒体内,IDH3尚未见突变的报道,IDH1、IDH2突变较为常见且相互排斥,其中最为重要的是IDH1突变。
首先,IDH1突变产生大量的2-羟基戊二酸(2-hydroxyglutaric acid,2-HG),2-HG与α-KG结构类似,可竞争性抑制许多α-KG依耐性酶,可能导致肿瘤的发生,同时,2-HG本身就是一种肿瘤细胞代谢产物,可能对神经系统恶性肿瘤的发生有促进作用。其次,IDH1突变可抑制脯氨酰羟化酶(prolyhydroxylase,PHD)的活性,并提高缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF1α)的表达,诱导下游效应如:血管生成、葡萄糖代谢和细胞增殖,从而可能促进肿瘤细胞生长、侵袭、血管生成及转移。说明IDH1突变是导致胶质瘤发生的重要因素[11-13]。但同时多项临床研究发现,IDH1突变与胶质瘤预后明显相关,IDH1突变的胶质瘤患者预示着更好的预后及更长的生存期,其机制尚不明确,考虑可能为IDH1突变既可导致胶质瘤的发生,又可抑制肿瘤细胞分化[14]。Sabha等[15]研究发现,在一组未经放射治疗的低级别弥漫性胶质瘤中,IDH1突变型组的生存时间明显长于IDH1野生型组。杨燕武等[16]也报道,在WHOⅡ级、Ⅲ级、Ⅳ级胶质瘤患者中,IDH1突变型组的无进展生存期及中位生存时间均长于IDH1野生型组。另一项研究显示,相对于IDH1野生型,IDH1突变型胶质瘤患者对化疗更为敏感[17]。因此IDH1成为近年研究胶质瘤治疗及预后的重要靶点。
MRI作为一种非侵入性检查,在胶质瘤诊断和评估中发挥着越来越重要的作用,由于其成像特性可间接反映肿瘤内部的代谢及分子机制,近年有多项基于MRI成像特征预测IDH1突变的研究报道。在这些研究中发现IDH1突变与MRI特征有着一些特定的关系,如IDH1突变型胶质瘤一般位于额叶,且很少位于脑干、间脑等深部脑组织,IDH1突变型胶质瘤相对于IDH1野生型胶质瘤,一般强化较弱、边界较清、肿瘤内囊变坏死较少、ADC值较高,呈相对良性的影像特征[18-22]。本研究收集了11项影像学特征及11项临床变量,进行单变量分析时,所有的临床因素均无统计学意义(P>0.05),有6项影像学特征有统计学意义(P<0.05),显示 IDH1突变型胶质瘤相对于IDH1野生型胶质瘤强化更弱、边界更清晰、一般累及单个脑叶、较少侵及深部白质、瘤周水肿较轻、瘤内囊变坏死较少见,证实IDH1突变型胶质瘤具有局部侵袭性较低的影像特征,这与之前的研究基本相符,但本研究显示2组间ADC值无明显统计学意义,这与之前的部分研究不符[23],考虑为样本量较少且未行亚组分析的原因,在后续的研究中将行进一步分析。多变量logistic回归分析,肿瘤边界、肿瘤累及脑叶、肿瘤累及深部白质、瘤周水肿进入最终模型,为预测IDH1突变的独立因素,采用ROC曲线、校准曲线、决策曲线对模型进行评价,证实了模型较高的预测能力。
本研究收集了胶质瘤患者部分临床资料及MRI半定量特征,建立了IDH1突变预测模型及列线图,并对模型进行了多维评价,这对临床决策提供了重要参考,但仍有一些不足,本研究为单中心回顾性研究,且样本量偏少,未对不同病理类型的胶质瘤行亚组分析,也缺少外部验证结果,这在下一步工作中将行进一步论证。
