大鼠HIRI模型中氧化损伤和Hcy含量的研究
2020-05-21卢建升田新雁王永宽
卢建升,田新雁,苏 娟,吕 兴,王永宽,庞 博,周 萍*
(1.大理大学药学与化学学院,云南大理 671000;2.大理大学基础医学院,云南大理 671000)
肝缺血-再灌注损伤(hepatic ischemia-reperfusion injury,HIRI)是肝脏组织缺血一段时间后再恢复血液灌注,不但没有使肝脏功能、结构恢复,反而加重其损伤程度的现象。HIRI是肝移植、休克复苏、严重肝外伤及肝叶切除等过程中不可避免的,也是影响治疗效果和预后的重要原因之一,严重时可导致患者的肝功能衰竭甚至死亡〔1-2〕。
同型半胱氨酸(homocysteine,Hcy)是体内重要的氨基酸——蛋氨酸(methionine,Met)经脱甲基等一系列反应生成的中间产物,在人体内含量极少,是一种具有细胞毒性的含硫氨基酸〔3〕。Hcy在重金属离子(如Fe3+或Cu2+)的催化下易发生自身氧化,生成超氧化物、过氧化氢和羟自由基等活性氧参与动脉粥样硬化、糖尿病、高血压等多种疾病的发生〔4-6〕。
肝脏是代谢Hcy的主要器官,临床研究表明,血浆Hcy水平升高与肝功能损伤存在着密切的联系〔7〕。在HIRI过程中,Hcy是否参与了其损伤的加重,却未见报道。故本研究将通过建立肝缺血-再灌注(24 h)损伤模型,来探讨Hcy含量与氧化损伤在HIRI中的变化。
1 材料
1.1实验动物SPF级SD大鼠,雄性,体质量180~220 g,购自昆明医科大学实验动物中心,合格证号:SYXK(滇)K2015-0002,适应性饲养1周后,建立大鼠HIRI模型。
1.2药物与试剂BCA蛋白质定量试剂盒(天根生化科技有限公司,批号:20190309);天门冬氨酸氨基转移酶(AST)测定试剂盒(批号:20190718)、丙氨酸氨基转移酶(ALT)测定试剂盒(批号:20190718)、总超氧化物歧化酶(SOD)测定试剂盒(批号:20190718)和丙二醛(MDA)测定试剂盒(批号:20190917)均购自南京建成生物工程研究所;同型半胱氨酸(Hcy)测定试剂盒(批号:201907)、透明质酸(HA)测定试剂盒(批号:201907)和层粘连蛋白(LN)测定试剂盒(批号:201907)购自上海泛柯实业有限公司;其他试剂均为分析纯。
1.3主要仪器无创血管夹(上海医疗器械有限公司);JR-30鼠恒温实验台(成都泰盟软件有限公司);VCX130超声细胞粉碎仪(SONICS,美国);冷冻高速离心机(珠海黑马医学仪器有限公司);数显恒温水浴锅(常州国华电器有限公司);快速混匀器(常州国华电器有限公司);超低温保存箱(海尔股份有限公司);荧光显微镜(OLYMPUS,日本);多功能酶标仪(Gene Company Limited,美国);T6紫外分光光度计(北京普析)。
2 方法
2.1实验动物分组取40只SD大鼠随机分为3组:假手术组(S)、缺血组(I)和缺血-再灌注组(I/R)。S组开腹90 min后,根据继续饲养0 h和24 h,随机分为S-I组和S-I/R组,每组10只;I组仅缺血90 min不再灌注,10只;I/R组缺血90 min后,再灌注24 h,10只。
2.2 HIRI模型建立术前24 h禁食不禁水。腹腔注射1%戊巴比妥钠(6 mL/kg)麻醉大鼠,下腹正中切口,暴露出肝脏门三静脉,根据刘俊平等〔8〕的方法,I组和I/R组采用无创血管夹夹闭肝左外侧叶和中叶的肝动脉、门静脉,阻断入肝约70%血流,90 min后除去,S-I组和S-I/R组只进行肝蒂部干扰。S-I/R组和I/R组缝合腹部切口两层,使大鼠从麻醉中恢复,继续饲养24 h后取材(S-I组和I组分别开腹90 min和缺血90 min后直接取材)。大鼠手术过程中保持在鼠台上,控制体温在(37±0.5)℃,大鼠下腔静脉采血(3%肝素钠抗凝),4℃,3 000 r/min离心10 min,分离得血浆-80℃冻存备用。
2.3肝脏采取与匀浆采血结束后,遵循动物伦理道德处死大鼠,分离得大鼠肝左外侧叶。取约1 g肝组织,按质量-体积为1∶9的比例加入0.9%氯化钠溶液,在功率为60%,超声循环5次(超声10 s与冰浴30 s为一个循环)的条件下制备10%匀浆液,4℃,3 000 r/min离心10 min,分离得10%肝匀浆上清液,-80℃冻存备用。
2.4肝组织病理变化苏木精-伊红(HE)染色法取肝左外侧叶部分组织,4%多聚甲醛固定24 h后,制备4μm厚切片,显微镜下观察肝组织病理损伤变化。
2.5肝功能指标测定按照试剂盒说明书步骤操作,于多功能酶标仪505 nm波长测定血浆中AST和ALT活力。
2.6肝组织生化指标检测取肝组织匀浆上清液,采用BCA法测定其总蛋白浓度。分别根据试剂盒说明书测定肝匀浆SOD活力,MDA、Hcy、HA和LN的含量。
2.7数据统计分析应用SPSS20.0统计分析软件分析数据,计量资料均以(s)表示,组间差异比较采用单因素方差分析(One-Way ANOVA),两组间比较采用LSD-t检验分析,P<0.05为差异有统计学意义。
3 结果
3.1大鼠HIRI模型建立情况通过手术阻断大鼠左肝叶及中叶血供,致大鼠约70%肝组织缺血90 min,恢复供血0 h或24 h的损伤模型的动物存活率高,大鼠HIRI模型建立的情况见表1。
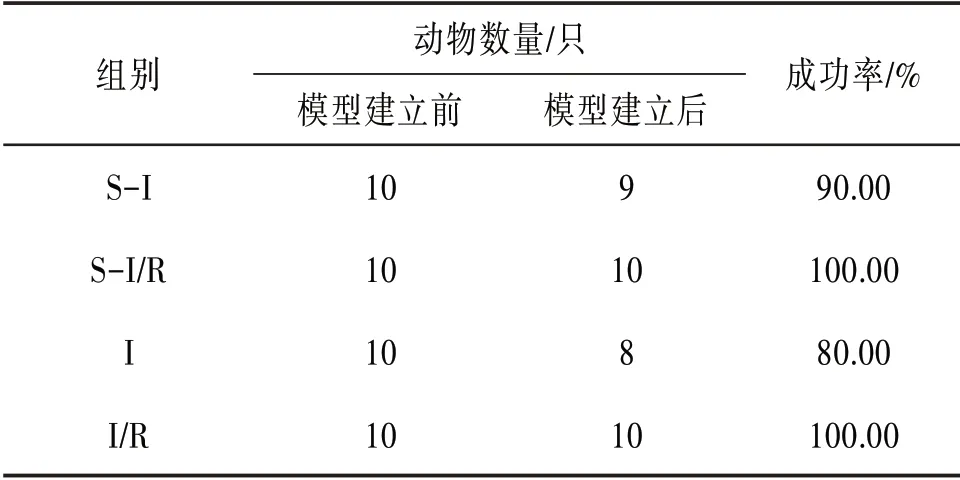
表1 大鼠HIRI模型建立情况
3.2肝组织病理变化HE染色结果显示,S-I组和S-I/R组肝脏中央静脉清晰完整,肝细胞呈索状排列整齐,肝细胞大小均匀,无变性和坏死,见图1A、B;I组肝细胞索状排列不整齐,分布不均匀,有少量变性和坏死,肝窦挤压变形且有明显淤血,有炎性细胞浸润,见图1C;I/R组肝窦受挤压消失,肝细胞明显肿胀,分布不均匀,明显的变性和坏死,有炎性细胞浸润,见图1D。

图1 大鼠肝组织病理观察(HE染色,×200)
表2 大鼠血浆中ALT和AST的活力变化(

表2 大鼠血浆中ALT和AST的活力变化(
注:与S-I组比较**P<0.01;与S-I/R组比较##P<0.01。
3.3大鼠肝功能的变化检测血浆ALT和AST的活力能准确反映肝脏的损伤程度。I组和I/R组分别与S-I组和S-I/R组比较,大鼠血浆AST和ALT活力均显著升高,差异有统计学意义(P<0.01)。见表2。
3.4大鼠肝脏氧化指标的变化I组和I/R组分别与S-I组和S-I/R组比较,肝组织SOD活力均显著降低,差异有统计学意义(P<0.01),MDA含量升高,差异有统计学意义(P<0.05,P<0.01)。见表3。
3.5大鼠肝脏中Hcy含量的变化与S-I/R组和I组比较,I/R组大鼠肝组织Hcy含量升高,差异有统计学意义(P<0.01,P<0.05)。见表3。
表3 大鼠肝组织中SOD活力变化,MDA、Hcy、HA和LN含量的变化(
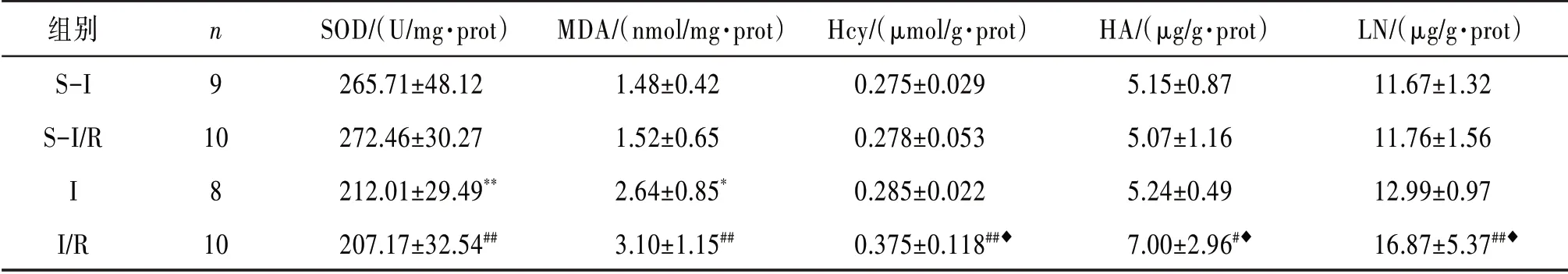
表3 大鼠肝组织中SOD活力变化,MDA、Hcy、HA和LN含量的变化(
注:与S-I组比较*P<0.05,**P<0.01;与S-I/R组比较#P<0.05,##P<0.01;与I组比较◆P<0.05。
3.6大鼠肝纤维化指标的变化与S-I组比较,I组大鼠肝组织HA和LN的含量变化没有统计学意义(P>0.05);与S-I/R组和I组比较,I/R组大鼠肝组织HA和LN含量均升高,差异有统计学意义(P<0.05,P<0.01)。见表3。
4 讨论
在肝移植、休克和阻断血管的肝脏切除等外科手术过程中,均可发生HIRI现象。影响HIRI的常见因素有缺血时间、缺血程度及再灌注的条件等〔9〕,若再灌注损伤严重,可能诱发肝炎、肝纤维化甚至肝硬化〔10〕。HIRI主要表现为肝细胞坏死,研究〔11-13〕发现其发病机制与氧化应激相关,机体产生广泛的活性氧及脂质过氧化反应等攻击肝细胞,造成肝细胞损伤,表现为SOD活力降低和MDA含量升高等。本研究结果显示,与S-I/R组比较,I/R组的肝脏病理切片损伤明显,肝细胞出现明显的变性和坏死病变,血浆中AST和ALT也显著增高,表明肝缺血-再灌注引起了肝损伤;I/R组肝组织中MDA的含量明显增高(P<0.01),I/R组MDA含量虽较I组增高但差异没有统计学意义(P>0.05),说明HIRI模型中对组织造成损伤,不是缺血本身引起的,而是恢复供血后过量的自由基攻击损伤细胞造成的。
当肝脏功能不全或肝脏受损时,将会导致机体糖类、脂质类及氨基酸等代谢障碍,其中Hcy代谢也将会受阻〔14〕。Hcy是一种具有细胞毒性的含硫氨基酸,与多种疾病发生发展相关的因子〔15〕,易在金属离子的存在下发生自身氧化,生成超氧化物、过氧化氢和羟自由基等活性氧进攻组织细胞并导致组织细胞损伤。I/R组肝组织中Hcy的含量比S-I/R组和I组均增高(P<0.01,P<0.05),表明在大鼠HIRI模型中,Hcy代谢受阻。据报道〔16〕,Hcy含量的升高能导致细胞发生氧化应激,在大鼠HIRI模型中Hcy可能参与HIRI的发生。此外,与S-I/R组和I组比较,I/R组肝组织中HA和LN的含量均升高(P<0.05,P<0.01),说明肝脏缺血-再灌注后,肝组织出现了胶原的沉积增加,与刘俊平等〔8〕研究相符,提示HIRI可能促发肝纤维化的发生。
综上所述,肝缺血-再灌注能通过氧化应激作用引起肝损伤,Hcy含量升高,后期可能促进纤维化的发生,为肝脏疾病的研究提供理论依据。
