一维普鲁士蓝/硅藻土复合材料对Cs+的吸附
2020-05-20姚初清戴耀东朱仲华柴凡超
姚初清,戴耀东,罗 威,朱仲华,柴凡超
南京航空航天大学 材料科学与技术学院,江苏 南京 211106
近年来随着核能应用的迅猛发展,核与辐射安全备受关注,如何处理核能应用中产生的大量放射性废水成为亟待解决的问题。在众多处理方法中,吸附法以其成本低廉、操作简单、去除率高等优点受到青睐。目前常用的去除放射性废水中Cs+的吸附剂主要有活性炭[1]、蛭石、蒙脱土[2]等,这些吸附剂虽然易于获得但存在吸附量低、吸附选择性差等缺点。因此研究具有高效吸附性能的吸附剂具有重要意义。
普鲁士蓝是一种面心立方结构的八面体配位化合物,分子式为K4Fe[Fe(CN)6]·nH2O。研究表明,Cs+与普鲁士蓝立方体结构中体心间隙的K+交换,使得普鲁士蓝具有良好的选择性吸附能力,常用于去除放射性废水中的Cs+ [3-4]。普鲁士蓝的结构、尺寸对它的吸附能力有很大的影响,一些特殊形态的普鲁士蓝如普鲁士蓝纳米立方体表现出优异的吸附、磁学等性能,一维结构的普鲁士蓝相比普通结构有更大的比表面积,能提供更多的吸附位点,因此制备一维结构的普鲁士蓝可以有效提高其吸附性能[5-7]。硅藻土是一种具有高度多孔结构的硅质岩石,其化学成分以SiO2为主,比表面积大、化学稳定性高,由于其表面带有负电荷,被应用于吸附各种金属离子、有机化合物[8-9]。本工作拟采用模板法合成一维结构的普鲁士蓝,利用共沉淀法将其负载到硅藻土表面,形成一维普鲁士蓝/硅藻土复合吸附材料。通过改变溶液浓度、温度、吸附时间、pH值等条件,研究一维普鲁士蓝/硅藻土对Cs+的吸附性能,获得饱和吸附量、吸附平衡时间等参数的变化规律,为探究普鲁士蓝/硅藻土处理含Cs+放射性废水的可行性提供一定的实验依据。
1 实验部分
1.1 材料和设备
亚铁氰化钾、三氯化铁、十六烷基三甲基溴化氨(CTAB)、十二烷基磺酸钠(SLS)、氯化钾、氯化铯、铯标准溶液(1 g/L),分析纯,阿拉丁试剂公司;直链藻硅藻土,浙江嵊州市华力硅藻土制品有限公司;无水乙醇,分析纯,国药集团化学试剂有限公司;盐酸,分析纯,南京化学试剂股份有限公司。
KB-3-1盘旋混合仪,海门市其林贝尔仪器制造有限公司;JT601N电子天平,精度万分之一,上海精天电子仪器有限公司;85-1磁力搅拌器,南京科尔仪器设备有限公司;SC-04离心机,转速4 000 r/min,安徽中科中佳仪器有限公司;TAS-990原子吸收分光光度计,北京普析通用仪器有限责任公司;NEXUS870型傅里叶变换红外光谱仪,Thermo Nicolet公司;FEI Quanta 650型扫描电子显微镜,FEI公司;RigakuUltimate IV型X射线衍射仪,日本理学,扫描角度10°~90°,扫描速率为5°/min。
1.2 一维普鲁士蓝/硅藻土的合成
利用表面活性剂作为模板,共沉淀合成普鲁士蓝纳米棒,并将其附着在硅藻土表面,生成一维普鲁士蓝/硅藻土复合材料。阳离子型表面活性剂CTAB、阴离子型表面活性剂SLS作为模板[10-11],当表面活性剂的浓度超过临界胶束浓度后,表面活性剂分子在溶液中有序地形成胶团,浓度达到10倍临界胶束浓度后[12],胶团会形成棒状的形状。而同时加入阴、阳离子型表面活性剂,能有效地降低表面活性剂的临界胶束浓度,更容易形成棒状的胶团[13],胶团形成过程示于图1。胶团表面结合的[Fe(CN6)]4-、Fe3+混合后沉淀生成棒状的普鲁士蓝,与硅藻土混合后形成一维结构普鲁士蓝/硅藻土。
首先配制0.1 mmol/L的CTAB、SLS溶液各40 mL,待溶质完全溶解后,分别加入4 mmol的K4[Fe(CN6)]·3H2O和FeCl3·3H2O,然后磁力搅拌3 h充分混合,将K4[Fe(CN6)]混合溶液滴加至FeCl3混合溶液,溶液迅速变色,随滴加逐渐变至深蓝色,滴加完毕后磁力搅拌6 h,充分反应,再加入0.5 g硅藻土,搅拌12 h后,过滤得到沉淀,用1∶1(体积比)水/乙醇混合溶液多次清洗沉淀,去除模板剂,之后70 ℃真空干燥12 h即可得一维普鲁士蓝/硅藻土复合材料。
1.3 吸附实验
将10 mg吸附剂加入10 mL不同浓度的Cs+溶液中,置于盘旋混合仪上一定时间,4 000 r/min离心5 min取上清液用原子吸收分光光度计测量Cs+浓度(浓度测量三次),吸附量可由(1)式计算得出。
(1)
其中:qe为平衡吸附量,mg/g;ρ0和ρe分别是Cs+的初始和平衡质量浓度,mg/L;m是吸附剂的质量,mg;V是Cs+溶液体积,L。
2 结果与讨论
2.1 复合材料的FTIR和XRD分析
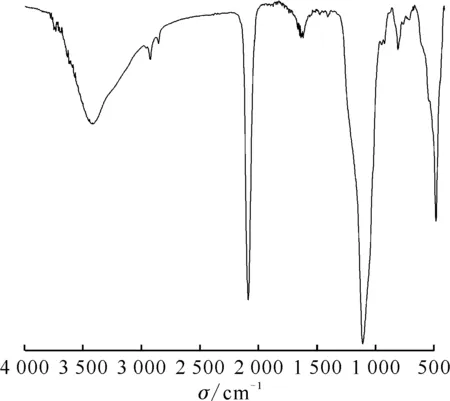
图2 一维普鲁士蓝/硅藻土的FTIR谱图
对一维普鲁士蓝/硅藻土复合材料进行FTIR分析,扫描范围为400~4 000 cm-1,结果示于图2。硅藻土由古代硅藻遗骸所组成,化学成分主要是SiO2·H2O,因此在图2中可以看到,在1 105 cm-1强而宽的吸收带是Si—O—Si的反对称伸缩振动,在798 cm-1和472 cm-1处出现的峰是Si—O键的对称伸缩振动峰,在3 415 cm-1附近的宽峰是水的—OH反对称伸缩振动峰,在1 631 cm-1附近的峰是水的H—OH—H弯曲振动峰[14]。而在2 084 cm-1处的尖峰是C≡N键伸缩振动峰,这也与普鲁士蓝中的[Fe(CN6)]4-符合。一维普鲁士蓝/硅藻土和一维普鲁士蓝的XRD谱图示于图3。由图3可知:一维普鲁士蓝和一维普鲁士蓝/硅藻土的XRD衍射谱图,其衍射峰与TiFe(CN)6·6H2O(JCPDS 23-0505)相符,表明样品的确是普鲁士蓝类化合物;与一维普鲁士蓝的衍射谱图比较,一维普鲁士蓝/硅藻土在2θ为20°~30°出现了馒头峰和数个尖锐的衍射峰,馒头峰是样品中含Si玻璃相的衍射峰,尖锐的衍射峰表明硅藻土含有一部分晶相SiO2。
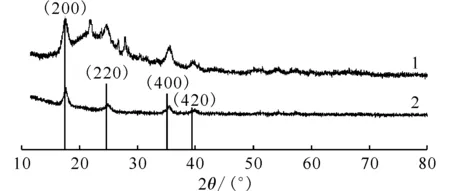
1——一维普鲁士蓝/硅藻土,2——一维普鲁士蓝
2.2 复合材料的SEM和EDS分析

图4 一维普鲁士蓝/硅藻土的SEM图像
一维普鲁士蓝/硅藻土的SEM图示于图4。从图4可知:一根棒状的普鲁士蓝附着在硅藻土表面,棒长约9 μm,直径约为160 nm。产物的EDS能谱结果列入表1。由表1可知:Fe元素的质量分数达到了17.2%,Fe是普鲁士蓝的主要组成元素,这表明该棒状产物的主要成分是普鲁士蓝;表1显示产物中含有一部分的Al,这是由于硅藻土本身含有少量的氧化铝。
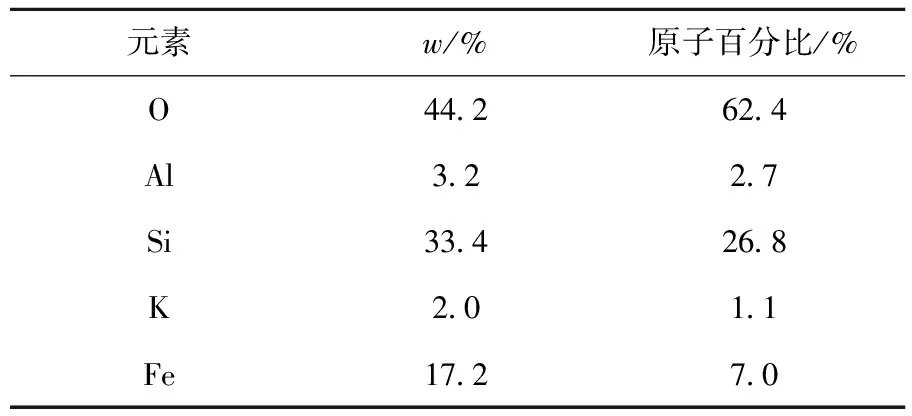
表1 一维普鲁士蓝/硅藻土的EDS表征结果
2.3 吸附动力学
为研究一维普鲁士蓝/硅藻土复合材料对Cs+的吸附动力学,将装有吸附剂和待吸附溶液的试管放入水浴恒温振荡箱在293 K、Cs+质量浓度为200 mg/g溶液下反应不同时间,离心后取上清液并测量Cs+浓度,对所测数据利用准一级动力学方程、准二级动力学方程、Elovich方程拟合,得到符合实验的动力学方程。准一级动力学方程、准二级动力学方程和Elovich方程的公式如下[15-17]:
qt=qe(1-e-k1t)
(2)
(3)
qt=bln(ab)+blnt
(4)
式中:t为吸附时间,min;qt为t时刻的吸附量,mg/g;qe是计算得到的平衡吸附量;k1和k2分别是准一级动力学和准二级动力学方程的速率常数;a、b是Elovich方程参数,分别表示初始吸附速率和脱附常数。
图5是动力学方程拟合曲线,表2是普鲁士蓝/硅藻土对铯吸附的准一级动力学、准二级动力学和Elovich方程的拟合参数。从图5可以看出:吸附数据与准二级动力学方程和Elovich方程符合的很好,而与准一级动力学方程相差甚远,由表2拟合的相关系数可知,准二级动力学方程(0.924)和Elovich方程的相关系数(0.974)远大于准一级动力学的0.755,这说明一维普鲁士蓝/硅藻土对Cs+的吸附既有物理吸附也有化学吸附[16],根据准二级动力学方程拟合得到的平衡吸附量为41.5 mg/g,k2为1.32×10-3g/(mg·min),这与293 K时测得的实际吸附量相符,根据Elovich方程得到的初始吸附速率也达到了0.327 mg/(g·min),说明吸附过程中化学吸附占优势[15]。一维普鲁士蓝/硅藻土对Cs+的吸附过程6 h基本能达到平衡,后续实验选择8 h作为吸附时间。
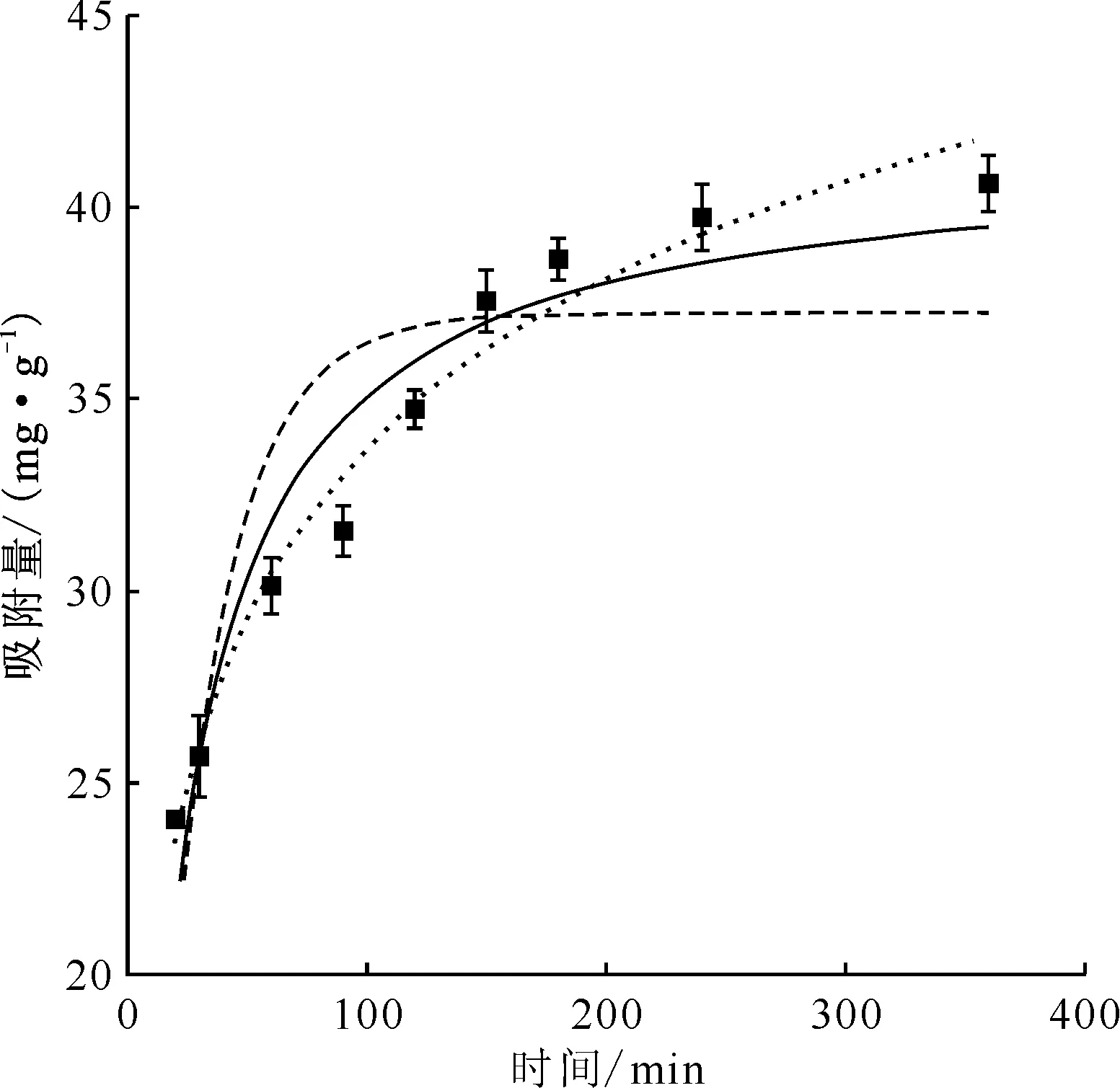
ρ0(Cs+)=200 mg/L — ——准二级,- - - ——准一级, ——Elovich方程
2.4 吸附等温线
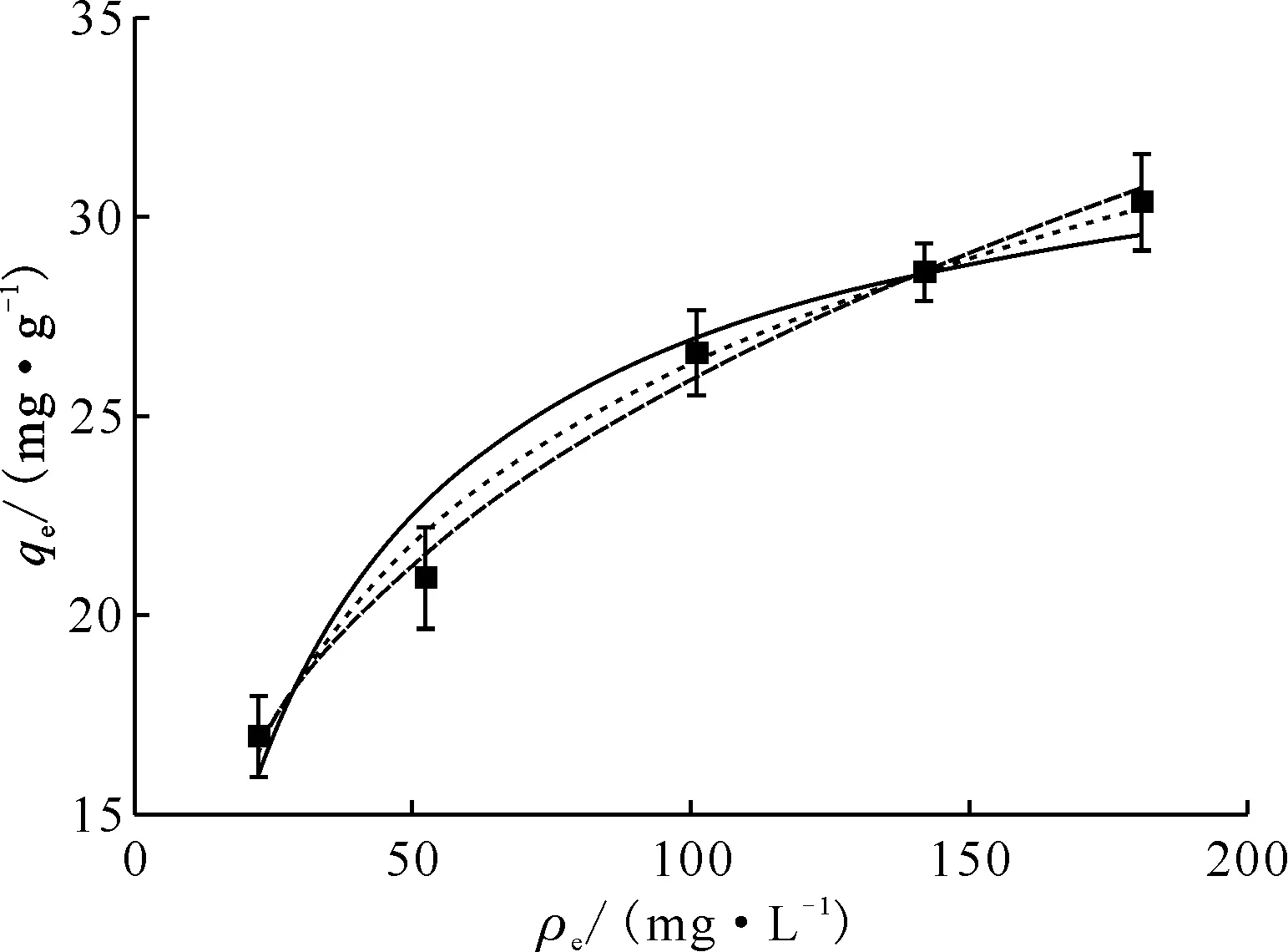
一维普鲁士蓝/硅藻土样品在293、301、308、318 K下,不同平衡浓度下Cs+的吸附量示于图6,普通普鲁士蓝/硅藻土样品在293 K下的吸附曲线示于图7。采用Langmuir、Freundlich和Tempkin模型对吸附等温线进行拟合,拟合参数列入表3。

表2 动力学方程拟合参数

t=8 h 模型:— ——Langmuir,- - - ——Freundlich, ——Tempkin
模型:— ——Langmuir,- - - ——Freundlich, ——Tempkin
Langmuir等温线[18]:
(5)
Freundlich等温线[15]:
(6)
Tempkin等温线[16]:
(7)
式中:qe是吸附达到平衡时的吸附量,mg/g;ρe是吸附平衡时溶液中Cs+质量浓度,mg/L;qmax是Langmuir等温线模型计算得到的饱和吸附量,mg/g;kL是Langmuir常数,L/g;kF是Freundlich常数,mg/g;1/n是与吸附强度有关的常数;R是气体常数,8.314 J/(mol·K);T是温度,K;A、bT是Tempkin常数。
由图6可知,一维普鲁士蓝/硅藻土对Cs+的吸附量随温度的升高而增加,当温度增至308 K以上时,吸附量不再增加,而根据Langmuir等温线拟合得到的饱和吸附量也与此相符。Freundlich等温线常数kF是与吸附剂的吸附能力有关的参数,表3中kF值随温度升高而增加;同时各温度下Freundlich等温线的n值均大于1,随温度的升高n值也在增加,说明一维普鲁士蓝/硅藻土对Cs+吸附较为容易[16],且吸附能力随温度升高而增强。从不同温度下等温线拟合的相关系数来看,Langmuir等温线的拟合结果更好,这说明一维普鲁士蓝/硅藻土对Cs+的吸附主要是发生在均匀的吸附剂表面的单层吸附,但也存在一部分不均匀表面的多层吸附[19]。图7是普通普鲁士蓝/硅藻土在293 K下对Cs+的吸附等温线,理论饱和吸附量(qmax)为33.5 mg/g,而同温度下一维普鲁士蓝/硅藻土的理论饱和吸附量达到了42.5 mg/g(表3),提高了26%,证明改变结构能够提高普鲁士蓝的吸附性能。
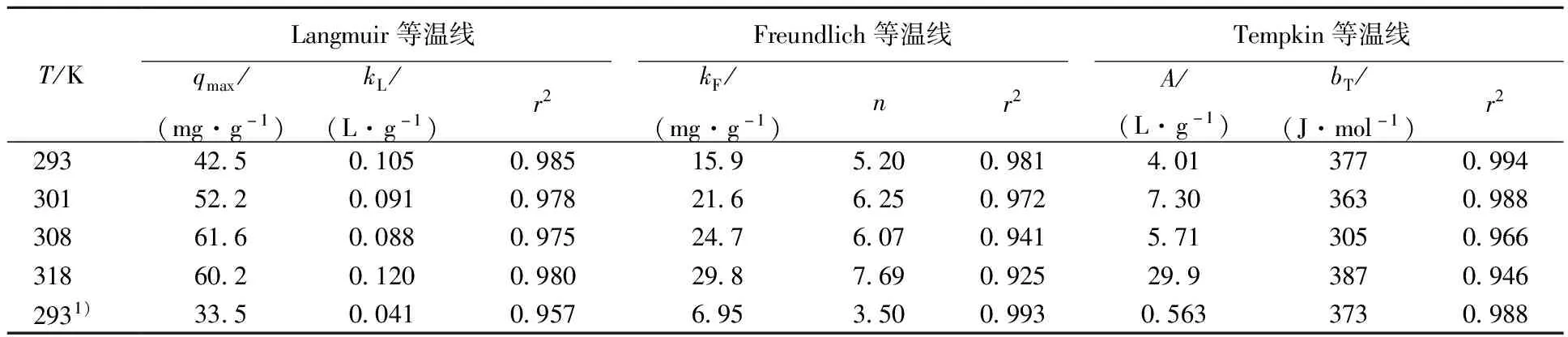
表3 等温线模型拟合参数
注:1) 普通普鲁士蓝/硅藻土
2)t=8 h
ρ0(Cs+)=200 mg/L,t=8 h (a)、(b)——298 K,(c)——308 K
2.5 pH对吸附的影响
293 K、Cs+质量浓度为200 mg/L下,不同初始pH值时一维普鲁士蓝/硅藻土对Cs+的平衡吸附量示于图8。由图8可知:在pH=4.5~6.0时一维普鲁士蓝/硅藻土对Cs+的吸附量稳定;当溶液pH从4.5下降到1.3,一维普鲁士蓝/硅藻土对Cs+的吸附量急剧下降;pH=1.3时,吸附量仅有22.5 mg/g。低pH值下吸附剂表面的正电荷密度较高,阻碍了阳离子的交换,从而使得一维普鲁士蓝/硅藻土的吸附量下降[16]。当pH为6.0~7.7时,溶液pH升高,一维普鲁士蓝/硅藻土的吸附量逐渐下降,这是由于普鲁士蓝在碱性条件下会分解为Fe(OH)3,pH>10时普鲁士蓝的分解会导致一维普鲁士蓝/硅藻土对Cs+的吸附量迅速下降。

T=293 K,ρ0(Cs+)=200 mg/L,t=8 h
2.6 不同共存离子对吸附的影响
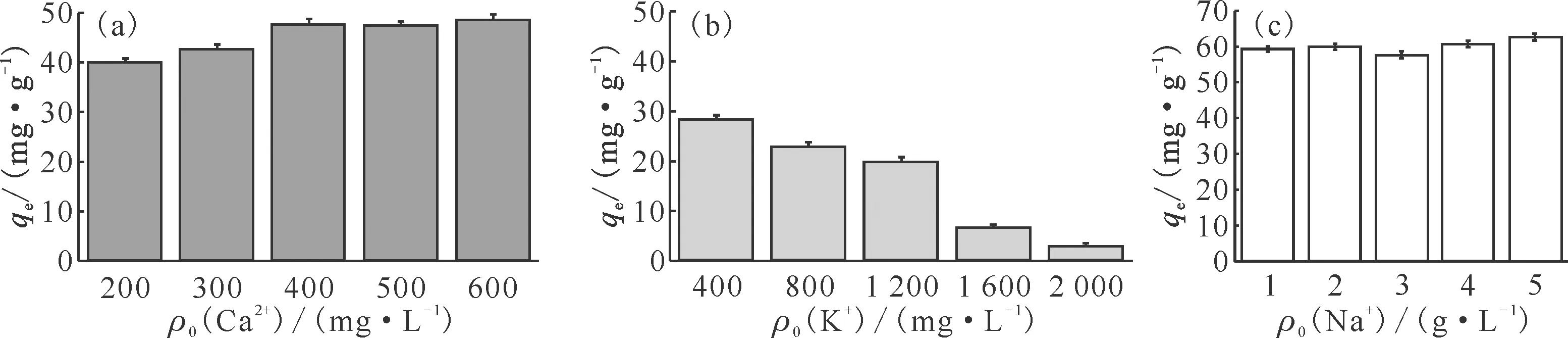
不同共存离子浓度下,一维普鲁士蓝/硅藻土对Cs+的吸附量示于图9,其中含Na+溶液吸附温度为308 K,其他均为293 K。由图9可知:K+对一维普鲁士蓝/硅藻土吸附Cs+的影响最大,当K+质量浓度达到2 g/L时,复合材料对Cs+的平衡吸附量下降了95%,主要是由于Cs+被普鲁士蓝吸附时将立方晶格结构内的K+交换出来,当Cs+和K+交换达到动态平衡时吸附也达到平衡,增加K+浓度相当于使吸附过程向释放Cs+的方向移动[4]。由图9也可以看到:随着K+浓度的升高,复合材料对Cs+的吸附量不断下降。同属碱金属族的Na+浓度却对Cs+吸附的影响不大,即使Na+质量浓度高达5 g/L,复合材料对Cs+的平衡吸附量也与308 K时的吸附量相差无几,这可能是由于Na+的离子半径小于K+和Cs+,使得Na+无法在普鲁士蓝晶体内形成稳定结构[20-21]。不同Ca2+浓度下,复合材料对Cs+的平衡吸附量与293 K时的吸附量(图6(a))偏差不大,说明Ca2+对一维普鲁士蓝/硅藻土吸附Cs+的影响很小。
3 结 论
利用模板法生长一维普鲁士蓝并将其附着在硅藻土表面制成一维普鲁士蓝/硅藻土复合材料,并通过实验探究了材料对Cs+的吸附性能。结果表明:
1) 一维普鲁士蓝/硅藻土复合材料对Cs+有较好的吸附效果,且平衡吸附量随温度升高而增加,一维普鲁士蓝/硅藻土对Cs+的吸附符合Langmuir吸附等温线,在308 K时的理论饱和吸附量达到了61.6 mg/g;
2) 准二级动力学方程较好地拟合了吸附动力学数据;同时一维普鲁士蓝/硅藻土的理论饱和吸附量相对于普通普鲁士蓝/硅藻土提高了26%;
3) 一维普鲁士蓝/硅藻土在弱酸条件下有较好的吸附效果,但在强酸环境下吸附量较低;高浓度K+会使一维普鲁士蓝/硅藻土对Cs+的吸附量降低,而Na+、Ca2+浓度对材料吸附Cs+的影响较小。
因此,一维普鲁士蓝/硅藻土复合材料显示了良好的应用前景。
