长尾大眼鲷COI基因序列的遗传多样性分析
2020-05-19姜芳燕韩冰冰王辉芳
姜芳燕,韩冰冰,李 语,王辉芳,杨 宁,黄 海
(1.海南热带海洋学院 a.热带海洋生物资源利用与保护教育部重点实验室;b.海南省热带海洋渔业资源保护与利用重点实验室,海南 三亚 572022;2.三亚市南繁科学技术研究院,海南 三亚 572000)
0 引言
长尾大眼鲷(Priacanthustayenus,Richardson 1846)隶属于属鲈形目(Perciformes),大眼鲷科(Pricanchidae),大眼鲷属(Priacanthus),俗称为红目连、大眼眶、大眼鸡、大眼圈等[1-2],为暖水性深水鱼类,分布于印度洋北部沿岸、东至印度尼西亚、北至中国,包括南海、台湾海峡、东海南部等海域[3],我国主要分布于海南、广东两地海域.长尾大眼鲷因其眼睛大而得名,瞳孔的一大半在身体中线的下面.其主要特征为身体呈长卵圆状、侧扁,体色多为粉红色或银白色而带粉红色光泽,头部大,吻较短,口裂较大,接近垂直,侧线完全,胸鳍短小,各鳍呈粉红色,且腹鳍布满黑色斑点.长尾大眼鲷属于暖水性底层鱼种,肉质鲜嫩,含多种氨基酸及粗蛋白、粗脂肪等营养成分,为南海北部近海底刺网、拖网渔业的主要捕捞对象之一[1-2].由于长尾大眼鲷良好的凝胶形成能力,现已成为东南亚国家鱼糜生产的重要鱼类[4-5].目前,国内外对长尾大眼鲷的研究主要集中在其生长分布[2]、骨骼[6]和肌肉营养组成[1,5]等方面,而有关长尾大眼鲷群体遗传多样性的研究鲜见报道.线粒体DNA与核DNA相比,具有母系遗传、变异率高、编码效率高、进化速度快、分子小、无组织特异性、检测方便以及解析能力强等优点,而被称为生物体种系发生的“生物钟”(molecular clock),在物种分类鉴定、系统学发生、遗传变异以及系统进化等领域应用广泛[6-7].其中,细胞色素c氧化酶亚基I(cytochrome c oxidase subunit I,COI)序列是最常用的遗传标记之一[8],具有遗传变异大、进化速率适中的特点,已证明COI基因序列可适用于种间、种内甚至是属以上阶元的遗传多样性分析[9],被广泛应用于鱼类、贝类以及其他无脊椎和脊椎动物的多样性分析、种类鉴别和系统分类和进化、分子生物学分析等科研领域[10-13].本研究主要以三亚海域采集的大眼鲷样本为研究对象,通过PCR扩增及测序方法获得长尾大眼鲷的COI基因序列,研究其在分子水平上的遗传进化关系,旨在为大眼鲷属鱼类的分类、遗传关系和系统进化提供分子生物学依据.
1 材料与方法
1.1 试验材料
样本采自海南省三亚市周边渔港,选择相对新鲜、体貌完整的长尾大眼鲷(Priacanthustayenus)作为样品,用放入冰袋的泡沫箱运回实验室.样品通过形态鉴定,取样后放入-20 ℃冰箱冰冻保存备用.
1.2 肌肉总DNA提取
鱼类肌肉总DNA提取采用北京索莱宝科技有限公司的动物组织DNA提取试剂盒,具体操作参照厂家说明书.
1.3 PCR扩增及测序
COI基因扩增引物为COI-F:(5′-CCTGCAGGAGGAGGAGAYCC-3′)和COI-R:(5′-AGTATAAGCGT CTGGGTAGTC-3′).PCR扩增条件设置参照文献[13]113,其中DNA聚合酶来源于广州东盛生物科技有限公司生产的Taq Plus DNA Polymerase(5 U·μL-1),COI基因片段PCR扩增后,经切胶回收,送往深圳华大基因有限公司测序.
1.4 数据分析
利用ClustalX 2.0对测序结果进行比对,并进行人工校对[14];采用MEGA 7.0分析不同序列的碱基组成、简约信息位点、变异位点、singleton位点以及核苷酸差异等,对不同单倍型之间遗传距离进行计算[15];系统树的构建参照已有文献进行[7]132;使用DNASP5计算核苷酸多样性(Pi)和单倍型多态性等[16].
2 结果与分析
2.1 长尾大眼鲷COI序列分析
长尾大眼鲷的COI基因序列PCR扩增的结果见图1,从图中可知,其片段大小约为700 bp.采用MEGA 7.0对序列进行比对和分析,结果表明,长尾大眼鲷群体的线粒体DNA 的COI基因片段长度为636 bp,A,T,G和C碱基的平均含量分别为22.3%,27.4%,19.3%和31.0%,A+T和G+C的平均含量约为50%,相差不明显.G+C在密码子的第1~3位的平均含量为39.8%~56.0%,表明4种碱基在密码子中出现频率有较明显的偏好性.
图1 长尾大眼鲷的COI序列PCR产物
2.2 单倍型分布
在17条COI序列中共定义了9个基因型,除Hap3占9条序列(出现频率高达52.94%)外,其余基因型都只有1条序列(出现频率仅为5.88%).在这9个单倍型中,有多态性位点57个,共58个突变,其中,简约信息位点只有1个,占总变异位点的1.75%.存在插入和缺失位点,如其中Hap1在第7位插入碱基T,在第21位缺失碱基C;Hap2在第21,585,589,608,626,636位分别缺失碱基C,A,G,C,G;Hap4在第29位缺失碱基A;Hap7在第2位缺失碱基C.
2.3 大眼鲷群体的遗传多样性
通过分析17条大眼鲷的COI序列可知,其单倍型多样性(Hd)为0.735,9种单倍型(基因型)的核苷酸多样性(Pi)为0.020 81,平均碱基差异(K)为13.027 78.各单倍型COI序列之间的遗传距离及标准误差详见表1.Tajima’s D的中性检验结果是-1.992 73,P<0.01,差异极显著.

表1 9种单倍型间的遗传距离及标准误差
注:对角线下面为遗传距离,对角线上面为其标准误差.
采用UPGMA法和NJ法构建长尾大眼鲷9个单倍型的分子系统树(图2和图3).结果表明,用这2种方法建树的分支情况基本一样,单倍型位置除Hap2外,其他单倍型在进化树上的位置均有变化.在UPGMA树中(图2),Hap2在最下层,往上依次为Hap6,Hap4,Hap5,Hap9,Hap1,Hap7,Hap8,Hap3,即在UPGMA树中,Hap2与Hap6的遗传距离最近,与Hap3最远;在NJ树中(图3),Hap2也在最下层,往上依次为Hap3,Hap8,Hap1,Hap5,Hap4,Hap9,Hap7,Hap6,即在NJ树中,Hap2与Hap3遗传距离相差最近,与Hap6相距最远.

图2 长尾大眼鲷9种单倍型的UPGMA系统发生树
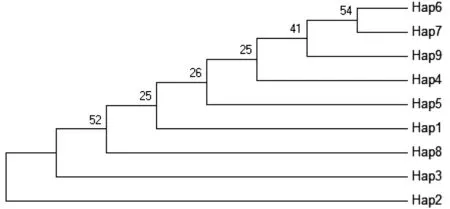
图3 长尾大眼鲷9种单倍型的NJ系统发生树
3 讨论
本实验采用中性选择分析的Tajima’s D检验分析长尾大眼鲷的种群扩张情况,如果有种群扩张现象出现,种群内部会有过多的低频变异出现,Tajima’s D中性检验能够检测到种群内部出现的低频变异,若其是负值且有显著意义时,即显示出种群扩张事件.本实验中,9种长尾大眼鲷的Tajima’s D的中性检验结果是-1.992 73,P<0.01,差异极显著,说明长尾大眼鲷种群经历过扩张事件[7]133.本实验采用线粒体的COI基因从分子水平上对大眼鲷进行种群进化的分析,在海洋生物物种鉴定方法中,线粒体蛋白编码基因的Msh 1序列[17]和线粒体DNA控制区的D-loop序列[18]同样具有较广泛的应用,但这些方法对大眼鲷的鉴定应用还有待进一步研究和验证.
长尾大眼鲷有较高的单倍型多样性(0.735),可能是由于环境的不均一、种群数量大或者是某些生活特征能适应种群的快速增长等原因造成的.就海洋鱼类来说,较大的种群数量是保持群体较高遗传多样性的基础,长尾大眼鲷在热带海洋中分布较广,可能为其较高的遗传多样性提供了基础.另外,研究用长尾大眼鲷群体的遗传多样性水平也相对较高(0.020 81).GRANT等[19]依据核苷酸多样性(Pi)与单倍型多样性(Hd)之间的关系,把种群扩张事件分成4种模式[7]133,根据这4种模式的划分依据标准,长尾大眼鲷COI序列的Hd值和Pi值均比较高,属于第4种群体扩张模式,说明南海长尾大眼鲷种群经历过扩张事件,推测其是由1个较大的种群经过长时间进化而来,也可能是由2个以上不同的种群2次接触后演化而来.
遗传多样性是物种适应、生存和进化最根本的基础.遗传多样性越丰富,说明该物种适应环境变化的能力越强,蕴藏的进化潜能越大,有丰富的育种和物种改良能力[20].尽管本研究显示出三亚地区长尾大眼鲷有较高的遗传多样性,但是其资源也可能因为人类的活动而减少.如近年来,三亚近海出现一定程度的污染,并呈现出日趋严重的趋势,加之没有节制的大规模捕捞,也会造成长尾大眼鲷资源的衰减.因此,有必要采取如加大污染治理力度或政府颁布相关法令等,以维持长尾大眼鲷野生资源的可持续性开发.
