热带海绵共附生真菌的分离与多样性分析
2020-05-19吴琪闽童剑锋杨振光李荭烨徐小雄冯慧敏
吴琪闽,童剑锋,李 聪,杨振光,李荭烨,徐小雄,冯慧敏
(海南热带海洋学院 a.食品科学与工程学院;b.生态环境学院,海南 三亚 572022)
0 引言
近年来,微生物研究领域发展迅速,如有对红树林根际土壤中的特定菌种进行分离鉴定[1];对阿宽蕉根基土壤放线菌的分离鉴定[2];海南发酵罗非鱼的细菌多样性分析[3]等研究.但是在陆源微生物资源被开发得越来越饱和的情况下,人们逐渐将研究领域转向了海洋微生物资源.海洋的表面积十分广阔,占到了地球的71%,体积更是达到了整个生物圈的95%[4]37.因为其巨大的表面积与体积,所以海洋中蕴含了极为丰富的生物资源.与陆栖微生物相比,海洋微生物处在高盐、高压、低温和低营养等极端条件下.生存环境的特异性,使海洋微生物在物种、基因组成和生态功能上表现出多样性和特异性,体内存在特殊代谢途径的酶,相应产生了一些特殊的活性代谢物质[4]60.例如,在肽类方面,2014年Yoon等[5]从未鉴定的海绵中分离得到了一株曲霉属真菌Aspergillussp.SF-5921,从其发酵产物的乙酸乙酯萃取液中分离得到一个能够产生抗神经炎性效果化合物;Prompanya C等[6]从海绵共生真菌-曲霉属真菌AspergillusSimilanensisKUFA0013的发酵液中分离得到对三种癌细胞有微弱的抑制活性的环肽类化合物similanamide[6].在生物碱类方面,2012年Cai等[7]从海绵来源曲霉属真菌ZHN-7-07的次级代谢产物中分离到具有微弱的抗甲流(H1N1)病毒活性的生物碱类化合物.此外在聚酮类、萜类等[8]亦具有新的发现.海洋源微生物作为一个广大的资源,蕴含了巨大的科研价值,正等待着科研学者们进行研究.
海绵是一种原始的无脊椎海洋后生物,在海洋中存在已经有6亿年之久.海绵群体数量庞大,占海洋动物种类的1/15,是在热带海洋中除珊瑚外的第二大生物量.全世界约有10 000~15 000种[9-10].虽然海绵是一种原始又简单的生物,但是近年来对海绵的研究表明其次级代谢产物在制药、治疗肿瘤、心血管和呼吸系统[11-14]等疾病领域具有很好的医疗价值.其底栖滤食的特殊性使得体内富集了大量微生物,能产生比其他海洋生物更为丰富的生物活性产物.海绵正逐渐成为科研人员研发海洋药物领域的一个重点对象.
本研究旨在从三亚海域热带海绵中分离出可培养的共附生真菌,研究其种属分布的多样性,为海绵共附生真菌的活性研究及其应用奠定基础.
1 材料与方法
1.1 实验材料
1.1.1 海绵样品
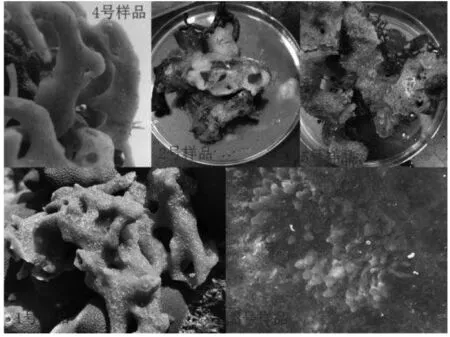
图1 供试热带海绵样品形态特征
本研究共使用5种海绵样品(如图1所示),它们采集自海南三亚天涯区红塘湾(18°18′10″N,109°10′0″E).样品采集后保存在无菌采样袋中,冰浴,当天带回实验室进行后续操作.
1.1.2 培养基
本实验采用4种分离培养基,分别为GPY、真菌II号、马丁培养基和MEA培养基,每种培养基均添加终浓度为100 mg·L-1的硫酸链霉素、100 mg·L-1的氯霉素和100 mg·L-1的氨苄青霉素.
(1)GPY培养基:葡萄糖20 g、蛋白胨10 g、酵母膏10 g、琼脂20 g、陈海水450 mL,ddH2O定容至1L,pH 7.5;
(2)真菌II号培养:葡萄糖10 g、甘露醇20 g、麦芽糖20 g、味精10 g、酵母膏3 g、玉米浆1 g、K2HPO40.5 g、MgSO40.3 g、琼脂20 g、陈海水450 mL,ddH2O定容至1 L,pH6.5;
(3)Martin培养基:葡萄糖10 g、蛋白胨5 g、KH2PO41 g、MgSO40.5 g、孟加拉红0.03 g、琼脂17 g、陈海水450 mL、ddH2O定容至1 L,pH自然
(4)MEA培养基:麦芽浸粉17 g、蛋白胨3 g、陈海水450 mL、ddH2O定容至1 L,pH自然.
纯化培养基采用PDA培养基(Solarbio,P8931),添加45%的陈海水,终浓度为100 mg· L-1的硫酸链霉素、100 mg·L-1的氯霉素和100 mg·L的氨苄青霉素.
1.2 方法
1.2.1 热带海绵可培养真菌的分离
将采集的海绵样品用无菌海水清洗3次,以去除表面附着物及其他杂质,然后分别进行3种预处理[15]26:(1)未做任何处理;(2)将海绵样品在10%EDTA溶液中浸泡30 min;(3)将海绵样品在60 ℃水浴中加热6 min.在超净工作台中,将经过预处理的样品分别用无菌手术刀和手术剪切成1 cm3左右的方块,放入无菌的研钵中,加入1 mL的无菌海水研磨至匀浆状,将匀浆吸取到无菌离心管中摇晃混匀后,制成10-1样品稀释液,再用无菌海水将配制好的10-1的样液稀释成10-2和10-3浓度梯度的稀释液.
采用倾注平板法对5个样品中的真菌进行分离,用移液枪吸取100 μL样液滴在培养皿中,然后倒入培养基摇晃均匀.每个处理3个平行,所有平板放在28 ℃恒温培养箱中倒置培养3~5 d,观察到菌落长出后及时将菌落转接到PDA培养基中进行纯化培养.纯化好的菌株置于20%的甘油,-70 ℃保存.
1.2.2 热带海绵可培养真菌的分子鉴定
采用CTAB法提取分离得到的纯化菌株的基因组DNA,利用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3)对基因组DNA进行PCR扩增,扩增产物通过1%琼脂糖凝胶电泳检测后送上海美吉生物医药科技有限公司测序.测序结果上传至NCBI(National Center for Biotechnology Information,https://www.ncbi.nlm.nih.gov/)进行Blast比对,以确定分离得到菌株的种属归类.
1.2.3 各样品可培养真菌的相似度分析
采用索伦森相似性系数(Sorenson Similarity Coefficient,CS)比较样品之间附生真菌种属组成的相似程度.计算公式为:CS=2A/(B+C).式中:A为两种样品共有种数或属数,B为样品B的附生真菌物种数或属数,C为样品C的附生真菌物种数或属数[16].
1.2.4 热带海绵可培养真菌的系统发育分析
将测序结果上传至NCBI比对后,选择与供试菌株相似度最大的序列为参比菌株序列.采用ClusterW对所有的序列进行比对,并进行手工调整,使用MEGA X软件,根据kimura模型估算系统进化矩阵,Bootstrap值设置为1 000,构建供试菌株与参比菌株的NJ系统发育树,从而分析热带海绵可培养真菌的系统发育关系.
2 结果与分析
2.1 热带海绵共附生真菌的分离结果
利用4种分离培养基从5份热带海绵样品中共分离得到33株真菌菌株,共计25个形态种.为初步确定分离菌株的分类地位,我们选择了25个形态种的特征菌株,扩增了其ITS序列并测序,结果如图2所示,这25个形态种隶属于14个属,其中木霉属Trichoderma为优势属,共分离得到11株菌,约占33.33%;其次为弯孢聚壳属Eutypella,共分离得到4株菌,约占12.12%;曲霉属Aspergillus和Cystobasidium属都分别分离得到了3株菌,约占9.09%;枝孢属Cladosporium和Paraphaeosphaeria属各分离得到2株菌,约占6.06%;Allocryptovalsa属、外瓶霉属Hortaea、Meyerozyma属、拟盾壳霉属Paraconiothyrium、Valsaria属、韦斯特壳属Westerdykella、威克汉姆酵母属Wickerhamomyces和炭角菌属Xylaria都仅分离到了一株菌,约占总数的3.03%.表1给出了14个属测序菌株、形态形似菌株、最大相似参比菌及其登录号,以及最大相似率.由表1中可知,菌株HMF07的最大相似菌株为Allocryptovalsapolyspora(Genebank ID:MF959500.1),二者的相似率为98.91%;菌株HMF08的最大相似菌株为Eutypellacitricola(Genebank ID:MG456731),二者的相似率为97.76%;菌株HMF23的最大相似菌株为Wickerhamomycesochangensis(Genebank ID:NR_154971.1),二者的相似率为98.29%,因此,这三个菌株可能是潜在的新的分类单元,需进一步研究确定.菌株HMF26与Paraconiothyrium属相似率最高,为99.61%,但是这一序列为未可培养的序列,因此,HMF26可能为首次分离获得的纯培养菌株.
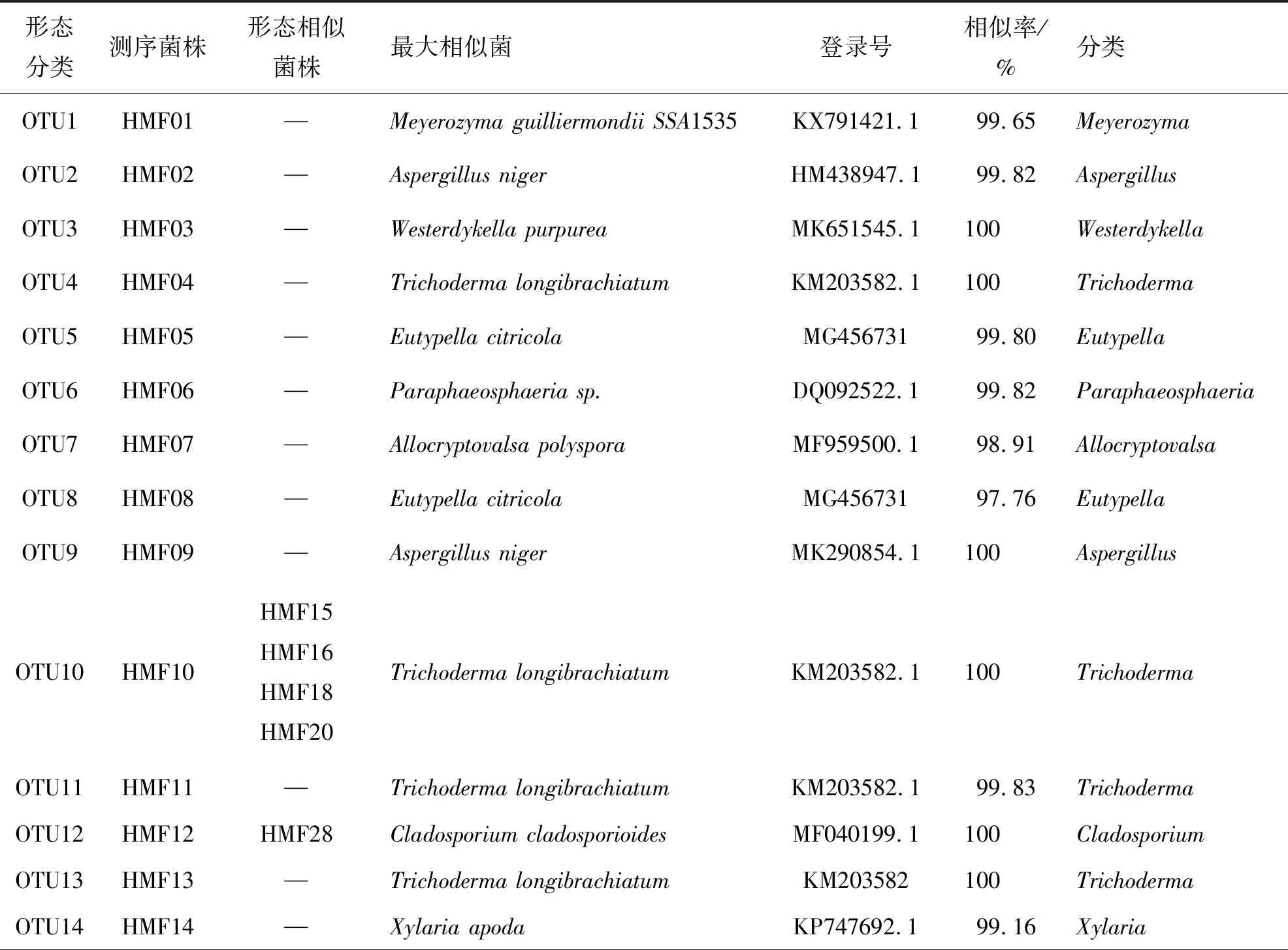
表1 热带海绵共附生真菌25个形态种的分类

表1(续)
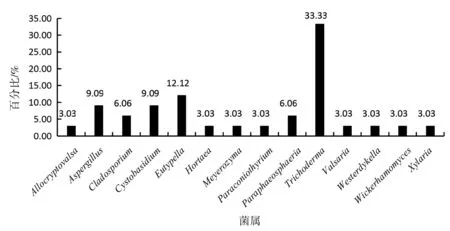
图2 热带海绵共附生真菌的多样性
2.2 热带海绵共附生真菌的组成与分布
各个海绵样品上的共附生真菌分离结果如表2所示.结果表明,海绵五号样品分离得到的菌株数量为12株,占分离种属的36.36%,其次为海绵一号样品,共分离得到11株菌,海绵样品三号上分离得到5株菌,海绵样品二号上分离得到3株菌,海绵样品四号上分离得到的菌株最少,只有2株.各种样品上分离的菌株不仅数量上有差别,种类上也存在一定的差异.其中,海绵一号样品多样性最为丰富,共分离得到8种不同属的真菌菌株,其次为海绵三号样品,虽然其仅分离得到5株菌株,但是这5株菌分别隶属于5个不同的种属.海绵五号样品虽然分离到了12株菌,但是其多样性不太丰富,仅为4个属,而海绵二号样品和四号样品不仅得到的菌株数量少,而且种类也不丰富.另外,从表2中还可以得知,不同海绵样品上真菌种类的分布还是具有较大的差异,其中木霉属Trichoderma和Cystobasidium属在三种不同的海绵样品上均有分布,曲霉属Aspergillus、弯孢聚壳属Eutypella和Paraphaeosphaeria属在两种不同的海绵样品上均有分布.而其他种属真菌只在部分海绵样品中分离得到,如威克汉姆酵母属Wickerhamomyces、拟盾壳霉属Paraconiothyrium和Allocryptovalsa属均来源于海绵一号样品,炭角菌属Xylaria、外瓶霉属Hortaea、Valsaria属均来源于海绵三号样品,枝孢属Cladosporium只在海绵二号样品上分离得到,韦斯特壳属Westerdykella只在海绵五号样品上分离得到.

表2 5种海绵样品上的共附生真菌分布
采用索伦森相似性系数,比较样品之间附生真菌种属组成的相似程度.结果如表3所示.由表3中可知,海绵一号样品与海绵五号样品,海绵二号样品与海绵四号样品之间的相似性系数均大于或等于0.5,说明它们之间的共附生真菌菌群有着较高的相似性.其他海绵样品之间的共附生真菌菌群的相似系系数均小于0.5,反映出它们之间共附生真菌多样性水平差异性较大,相似程度低.
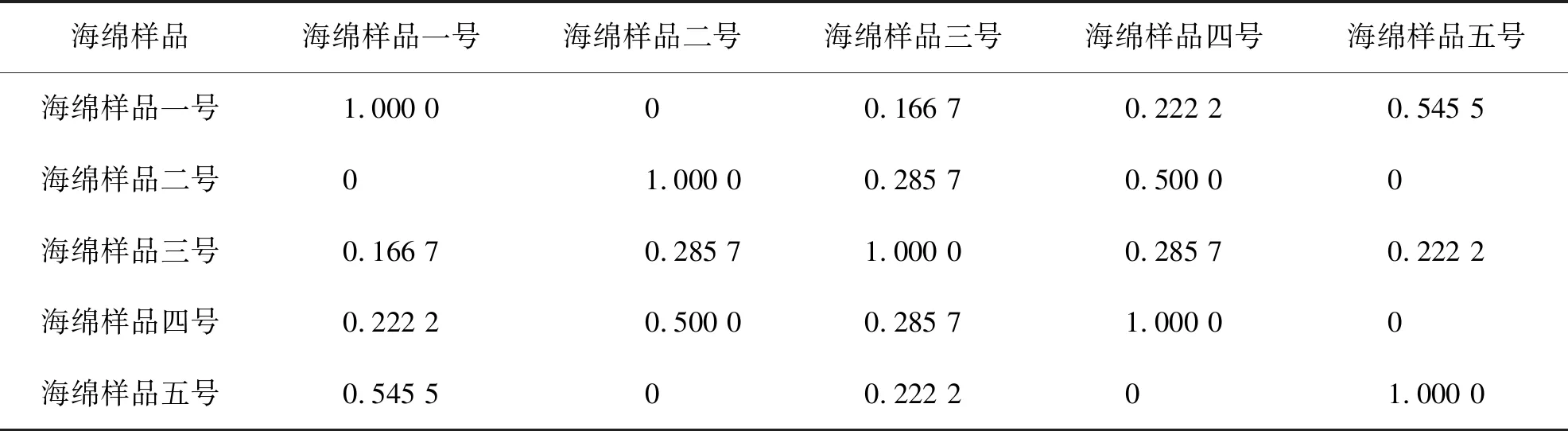
表3 5个海绵样品之间真菌群落结构相似性系数
2.3 4种分离培养基对海绵共附生真菌的分离能力比较
本研究共采用4种分离培养基进行分离,共得到真菌菌株33株,其中真菌II号培养基共分离得到10株菌,占总菌株数的30.30%;Martin培养基共分离得到6株菌,约占18.18%;MEA培养基共分离得到8株,约占24.24%;GPY培养基共分离得到9株菌,约占27.27%.每种分离培养基上得到的菌株数及其种类如表4所示,结果表明,四种培养基均可分离得到真菌菌株,但是每种培养基的出菌率存在一定的区别,其中GPY培养基和真菌II号培养基出菌率更高.
进一步分析发现,这4种分离培养基分离得到的菌株,不仅数量有差异,菌株的种类也有一定的区别.其中,GPY培养基和真菌II号培养基分离得到的菌株种类最为丰富,都为7个属,而MEA培养基分离得到8株4个属的真菌菌株,Martin培养基分离得到的菌株数最少,仅为6株4个属.木霉属Trichoderma在4种分离培养基上均有得到.弯孢聚壳属Eutypella和Cystobasidium属在GPY培养基、MEA培养基和真菌II号培养基上均能分离得到.此外,韦斯特壳属(Westerdykell)、Paraphaeosphaeria属和Allocryptovalsa属仅在Martin培养基上分离得到,枝孢属Cladosporium、威克汉姆酵母属Wickerhamomyces、外瓶霉属Hortaea只在GPY培养基上分离得到;而迈耶氏酵母属Meyerozyma、拟盾壳霉属Paraconiothyrium和炭角菌属Xylaria则只在真菌Ⅱ号培养基上分离得到;Valsaria属则只在MEA培养基上分离得到.研究结果说明热带海绵共附生真菌对不同培养基具有偏好性,但GPY培养基和真菌Ⅱ号培养基最适合用于分离海绵共附生真菌.
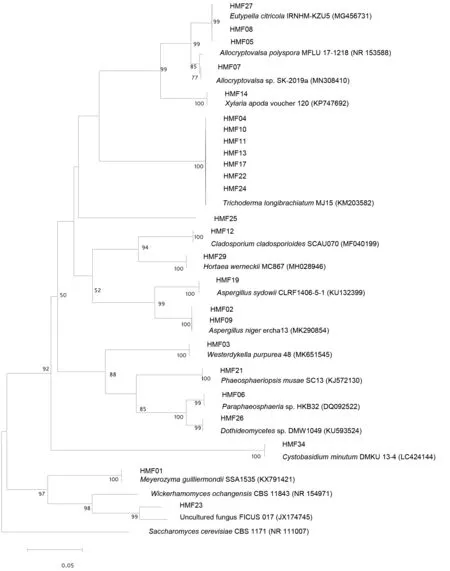
图2 供试菌株与参比菌株基于RDNA-ITS序列的NJ系统发育树
表4 4种培养基上海绵共附生真菌的分布
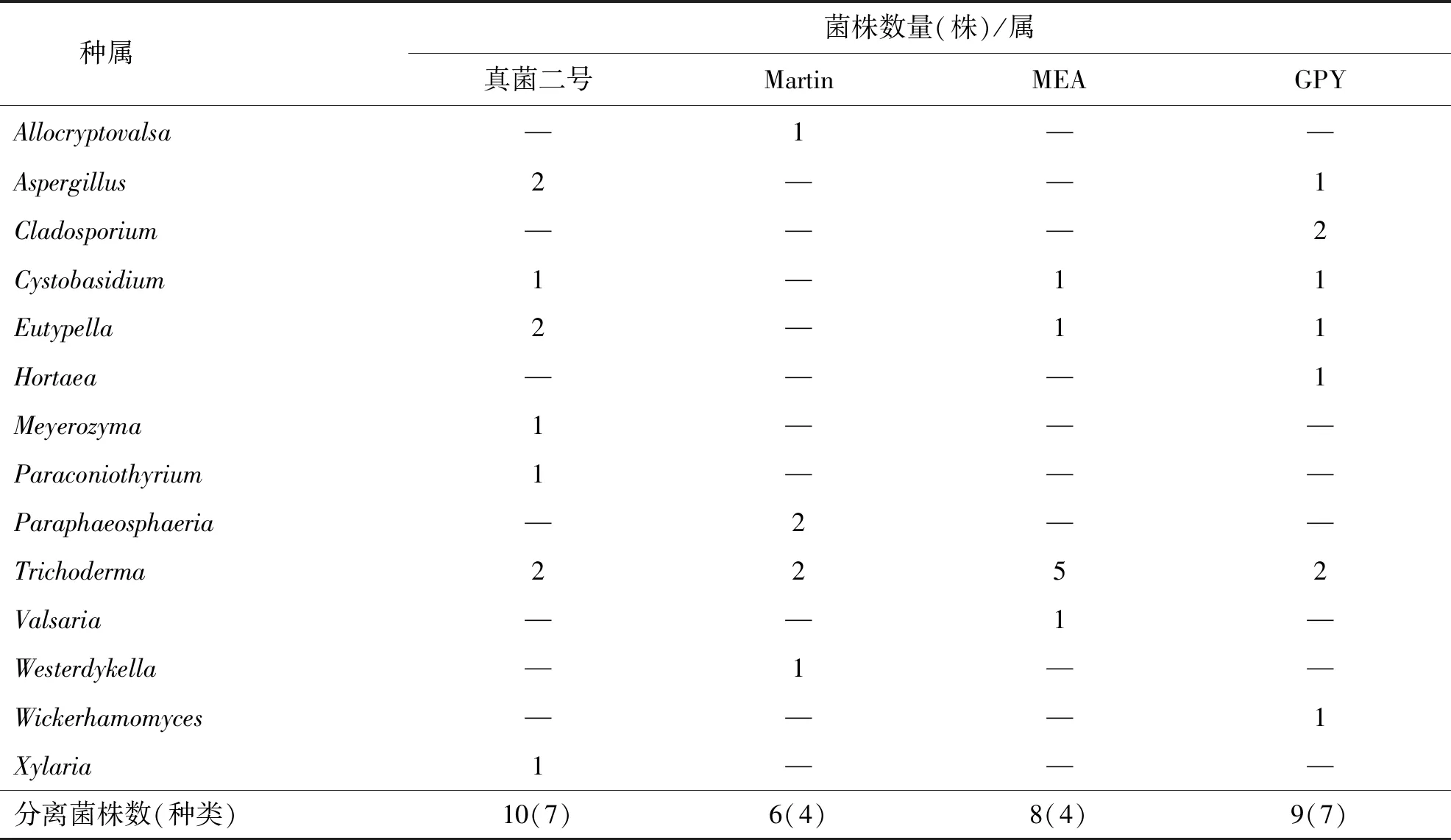
种属 菌株数量(株)/属真菌二号MartinMEAGPYAllocryptovalsa—1——Aspergillus2——1Cladosporium———2Cystobasidium1—11Eutypella2—11Hortaea———1Meyerozyma1———Paraconiothyrium1———Paraphaeosphaeria —2——Trichoderma2252Valsaria ——1—Westerdykella—1——Wickerhamomyces———1Xylaria1———分离菌株数(种类)10(7)6(4)8(4)9(7)
2.4 热带海绵共附生真菌基于rRNA-ITS序列的系统发育分析
将供试的25个菌株的ITS序列上传至Genebank进行Blast比对,并下载各菌株的参比序列,以Saccharomyces cerevisiae(Genebank ID:LC424144)为外类群构建供试菌株与参比菌株基于rDNA-ITS序列的NJ系统发育树.由图2可知,供试的菌株可以明显分为两大类,一大类为酵母菌,一大类为丝状真菌.其中HMF23与未培养真菌菌株 FICUS 017(Genebank ID:JX174745)聚到了一起,可能为首次获得的纯培养菌株的新物种.
3 讨论
本研究从三亚海域的五个热带海绵样品种共分离出33株真菌菌株,ITS序列表明它们属于14个属,其中HMF07、HMF08和HMF23菌株与已知最大相似菌的相似率都低于99%,有可能为潜在的新物种,而HMF26的最大相似菌为未培养真菌,其也有可能为首次获得的可培养菌株.本研究结果表明,木霉属Trichoderma为热带海绵共附生真菌中的优势属.这一结果与前人的报道不太相符.在张圣良等[17-19]的研究中,优势菌属均为曲霉属.导致这种差别的因素,我们认为主要集中在两种方面.在本次研究中,我们采取了三种预处理方法,一种是60 ℃水浴加热6 min,一种是在10% EDTA溶液中浸泡30 min,还有一种便是不做处理.三种预处理方法下,60 ℃水浴加热并分离出菌株.在前人对海洋源共附生真菌的分离研究中,采用EDTA溶液浸泡的预处理方式尚属少见,大部分都是经过冲洗后即研磨制取样液.所以EDTA溶液对曲霉属真菌或其他菌属是否产生抑制影响,是值得考虑的一个因素.另外,由于采集的海绵样品尚未得到鉴定,所以海绵样品的种类与特定分布海域的环境因素是否会对曲霉属真菌与木霉属真菌产生影响也暂时不得而知.木霉属作为自然界中分布较为广泛的真菌类群,因其中许多种类对植物病原真菌具有拮抗和重寄生作用以及能够产生纤维素酶等多种酶类而备受关注[20].本研究分离出木霉属为优势属类的结果亦可为后人对海洋源木霉属真菌的特定研究中提供一定的参照作用.
在前人关于海绵共附生真菌的研究报道中[21-25],分离得到的种属有曲霉属(Aspergillus)、青霉属(Penicillium)、拟盾壳霉属(Paraconiothyrium)、枝孢属(Cladosporium)、茎点霉属(Phoma)、假丝酵母属(Candida)、迈耶氏酵母属(Meyerozyma)、红酵母属(Rhodotorula)、侧齿霉属(Engyodontium)、炭角菌属(Xylaria)、踝节菌属(Talaromyces)、链格孢属(Alternaria)、暗球腔菌属(Phaeosphaeria)、光黑壳属(Preussia)、双散霉属(Dicyma)、拟盘多孢属(Pestalotiopsis)等种类丰富的海洋真菌.本研究分离得到的33株真菌中,除了分离到与上述研究中共有的真菌外,还分离到外瓶霉属(Hortaea)、韦斯特壳属(Westerdykella)、威克汉姆酵母属(Wickerhamomyces)、Valsaria属、Paraphaeosphaeria属、Allocryptovalsa属和Cystobasidium属,这些种属在前人的研究中少见或未见.
本研究采用4种不同的真菌分离培养基对热带海绵共附生真菌进行分离培养,研究结果表明GPY培养和真菌II号培养分离得到的菌株数量和种类都较为丰富,因此尝试用于海洋真菌的分离培养.而Martin培养基在分离海洋源真菌的实验中作为一种常见的培养基,其分离效果普遍得到大家认可,但是在本次实验中并未取得显著的效果,所以在培养基的选取中仍然需要经过多方面的考量.
