同时性肺腺癌合并肾透明细胞癌1例并文献复习
2020-05-19张妍妍姚俊涛
张妍妍,姚俊涛
多原发癌 (multiple primary carcinoma,MPC),是指患者同时或先后发生两个或两个以上各自独立、毫无关联的原发恶性肿瘤,可发生在同一器官或同一系统的不同部位,也可发生于不同器官或不同系统,发生两个独立的原发恶性肿瘤称为双原发癌,两个以上者称为多原发癌。MPC发生率虽然不高,但在临床实践中绝非罕见,近年来,其发病率有升高趋势。笔者所在医院收治了1例同时性肺腺癌合并肾透明细胞癌患者,现将治疗经验报告如下。
1 临床资料
患者,女,56岁,2016年3月因“体检发现左肾占位病变2周”入院,无腰腹部疼痛,无尿频、尿痛、尿不尽,无肉眼血尿,无肢体乏力等。既往体健,无吸烟、饮酒史,其兄长患有肺癌。实验室检查未见异常,肿瘤标志物CEA、NSE、CF211值均在正常范围。肾脏增强CT(图1)示左肾下极软组织肿块影,大小约40.6 mm×37.6 mm×36 mm,内见不均匀强化,考虑肾癌可能。进一步胸部CT(图2)检查示左肺上叶软组织肿块影,大小约31.8 mm×31.8 mm×21.6 mm,右肺下叶背段小结节影,纵隔可见小淋巴结。头颅MRI及骨扫描均未见异常。2016-03-17行左肺肿块穿刺活检,病理(图3)示:“左肺肿块穿刺”小块中分化腺癌。 免疫组化示:CK7 (+),TTF-1 (+)、NapsinA(+)、CD10(-)、P504S(-)、PAX8(-)、CK20(-)、HCK(-)、Vin(-)。 结合免疫组化染色结果符合肺原发。肺癌基因检测示:EGFR基因18、20、21外显子野生型,19外显子缺失突变型 (19-del),ALK融合基因检测结果提示不融合。据相关检查结果及多学科会诊考虑肺部肿瘤为原发灶,左肾转移可能,肾原发恶性肿瘤不除外。临床诊断为:左肺癌(腺癌T2N0M1Ⅳ期)双肺转移左肾转移?鉴于无法手术的晚期非小细胞肺癌,且存在EGFR 19-del突变,结合其治疗意愿,于2016-03-31起口服埃克替尼,125 mg,3次/d。期间颜面及胸背部出现Ⅰ度皮疹,考虑药物相关不良反应。2016-04-28复查胸腹CT(图4)示:左肺上叶片絮影,右肺下叶小结节影,边缘欠锐利,纵隔内未见明显肿大淋巴结影;左肾形态不规整,包膜局限性隆起,左肾下极软组织肿块影,大小约41 mm×34 mm×36 mm,突向包膜外,CT值约30.9 HU。同2016-03-10片对比,左肺结节较前明显缩小,左肾病灶稳定,疗效评价:部分缓解(PR)。继续口服埃克替尼靶向治疗。2016-05-20入院查ALT 400 U/L,AST 270 U/L,肝功损害3级。患者无相关症状,既往无肝炎病史,近期无合并其他用药史,考虑肝功异常系埃克替尼的不良反应,暂停用埃克替尼,予保肝对症处理后肝功转氨酶恢复正常,2016-05-31继续口服埃克替尼。鉴于靶向治疗后肺部病灶较前明显缩小,左肾占位灶未见明显变化。因此,行双肾增强CT(图5)进一步明确:左肾下极软组织肿块影,大小约42 mm×34 mm×36 mm,呈不均匀强化,边缘较清晰,左肾盂受压变形。据影像学特点考虑左肾占位系肾脏原发恶性肿瘤,普外科会诊建议手术切除。遂停用埃克替尼,完善术前检查后,于2016-09-05在全麻下行“根治性左肾切除术”。术中腹膜后血管周围及肾门未见异常结节和肿大淋巴结。术后病理(图6)示“左肾”透明细胞型肾细胞癌,侵及局部肾被膜,未累及肾盂黏膜,左肾门动静脉及输尿管切缘未见癌组织。病理诊断:左肾癌(透明细胞癌T1bN0M0Ⅰ期)。术后手术切口愈合良好,复查胸部CT肺部病灶较术前无著变,继续口服埃克替尼。定期复查肿瘤标志物均在正常范围,胸腹部CT(图7)示:左肺野内见片絮致密影,肺部病灶疗效评价维持PR,肾癌术后局部未见复发,无远处新发病灶。在初步诊断后,患者处于良好控制状态至今已41个月。

图1 患者肾脏增强CT(2016年3月)

图2 患者靶向治疗前CT(2016年3月)

图3 患者左肺上叶中分化腺癌病理图(HE×100)

图4 患者靶向治疗后CT(2016年4月)
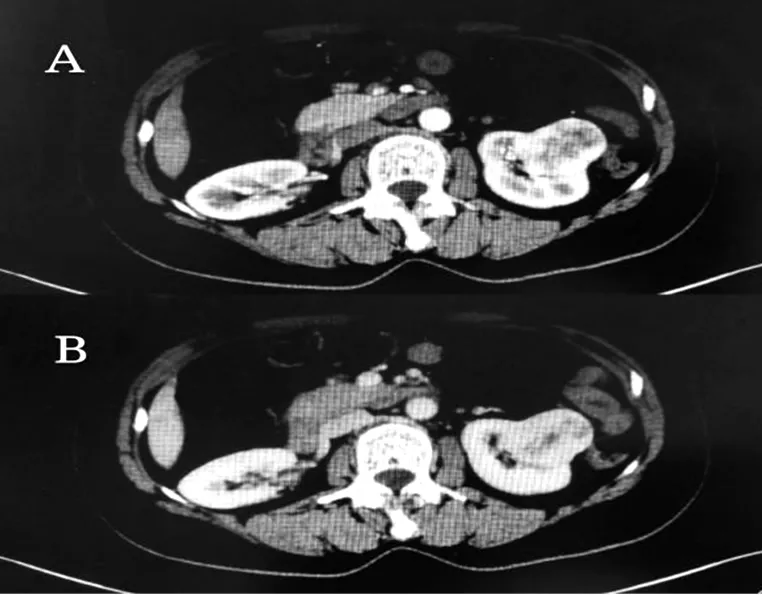
图5 患者术前双肾增强CT(2016年8月)

图6 患者左肾透明细胞型肾细胞癌病理图(HE×100)

图7 患者术后CT(2019年4月)
2 讨论
MPC是指同一患者体内一个或者多个器官、组织同时或先后发生2种或2种以上不同组织类型的原发恶性肿瘤,又称为重复癌[1]。国际癌症协会[2]对MPC的诊断标准做了描述:多原发癌为多灶性肿瘤,其存在不取决于时间;每一个原发癌起源于一个部位或组织,而不是侵袭、复发或转移;具有不同组织学形态的肿瘤,即使它们在同一个部位也应算作多原发癌。目前学者认为[3]多种恶性肿瘤发生间隔在6个月内为同时性多原发癌(synchronous carcinoma,SC),超过6个月者为异时性多原发癌(metachronous carcinoma,MC)。
MPC的病因目前尚不明确,综合相关文献分析,可能与生活方式及环境、机体易感性、免疫功能、内分泌因素、基因和遗传因素、化疗药物致癌、放疗后继发性癌及肿瘤患者生存期延长等因素有关[4-6]。随着诊断技术的进步,综合治疗的发展,恶性肿瘤患者生存期的延长,MPC的发生率逐渐升高。不同研究中MPC的发病率在2.4%和17%之间变化[5], 而国内报道的发病率仅为 0.84%至 1.31%[7],可能与对MPC的认识不足有关。其中75%以上的MPC是年龄超过50岁的老年男性,腺癌为最常见的病理类型[8,9]。
MPC发生在同一系统器官或成对脏器多见,发生在不同系统的器官比较少见。其好发部位在不同国家和地区中文献报道不一,日本MPC以胃癌最常见,而我国以鼻咽癌、肺癌、结直肠癌、乳腺癌为主[1]。其中肺癌伴发的其他原发癌主要为结直肠癌、食管癌、甲状腺癌[10],与之同步的第二原发肿瘤常发生于肺部(31%),头颈部(20%)和泌尿道(11%)[11],腺癌是常见的组织学类型[12]。非小细胞肺癌(nonsmall cell lung cancer,NSCLC)患者最常见的转移部位是脑、骨、肾上腺和肺[13],孤立性单侧肾转移相当罕见。肾癌最常见的亚型是透明细胞癌,发生在70%~75%的病例中[14]。肾转移癌通常是双侧和多灶性的,也可能在乳腺癌,肺癌和结直肠癌患者中表现为大的单发转移[15]。
大多数原发性腺癌的甲状腺转录因子-1(thyroid transcription factor-1,TTF-1) 和细胞角蛋白 7(cytokeratin 7,CK7)为阳性[16]。 其中 TTF-1 是肺腺癌的典型标志物,具有高度特异性,在大约76%的肺腺癌中呈阳性[17],在原发性肾肿瘤中为阴性[18]。当腺癌具有CK7阳性/CK20阴性表型并且表现出TTF-1阳性染色时,可能是原发性肺肿瘤[19]。NapsinA也是一种有用的标志物,可以帮助诊断肺腺癌和肾细胞癌[20]。影像学检查是肾癌的主要诊断依据,螺旋CT特别是其增强扫描技术被认为是诊断肾癌最理想的影像工具,对照术后病理符合率可高达90%以上[21,22]。该例患者体检发现左肾占位病变,2周后入院检查同时发现左肺占位。行左肺占位穿刺活检,病理结果提示腺癌,免疫组织化学染色示TTF-1和CK7呈弥漫阳性,CK20阴性,提示符合肺原发。肾脏占位为孤立性单发癌结节,突向包膜外呈外生发育和不均匀强化,需除外肺癌肾脏转移。由于肾癌穿刺时可能发生播散转移,术前穿刺活组织病理检查对诊断肾癌的价值非常有限,所以只有对部分年老体弱或有手术禁忌证的患者采用肾穿刺活检明确诊断以确定治疗方案,对于拟手术的患者,不推荐穿刺活检。考虑到晚期肺癌疾病进展快,生存期较肾癌短,决定将肺癌病情控制稳定后再对肾脏占位行手术切除明确诊断。在随访中,笔者观察到左肾肿块的稳定性及增强CT呈 “快进快出”特点[23],考虑肾脏原发恶性肿瘤可能性大,遂行手术切除,术后病理提示左肾透明细胞型肾细胞癌。证实肿瘤细胞来源于不同组织,排除二者互为转移、复发的可能,分别为肺和肾的原发癌,符合同时性双原发癌的诊断标准。
MPC与转移癌或复发癌的治疗原则完全不同,临床上一旦出现肿瘤的复发转移多采用姑息治疗,预后往往较差;MPC则须按照癌灶各自的病理类型、临床分期等尽可能采用根治性治疗手段,尤其是局限性肿瘤,其治疗措施及治疗效果不受第一原发癌灶的影响[5]。该例病例的治疗根据原发肺癌和原发肾癌的类型、性质及治疗原则分别采取靶向治疗和根治性手术治疗。靶向药物治疗选择性高、不良反应轻、口服给药方便、患者依从性好,作用于表皮生长因子受体(epidermal growth factor receptor,EGFR)的酪氨酸激酶抑制剂 (tyrosine kinase inhibitor,TKI)可使携带EGFR突变的晚期NSCLC患者受益,可显著延长生存期[24]。患者肺癌基因检测结果提示EGFR基因18、20、21外显子野生型,19外显子缺失突变型(19-del)。故与患者及家属沟通后,同意接受靶向治疗。盐酸埃克替尼是一种高效特异性的EGFR-TKI,可显著改善EGFR突变的晚期肺腺癌患者的无进展生存期 (Progression-free Survival,PFS),具有可耐受和易控制的安全性,目前指南推荐为ⅢB/Ⅳ期肺腺癌和EGFR 19/21外显子突变人群的一线治疗[25,26]。使用埃克替尼治疗的携带19外显子突变与21-L858R点突变的患者相比,PFS略长,可优先考虑靶向治疗[27]。该例患者明确诊断为无法手术的晚期肺腺癌,基因检测结果提示存在EGFR基因19-del突变,具有靶向治疗最佳靶点,遂采用口服埃克替尼靶向治疗。文献表明有少数患者用药期间出现一过性肝氨基转移酶升高[28,29],特别是在用药的前1个月内,建议定期检查肝功能。患者服用埃克替尼耐受性较好,用药期间出现一过性转氨酶升高,停药及保肝治疗后复查肝功转氨酶降至正常则继续给药,此后复查肝功转氨酶均在正常范围,仅出现Ⅰ度皮疹,无腹泻、恶心等其他不良反应。
MPC诊疗的关键是早发现、早诊断、早治疗。肿瘤标志物、超声、平扫及增强CT等检查是发现肿瘤的重要方法。对肿瘤患者定期进行全面复查,发现新癌灶之后积极鉴别诊断及穿刺病理活检是治疗的重要原则[15,30]。 对于该患者,如果初诊时未取肺部占位活检病理,极易误诊为肾癌肺转移,治疗原则和方案的选择就会不同,患者的预后也将不同。原发性肾肿瘤一旦确诊,手术是金标准[31],其对于放化疗不敏感,根治性或者部分肾切除是目前主要的治疗手段。术后的复发风险与病理分期有关,Ⅰ期5年无进展生存率为93%,Ⅱ、Ⅲ期的5年复发风险在30%~40%[32]。鉴于靶向药物的使用可能会影响到术后伤口的愈合,术前停用靶向药物的时机和周期取决于药物的半衰期,推荐停药2~3个药物半衰期,若停药时间过长则可能导致肿瘤进展或耐药[33]。因此,明确掌握药物半衰期,术前合理时机停药,确保药物在体内最大化清除,可能会降低切口相关并发症发生的风险。该例初始针对NSCLC行靶向治疗,肾脏肿块通过监测进行管理,用药1个月后肺部病灶疗效评价PR。靶向治疗5个月后,肾脏肿块未见缩小,结合影像学检查考虑系肾脏原发恶性肿瘤。遂停用埃克替尼,排除手术禁忌后,行左肾肿瘤根治性切除术,确诊为肾透明细胞癌,病理分期为Ⅰ期,无须接受术后的辅助治疗,使肾脏肿瘤得到根治。术后未发生伤口延迟愈合,肺部病灶未进展,继续埃克替尼靶向治疗。2019年4月入院复查,胸部CT示肺部病灶维持PR,肾癌未见复发转移,口服埃克替尼靶向治疗中,患者目前已生存41个月。
该病例提示,在临床工作中发现多处癌灶时,除了考虑复发、转移癌外,还要考虑MPC的可能,及时进行穿刺病理活检明确诊断;同时性多原发癌应根据各原发肿瘤的生物学行为,先处理进展快、预后差、直接危及生命的病灶;基于手术的综合治疗手段可明显延长 MPC 患者的生存期[15,34-36],若有手术条件且无手术禁忌证的患者,尽可能行根治性手术切除肿瘤。因此,对MPC应提高认识,综合考虑患者的肿瘤分期、病理分化程度、疾病进展速度,采取积极、规范化、个体化治疗,对改善患者的预后有非常重要的意义。
