新城疫病毒非结构蛋白W的分子特征及生物信息学分析
2020-05-18欧阳伟王晶宇孙伟伟王晓丽夏兴霞诸玉梅王永山
钱 晶,欧阳伟,王晶宇,孙伟伟,王晓丽,夏兴霞,诸玉梅,王永山
(江苏省农业科学院 兽医研究所 农业部兽用生物制品工程技术重点实验室,江苏 南京 210014)
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)强毒株感染引起的一种急性、高度接触性禽类烈性传染病[1]。世界动物卫生组织(OIE)将ND列为必须报告的动物疫病。我国将其列为一类动物疫病,并在《国家中长期动物疫病防治规划(2012-2020年)》中列为优先防治和重点防控的动物疫病之一[2]。近年来,我国ND呈现出新的流行病学特点:非典型性ND和免疫带毒现象普遍存在,免疫失败时有发生,直接及间接造成的经济损失巨大,ND的防控面临着新挑战[3-4]。因此,寻求防控ND的新途径已成为亟待解决的重大科学与生产实际问题。
NDV为副黏病毒科副黏病毒属的禽副黏病毒I型,基因组为不分节段的单股负链RNA,可编码6个结构蛋白(NP、P、M、F、HN、L)和2个非结构蛋白(V、W)[1]。NP、P和L作为内部蛋白参与病毒RNA的转录与复制,形成有活性的mRNA[5-6];M蛋白构成囊膜内表面的支撑物,并驱动病毒出芽[7-8];F和HN是形成病毒表面纤突的糖基化蛋白,也是决定NDV毒力和致病性的主要因素[9-10]。另外,V蛋白能通过多种策略拮抗宿主I型IFN信号通路[11-13]。然而,目前有关W蛋白的功能及其作用机制尚不明确。
为此,本试验选取遗传背景清晰的新城疫病毒信息,利用生物信息学软件分析W蛋白的遗传进化规律、潜在的蛋白质修饰位点以及高级结构等,获得其分子特征,并以此预测W蛋白的功能结构域,为深入解析新城疫病毒W蛋白的功能研究奠定基础。
1 材料与方法
1.1 毒株信息与W蛋白序列确定从GenBank上选取24株信息完整、可信度高的NDV毒株序列(表1),采用BioEdit软件在病毒P基因开放阅读框第401位插入2个G碱基,寻找W基因编码区,翻译成氨基酸(amino acid,aa)序列,确定各毒株的W蛋白序列。
1.2 遗传进化分析采用MEGA6.06软件对24条W蛋白序列进行遗传进化分析,运用邻位相连法(Neighbor-Joining)构建系统进化树,bootstrap设置1 000次重复。
1.3 蛋白修饰位点预测应用NetNGlyc 1.0 Server、NetOGlyc 4.0 Server和NetPhos 3.1 Server在线软件分析W蛋白中N侧链糖基化、O侧链糖基化以及磷酸化修饰位点与激酶结合位点的数量和种类。
1.4 信号肽、跨膜区及核定位信号预测应用SignalP-5.0 Server、TMHMM Serverv.2.0和cNLS Mapper在线软件分析W蛋白中信号肽、跨膜区及核定位信号情况。
1.5 高级结构预测应用SOPMA和I-TASSER在线软件综合分析W蛋白的二级结构,确定α螺旋、β转角以及无规则卷曲等的分布情况。
2 结果
2.1 W基因及其编码蛋白序列长度分析P、V、W蛋白具有共同的氨基末端(N端,第1~134位),但羧基末端(C端)不同,W蛋白长度的差异是通过改变C端结构域长度来实现的。由表1可见,不同毒株W蛋白序列长度各有不同,目前存在8种不同长度,分别为137aa、147aa、155aa、179aa、183aa、196aa、221aa和227aa。ClassⅠ毒株W蛋白均为183aa;在ClassⅡ中基因Ⅰ型毒株均为147aa,基因Ⅱ型弱毒株和基因Ⅴ型毒株均为179aa,基因Ⅱ型中强毒株均为221aa,基因Ⅲ、Ⅵ和Ⅶ型强毒株均为227aa,基因Ⅳ型毒株均为196aa,基因Ⅷ型毒株均为155aa,基因Ⅸ型毒株均为137aa。除基因Ⅸ型强毒株W蛋白序列长度较短外,NDV强毒株(包括中强毒)W蛋白序列长度均较长,表现为不同基因型毒株W蛋白长度差异又与强、弱毒特征存在一定相关性。
2.2 遗传进化树分析根据W蛋白氨基酸序列绘制遗传进化树,结果显示基于W蛋白序列的基因型划分情况与已报道的各毒株基因型相同,各基因型组内毒株高度同源,尽管基因Ⅱ型毒株中存在2种序列长度,但由进化树可见其W蛋白变异水平均在同一分支内,表明不同毒株W蛋白变异呈现基因型一致性(图1)。
2.3 糖基化和磷酸化修饰位点分析N-糖基化预测结果显示,所有毒株的N-糖基化位点均在P/V/W共有区,除3株(IT-227/82、ZJ1、HB/1/05/Dk)包含有2个N-糖基化位点,其余毒株均为1个。O-糖基化预测结果显示,各毒株所包含的O-糖基化位点数量趋于基因型一致,其中基因Ⅱ型中强毒、基因Ⅲ型和基因Ⅶ强毒株C端O-糖基化位点数量显著多于其他毒株(表2)。磷酸化预测结果显示,所有毒株的丝氨酸和苏氨酸磷酸化修饰位点数量同样趋于基因型一致,基因Ⅶ强毒株W蛋白上丝氨酸和苏氨酸磷酸化修饰位点数量最多,磷酸化位点数量差异主要出现在W蛋白C端结构域(第135位aa开始)(表3)。由此可见,基因Ⅱ型中强毒株与基因Ⅲ、Ⅵ和Ⅶ型强毒株W蛋白上潜在糖基化和磷酸化位点数量较多可能与W蛋白长度有关,提示W蛋白上糖基化位点和磷酸化位点数量与其长度呈正相关性。

表1 新城疫病毒W基因及其编码蛋白长度统计

图1 W蛋白的遗传进化树
2.4 核定位信号分析跨膜结构和信号肽分析表明所有W蛋白均无跨膜区和信号肽区域。核定位信号分析表明所有W蛋白存在1个约30aa长度的核定位信号序列,基因2型毒株W蛋白核定位序列位于第138~168位,其他所有毒株核定位序列均位于第106~136位,并且毒株间核定位序列同源性较高(表4)。这表明W蛋白具有入核潜能,推测W蛋白的功能活动区可能在细胞核。
2.5 二级结构分析二级结构预测分析表明,所有W蛋白存在4种结构形式,分别为α-螺旋、β-折叠、β-转角和无规则卷曲,其中无规则卷曲结构含量最高,其次为α-螺旋。W蛋白包含有至少3个α-螺旋结构域,通过序列比对发现基因Ⅱ型(编码221aa的BC株和TX/GB株)和基因Ⅲ、Ⅵ和Ⅶ型(编码227aa)NDV在其C端结构域均(第206~221/225位)额外存在1个α-螺旋结构域(表5,图2),这一结构域的存在是否与毒力相关还有待进一步研究。
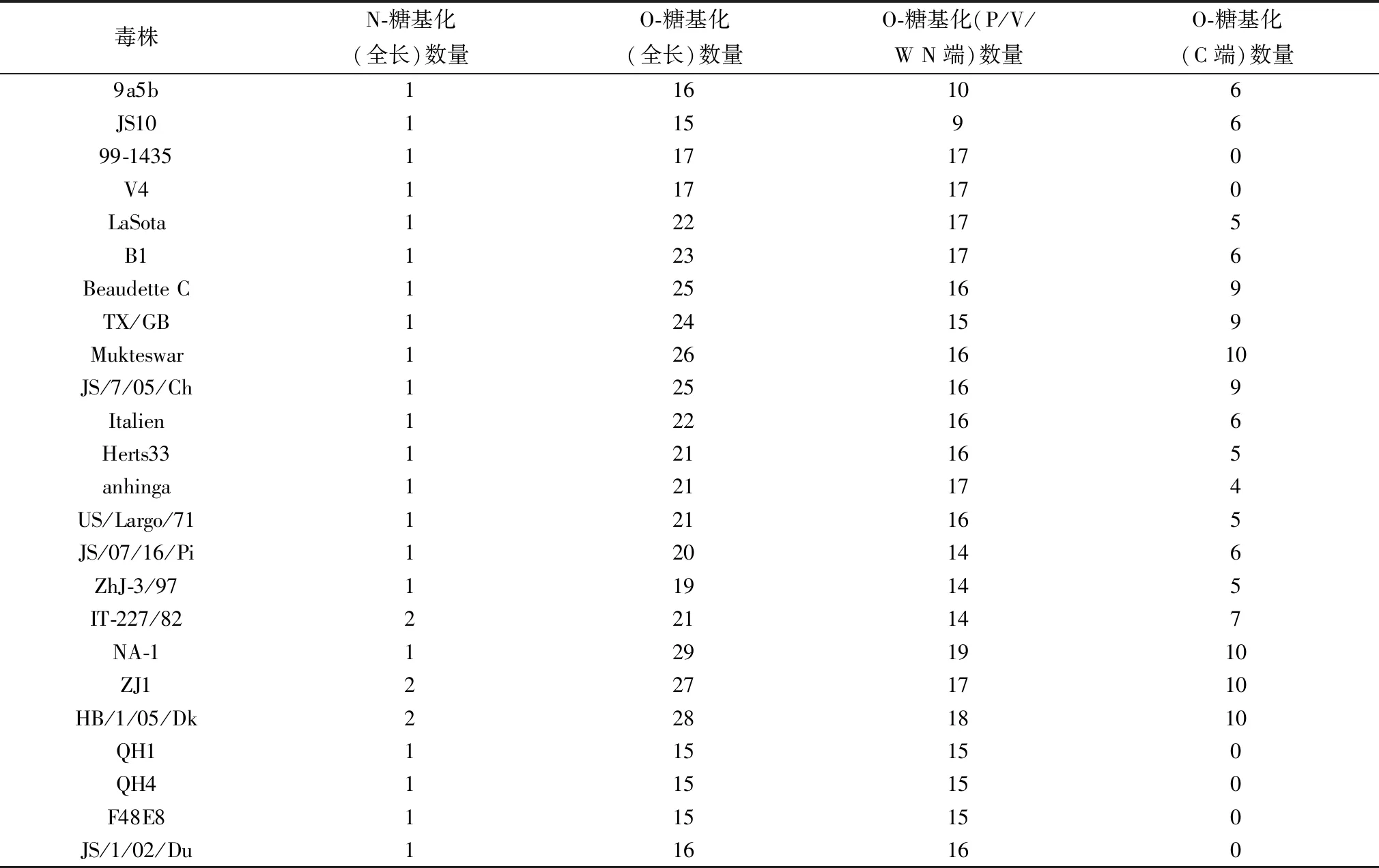
表2 W蛋白潜在糖基化位点统计
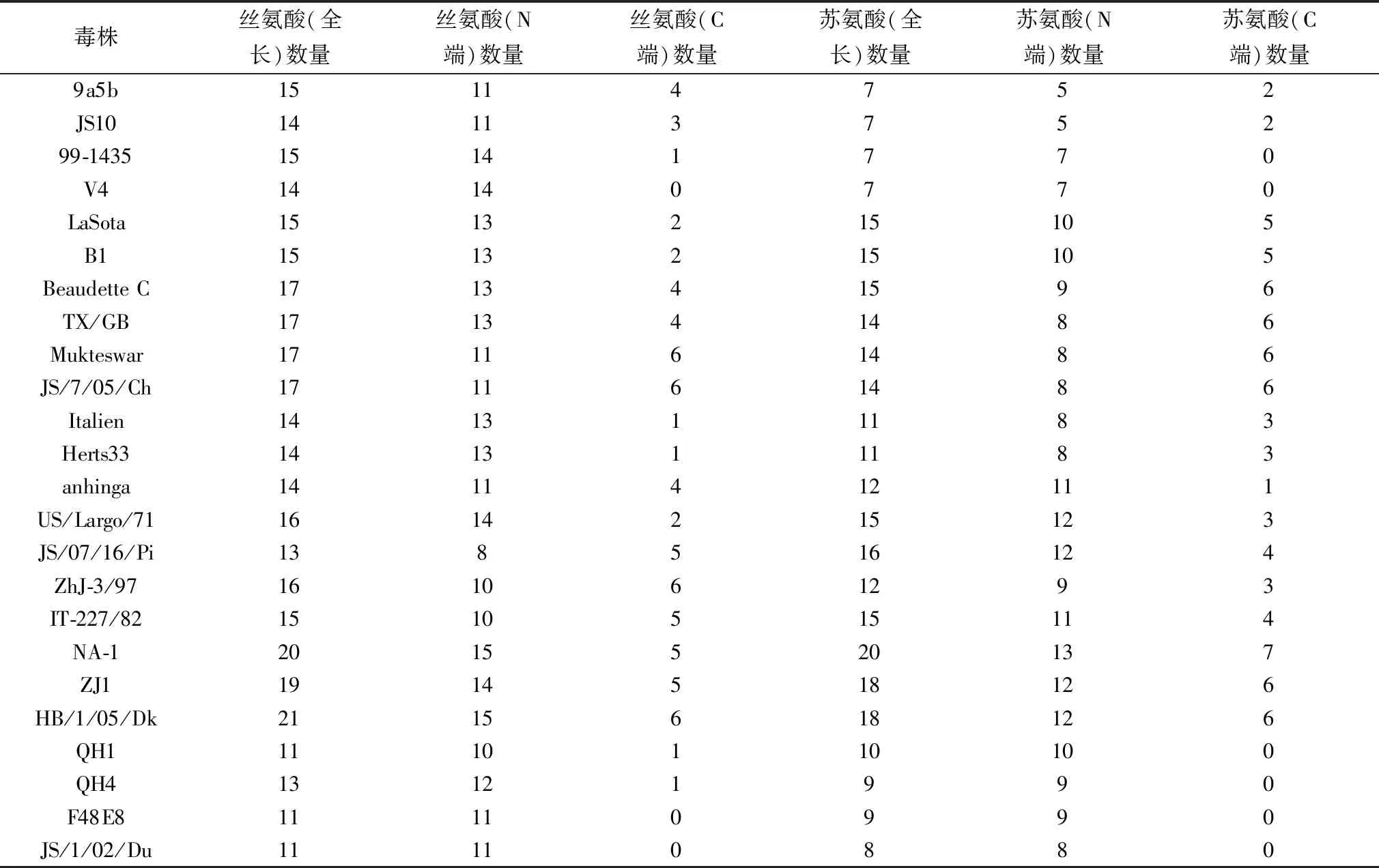
表3 W蛋白潜在磷酸化位点统计

表4 W蛋白潜在核定位信号统计

表5 W蛋白二级结构预测统计 %

图2 W蛋白羧基端序列比对及二级结构预测
3 讨论
新城疫病毒P基因在转录过程中通过“RNA编辑”作用,分别产生2个非结构蛋白(V和W),其中W蛋白是最短编码产物[5,14]。最早,CHAMBERS等[15]通过SDS-PAGE发现2个约36 000和33 000大小的条带,将其鉴定为V和W蛋白。MEBATSTION等[16]发现,编码P、V、W基因的转录体比例分别为68%,29%和2%。WAKAMATSU等[17]在研究V蛋白的过程中,推测W蛋白可能与NDV毒力和致病性有关,但未得到确切证实。国内对W蛋白的研究也仅停留在蛋白表达及其抗体制备方面,并未有深入研究。近期国内学者分析不同毒力的NDV毒株感染初期RNA编辑动力学,发现强毒株W基因的转录体比例与之前的报道有所差异,明显高于弱毒株的转录体比例[18],提示强毒株W蛋白可能参与病毒的感染与复制。
NDV具有遗传多样性,分为ClassⅠ和ClassⅡ两类,每类又可进一步分为多种基因型,其中ClassⅡ 至少包括18个基因型[19]。分子流行病学监测数据表明,我国目前流行的NDV以ClassⅡ类中的基因Ⅵ型和Ⅶ型为主,个别地区还出现了新基因型[2]。本试验发现不同毒株W蛋白序列长度呈现基因型一致性,不同基因型毒株W蛋白长度差异又与强、弱毒特征存在一定相关性,W蛋白长度的差异是通过改变C端结构域长度来实现的。最近,KARSUNKE等[20]发现,Clone 30株(基因Ⅱ型)C端结构域核定位序列(NLS)的突变会改变W蛋白的细胞定位情况,然而不同基因型NDV毒株W蛋白长度具有多样性,并且基因Ⅱ型毒株与其他毒株W蛋白的核定位序列存在差异,这使得毒株间W蛋白定位及功能可能存在不同作用模式,这有待进一步研究论证。
本试验结果表明,W蛋白序列具有长度多样性,与病毒毒力存在一定相关性;W蛋白长度的差异是通过改变C端结构域长度来实现的,蛋白修饰位点数量与其长度呈正相关性,强毒株C端结构域存在额外的α-螺旋结构,推测W蛋白可能是NDV强毒株上关键的新型毒力标志。另外,W蛋白存在稳定的核定位信号,提示其功能活动区可能在细胞核。这将对W蛋白功能挖掘以及深入理解NDV感染机制提供新的理论基础。
