狐源犬瘟热病毒HBF-1株全基因组序列测定及其分析
2020-05-18薛向红闫喜军朱翔宇
卜 研,薛向红,闫喜军,朱翔宇,胡 博,史 宁
(中国农业科学院 特产研究所,吉林 长春 130122)
犬瘟热(canine distemper,CD)是由犬瘟热病毒(canine distemper virus,CDV)感染犬科和其他食肉动物而引起的一种急性热性、高度接触性传染病[1],该病传染性强,发病率和死亡率高。自然感染宿主不断扩大,包括犬科、鼬科、浣熊科、猫科,海豹科、偶蹄目猪科、以及猕猴属。CDV经常引起大批宠物犬、貉、狐等发病,致死率30%~80% ,雪貂的致死率可达100%,犬瘟热对犬、毛皮经济动物、野生动物的生命安全造成严重威胁,给养殖户带来巨大经济损失[2-7]。犬瘟热病毒为副黏病毒科(Paramyxovaridae)麻疹病毒属(Morbillivirus)成员,CDV基因组为不分节段单股负链RNA病毒,由15 690 bp核苷酸组成,依次有6个开放阅读框,分别为核蛋白 (N) 、磷蛋白 (P) (内部含有2个非结构蛋白基因C和V)[8]、基质蛋白 (M) 、融合蛋白 (F) 、血凝素蛋白 (H) 和大聚合酶蛋白 (L)。
CDV Hebei株是2010年从北极狐中分离到的犬瘟热病毒,它可在不同动物间发生种间水平传播,属于犬瘟热病毒强毒株[9]。研究表明,犬瘟热病毒强毒株经过适应细胞后,毒力会减弱[10]。因此,本试验旨在从基因组水平分析犬瘟热病毒强毒株适应细胞前后,病毒基因组核苷酸序列的变异情况。 我们首先对适应Vero-dSlam细胞后的HBF-1的全基因组序列进行了测定。然后,与最初分离株Hebei株的全基因组序列进行全面比对和序列分析,明确变异发生的具体位点,这些为后续研究强毒株与Slam受体相互作用及建立反向遗传操作平台奠定基础。
1 材料与方法
1.1 病毒和主要试剂北极狐源犬瘟热病毒Vero-dSlam细胞适应株HBF-1,由中国农业科学院特产研究所特种动物疫病防控研究室保存;总RNA提取试剂盒RNeasy mini kit购自QIAGEN;反转录试剂盒SuperscripTMⅢ First-Strand Synthesis SuperMix购自invitrogen;高保真酶TransStart FastPfu DNA Polymerase,pEASY-Blunt Cloning Kit,感受态细胞Trans1-T1均购自北京全式金生物技术有限公司;DNA凝胶回收试剂盒和质粒小量提取试剂盒购自Axygen。
1.2 引物设计与合成根据GenBank中已经公布的23株犬瘟热病毒的全基因组序列,比对分析后,利用Primer Premier 5.0在保守区设计了11对特异性引物F1/R1~F11/R11(具体序列见表1),引物送由上海生工生物技术公司合成。
1.3 总RNA提取根据QIAGEN总RNA试剂盒的说明书提取总RNA。取200 μL Vero-dSlam细胞适应株HBF-1病毒液到无RNA酶的1.5 mL离心管中,加入350 μL RLT,将病毒液充分裂解,加入550 μL 70%乙醇吹打混匀,取700 μL到新的2 mL column tube中,12 000 r/min离心1 min,弃废液;加入700 μL RW1,12 000 r/min离心1 min,弃废液;加入500 μL RPE,12 000 r/min离心1 min,弃废液;再加入500 μL RPE,12 000 r/min离心1 min,弃废液;将吸附柱放到新2 mL离心管中,12 000 r/min 空离心1 min;重新将吸附柱放到无RNA酶污染的新1.5 mL离心管中,加入30 μL Rnase free water到膜上,12 000 r/min离心1 min;测定浓度后进行反转录,用于RT-PCR反应。
1.4 RT-PCR反应
1.4.1RNA反转录 取Annealing Buffer 1 μL、50 μmol/L Oligo(dT)20primer 1 μL、50 mg/L random primer 1 μL、RNA 5 μL,将以上试剂加到0.2 mL 薄壁PCR管上,冰上混匀,在65℃孵育5 min,立即放冰上1 min,之后加入2×first-strand reaction mix 10 μL、SuperScriptTMⅢ/RNaseoutTMEnzyme Mix 2 μL,混匀短离心,50℃孵育50 min。

表1 扩增用引物序列
1.4.2cDNA PCR扩增 扩增用50 μL体系:即5×TransStartFastPfuBuffer 10 μL、TransStartFastPfu DNA Polymerase(2.5 U/μL)1 μL、dNTPs(2.5 mmol/L)4 μL、上、下游引物各(20 μmol/L)1 μL、无菌水31 μL、cDNA 2 μL。反应程序为:95℃预变性1 min,95℃变性20 s,45~61℃退火20 s,72℃延伸90 s,循环40次,72℃延伸5 min。PCR产物经1%琼脂糖凝胶电泳,鉴定正确后,进行胶回收。
1.5 全基因的克隆与序列测定分别将胶回收的11个片段连接到pEASY-Blunt载体上,即4 μL的目的片段加入到1 μL载体中,25℃连接20 min,反应结束后放到冰上,转化到Trans1-T1感受态细胞中,12 h之后挑菌,用Amp抗性的LB培养基培养过夜,提取质粒,进行酶切鉴定,将初步鉴定正确的质粒送到上海生工生物技术公司测序。
1.6 序列分析利用DNAstar软件中的Seqman工具对所获得的11个片段序列进行拼接,找出开放阅读框的位置与数目,利用MegAlign将拼接好的全序列与GenBank的CDV基因组全序列进行同源率分析和氨基酸比对。并利用MEGA6.0软件对HBF-1H基因与GenBank中其他已知CDV毒株的H基因进行亲缘关系分析。
2 结果
2.1 RT-PCR结果以11对所设计的特异性引物用高保真DNA聚合酶扩增所需基因获得11个目的片段(图1)。11个目的片段长度依次约为1 200,1 500,1 500,1 900,1 500,1 700,1 500,1 500,1 300,2 100,1 800 bp,与预期相符。
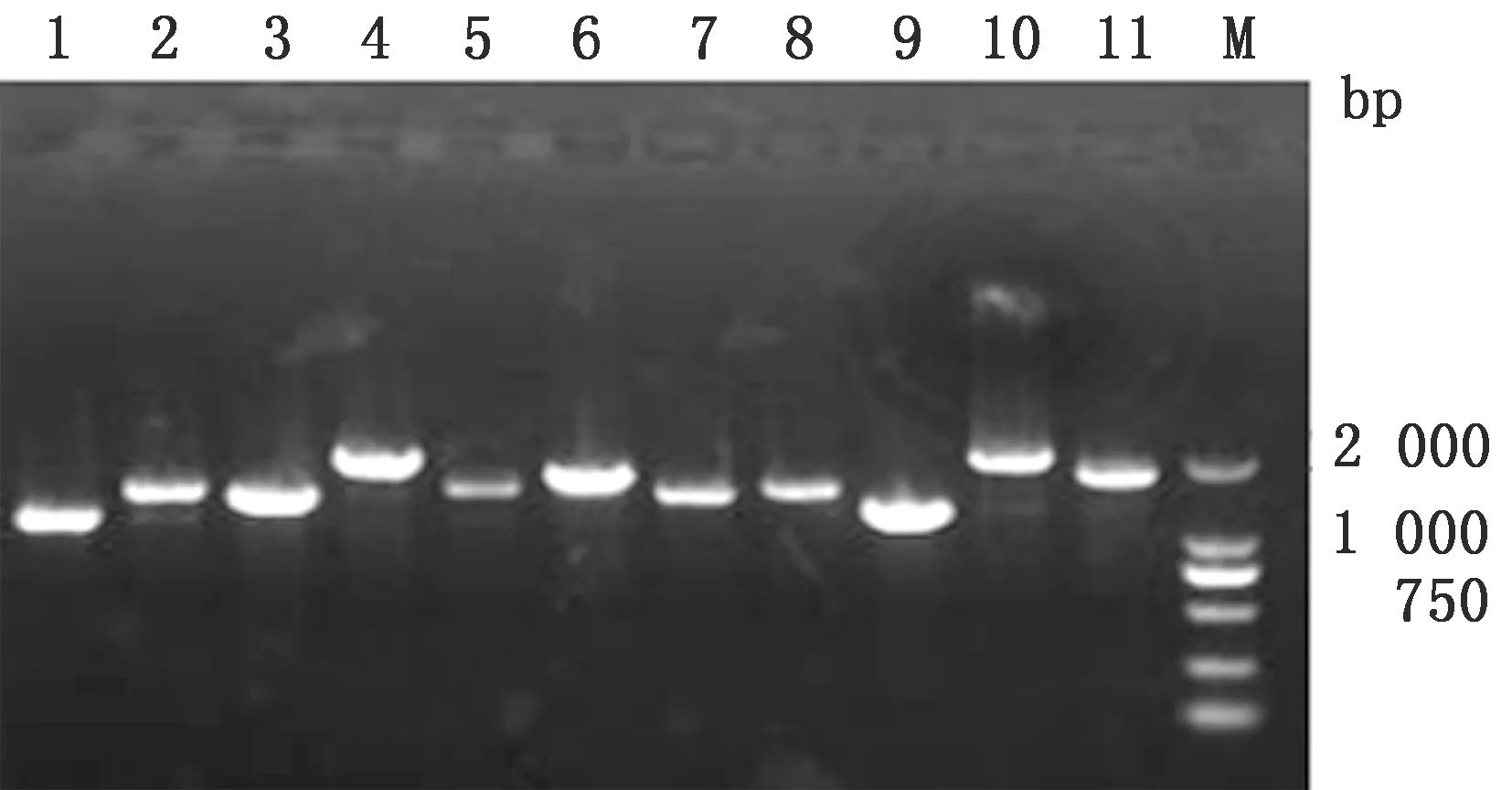
图1 犬瘟热病毒HBF-1株全基因组扩增结果 1~11.分别为引物F1~F11的扩增产物;M.Marker
2.2 狐源CDV基因组的序列测定及拼接将RT-PCR获得的11个片段进行克隆与测序,利用DNAstar中的SeqMan软件将分段克隆获得的CDV HBF-1基因组序列进行拼接,从而获得CDV HBF-1株的全基因组序列,分析结果表明,狐源CDV基因组全长为15 690 nt,与GenBank上登录的CDV基因组大小一致,3′端前导序列和5′端尾随序列分别有52和38个核苷酸组成,其中N、P、M、F、H和L蛋白ORF基因大小分别为1 569,1 521,1 005,1 986,1 821,6 552 nt(表2)。2个相邻结构蛋白基因之间的非编码区序列都包含一个终止信号和半保守的多聚腺苷酸化和基因间非转录三联核苷酸CUU(H和L基因间为CUA,L基因和5′端尾随序列为CAA),猜测基因间隔序列与转录信号有关[11]。
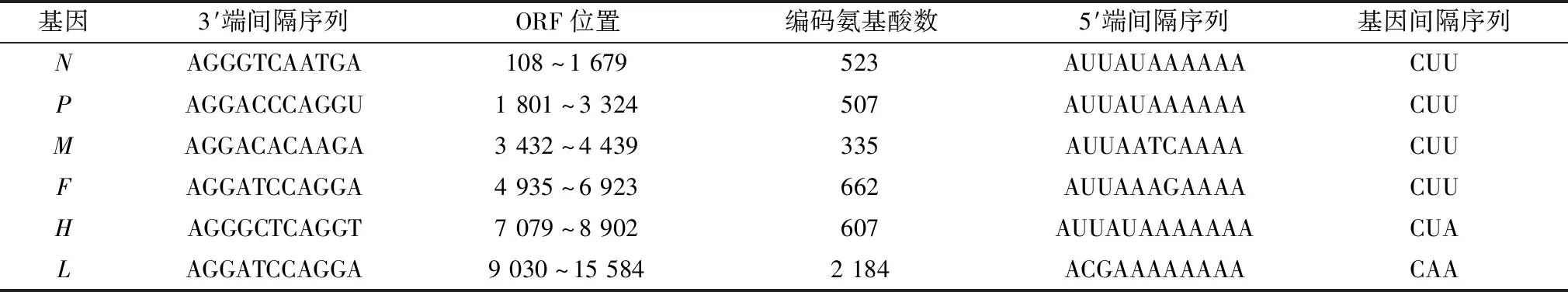
表2 狐源犬瘟热病毒基因编码蛋白及基因间隔序列
2.3 狐源基因组序列与其他株CDV同源性分析利用MegAlign对HBF-1株和GenBank上公布的21株CDV全基因组序列进行比对分析。HBF-1株为犬瘟热病毒河北狐源分离株Hebei的Vero-dSlam细胞适应株,因此两者同源率最高,为99.8%(图2)。HBF-1株与A75/17株(America-1型强毒株) 的亲缘关系近,同源率最高,同源率为96.2%,与疫苗株Onderstepoort、Snyder Hill、CDV-3的亲缘关系相对较远,同源率相对较低,分别为92.7%,92.8% 和92.7%(图2)。由地域分型可看出HBF-1株与HLJ-06(黑龙江)亚洲地区毒株亲缘关系较近,同源性为98.5%。HBF-1株与其他CDV全基因组同源率分别为:01-2689(95.6%)、007LM(94.6%)、011C(94.5%)、50Con(94.6%)、55L(94.5%)、98-2646(94.8%)、98-2654(94.8%)、002601(95.6%)、5804P(95.5%)、164071(96.1%)、CYN07-hv(97.7%)、M25CR(94.5%)、Phoca-Caspian-2007(92.8%)和Shuskly(92.8%)。
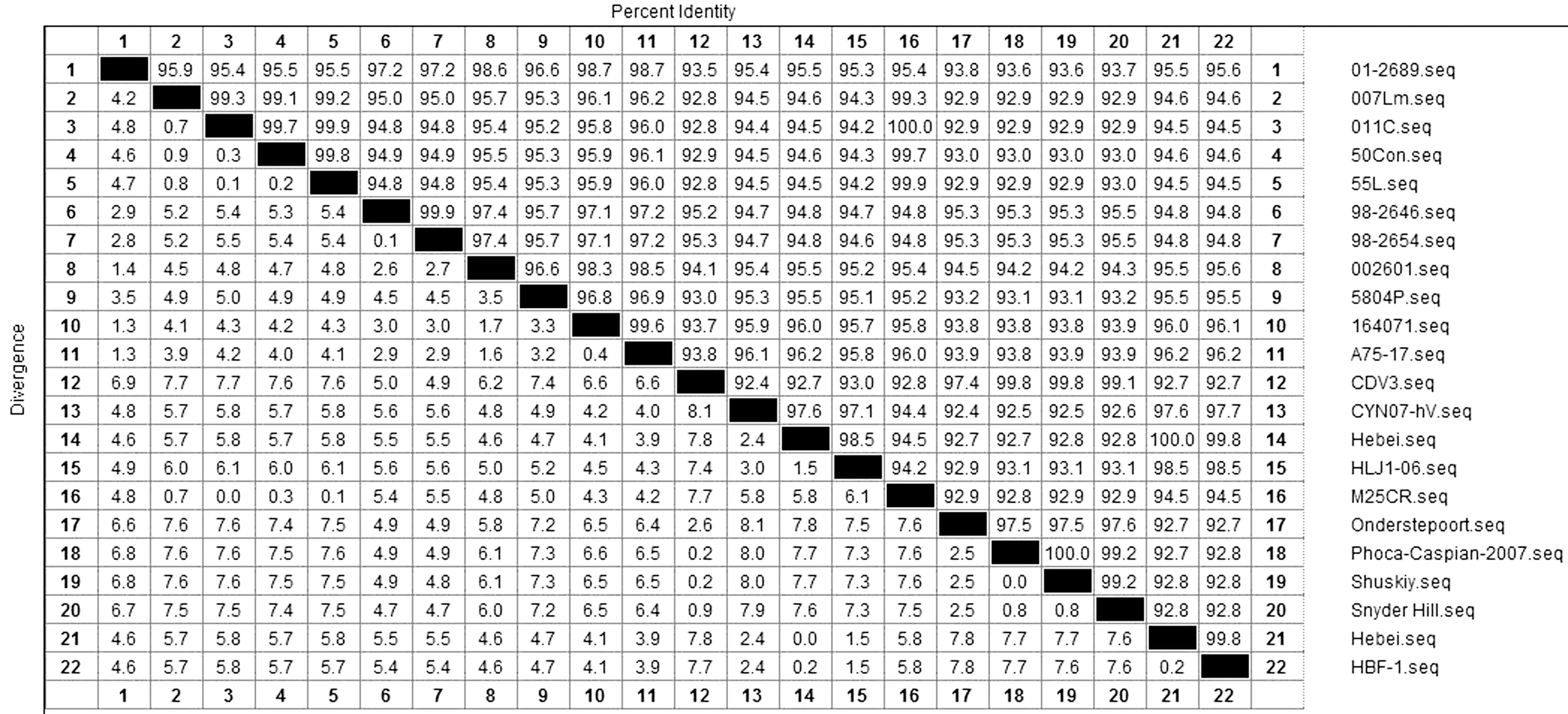
图2 CDV-HBF-1株全基因组与其他CDV基因组同源性比较
2.4 HBF-1株氨基酸序列分析由于分离株Hebei与Vero-dSlam细胞适应株HBF-1的全基因组核苷酸序列存在0.2%的差异。因此,使用DNAstar软件对HBF-1株与Hebei株不同核苷酸位点所对应编码位点进行了比对,发现一些保守氨基酸发生突变(表3),这些突变可能对蛋白的结构与构象产生影响[12]。

表3 HBF-1株与Hebei 株的编码区保守氨基酸处氨基酸突变位
注:a.全基因组中核酸的位置;b.每个蛋白中氨基酸的位置;c.“-”为非编码区
将CDV HBF-1株的H氨基酸序列与其他强毒株和疫苗株比对显示,各疫苗株在固定位点有确定氨基酸的变化,而各强毒株的氨基酸的变化没有特定的规律(图3)。H基因是CDV的主要抗原性保护基因,也是变异率最高的基因,因此通常被用于CDV进行基因分型[13]。运用DNAstar和MEGA6.0软件对所扩增的 HBF-1H基因组与GenBank中其他CDV毒株的H基因进行序列分析,结果显示,HBF-1株与HLJ1-06毒株亲缘关系较近(图4),其同源率为98.5%,属于Asia-1型,与国际标准疫苗株Onderstepoort同源率较低,仅为92.7%,与国际标准强毒株A75/17同源率高达96.2%,可以确定CDV-HBF-1毒株为Asia-1型强毒株。
3 讨论
近年来,国内外犬瘟热发病趋势呈现上升状态,免疫接种的动物也有发病报道[14-15],犬瘟热病毒的自然感染宿主范围不断扩大,甚至可感染非人灵长类[16-17],因此,对野毒株进行全基因组序列分析有重要意义。本研究获得了分离株Hebei的Vero-dSlam细胞适应株HBF-1,对HBF-1株的全基因组进行了序列测定和分析。首先以GenBank中已公布的CDV全基因组序列的相对保守区为模板,设计11对特异性引物,通过RT-PCR方法扩增获得11个目的片段。然后,将11个片段纯化后,连接至平端载体pEASY-Blunt上,进行序列测定,每个碱基位点保证测序6~8次,最后拼接获得HBF-1全基因组序列。对HBF-1全基因组序列分析结果显示:HBF-1株基因组全长为15 690 nt,从3′到5′端依次编码N、P、M、F、H和L 6个结构蛋白,其ORF框大小分别为1 569,1 521,1 005,1 986,1 821,6 552 nt。将HBF-1株与Hebei株核苷酸比对可知,在基因的非编码区和编码区都存在核苷酸变异,但与其他CDV毒株比对发现,各个毒株在结构基因的起始和终止位置基本一致,基因长度和其基因间隔序列也基本相同,说明CDV的基因结构在遗传上是相对保守的,这与之前报道一致[18]。通过与GenBank中已公布的其他CDV毒株的同源率分析可知,HBF-1株与HLJ-06株同源性最高为98.5%,而与CDV3、Onderstepoort等疫苗株相似性较低,同源率都为92.7%,HBF-1株为Asia-1型强毒株。

图3 CDV各个毒株H蛋白氨基酸序列分析
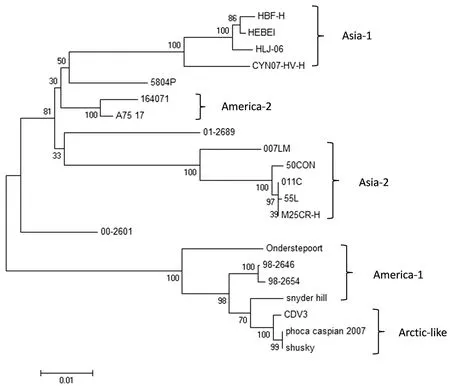
图4 基于H基因氨基酸序列的不同CDV毒株遗传系统进化树
CDV HBF-1株与最初的分离毒Hebei株序列比对发现,在其编码区有13处氨基酸发生了变异,我们推测,这些变异很有可能是在病毒适应细胞过程中产生的。 但是目前尚不清楚CDV强毒株Hebei适应细胞后,病毒HBF-1的毒力和致病性是否发生改变,这些变异与病毒毒力和致病性的具体关系,仍需要后续进一步研究。研究表明,CDV H蛋白的 542 位突变为 N和549 位突变为 H,可引起当地犬瘟热暴发,发病动物死亡率较高[19]。犬源与非犬源CDV在H基因氨基酸530和549位点上有显著差异,其中犬源CDV多为549Y,非犬源(狐狸、水貂、貉等)CDV则更趋向于549H[6],狐源CDV HBF-1株的H氨基酸序列与其他强毒株和疫苗株的比对结果显示,HBF-1的H蛋白出现了2处氨基酸突变,549位由Y突变为H,这将增加CDV HBF-1毒株对其他宿主的感染和适应能力。另外F和H蛋白共同介导了相邻细胞间的融合作用[20],HBF-1株与Hebei株比对显示,F和H蛋白都有2处氨基酸突变,这可能影响蛋白的二级结构的形成,进而对适应细胞和促使细胞间膜融合产生影响。
