1株犬源PCV3的全基因克隆与序列分析
2020-05-18辛佳亮韩知晓闭璟珊孔子荣张书祥孙文超鲁会军金宁一1
辛佳亮,汪 伟,杜 倩,韩知晓,闭璟珊,孔子荣,张书祥,孙文超,曹 亮,鲁会军,郑 敏,金宁一1,*
(1.广西大学 动物科学技术学院,广西 南宁 530004;2.广西壮族自治区动物疫病预防控制中心,广西 南宁 530000;3.温州大学 病毒学研究所,浙江 温州 325035;4.军事医学科学院 军事兽医研究所,吉林 长春 130122)
猪圆环病毒3型(porcine circovirus type 3,PCV3)是近年来发现的一种新型猪圆环病毒,属圆环病毒科圆环病毒属,是一种共价闭合、无包膜的单股环状DNA病毒[1]。该病毒全长 2 000 bp,包含3个主要的开放阅读框(opening reading frame,ORF),分别是编码296个氨基酸组成的复制蛋白酶(replicase protein,Rep)的ORF1、编码214个氨基酸组成的衣壳蛋白(capsid protein,Cap)的ORF2和编码230个氨基酸组成的功能未知蛋白的ORF3[2]。
2016年,美国学者PALINSKI等[2]和PHAN等[3]从罹患心肌炎和多系统炎症的仔猪中发现PCV3。随后,在欧洲和亚洲各国的猪群中也相继发现了PCV3的存在[2-8],并且可分为PCV3a和PCV3b等2个亚型[9-10],这说明PCV3在世界范围内广泛存在。临床资料显示,PCV3可通过胎盘和精液进行传播[3,10],不同年龄、性别和品种的猪群均可感染PCV3,但以妊娠母猪和仔猪最为易感[3,5],主要表现为猪皮炎与肾病综合征(porcine dermatitis and nephropathy syndrome,PDNS)、母猪繁殖障碍(reprdouctive failure sows)和仔猪腹泻(piglet diarrhea)等问题[2-3,11]。研究发现,可从犬群中检测到PCV3[12],这暗示着PCV3可能和PCV2同样具有跨物种传播的能力[13]。
为进一步确认PCV3能感染犬,并了解广西地区犬源PCV3毒株的流行情况及其分子特征、分析不同宿主及国内外PCV3毒株进化关系,本试验拟对广西多个地区采集的犬血清进行检测,以期为进一步开展PCV3病毒遗传进化、致病性研究以及跨种传播奠定基础。
1 材料与方法
1.1 病料由广西动物疫病预防控制中心采集并保存来源于广西防城港、玉林和百色3个地区的养殖场中的犬或散养家犬的血清,共计148份。
1.2 主要菌株、试剂和载体2×Taq PCR MasterMix、病毒基因组DNA/RNA提取试剂盒、Maker Ⅲ、DNA纯化回收试剂盒和质粒小提试剂盒购自天根生化有限公司;Trans5α感受态细胞购自北京全式金生物技术有限公司;琼脂粉、琼脂糖、蛋白胨、酵母粉购自生工生物工程(上海)股份有限公司;pMD-18T Simple Vector购自大连宝生物公司;其他试剂均为国产分析纯。
1.3 病毒基因组提取根据天根的病毒基因组DNA/RNA提取试剂盒的方法,提取犬血清DNA,并于-20℃保存备用。
1.4 病毒检测和全基因组扩增根据GenBank中GX-920/2017(GenBank:MG253683.1)毒株序列,设计合成1对检测引物(JC-F/R)和2对扩增全长引物(PCV3-F/R)(表1)。引物均由生工生物工程股份有限公司公司合成。
1.4.125 μL检测反应体系及反应条件 反应体系如下:2×Taq PCR MasterMix 12.5 μL,JC-F和JC-R各0.5 μL,DNA模板1.5 μL,ddH2O 10.0 μL。反应条件为95℃预变性5 min;95℃变性30 s,56℃退火50 s,72℃延伸1 min,共30循环;72℃延伸10 min。扩增产物进行1.0%琼脂糖凝胶电泳鉴定。
1.4.250 μL全长反应体系及反应条件 反应体系如下:2×Taq PCR MasterMix 25.0 μL,PCV3-F和PCV3-R各1 μL,DNA模板3 μL,ddH2O 20.0 μL。反应条件为95℃预变性5 min;95℃变性30 s,62℃退火50 s,72℃延伸2 min,共30循环;72℃延伸10 min。扩增产物进行1.0%琼脂糖凝胶电泳鉴定。

表1 PCV3 检测和全长引物
1.5 目的片段胶回收、克隆鉴定和测序使用DNA纯化回收试剂盒回收扩增的目的片段。将回收纯化后的DNA片段与pMD18-T Simple Vector连接并转化至Trans5α感受态细胞中。将转化菌液均匀涂布含有氨苄青霉素的LB平板培养12 h,挑取单个白色菌落,接种于含有氨苄青霉素的LB液体培养基中,置于37℃、220 r/min的摇床中培养12 h。将培养的菌液按天根质粒小提试剂盒方法提取质粒,进行PCR鉴定。将鉴定结果为阳性的质粒送吉林库美生物有限公司测序。
1.6 序列分析应用DNAstar软件将获得的基因序列与NCBI公布的代表参考毒株 进行氨基酸序列和核苷酸序列比对。
1.7 系统进化分析利用MEGA7.0软件,使用Maximum Likelihood (ML) 法p-distance模式构建系统进化树,并进行基因分型。
2 结果
2.1 分子流行病学调查利用JC-F/JC-R引物对148份犬血清进行PCR扩增,目的片段为650 bp,发现其中36份为PCV3阳性样品,阳性率为24.3%,部分样品检测结果如下图所示(图1)。
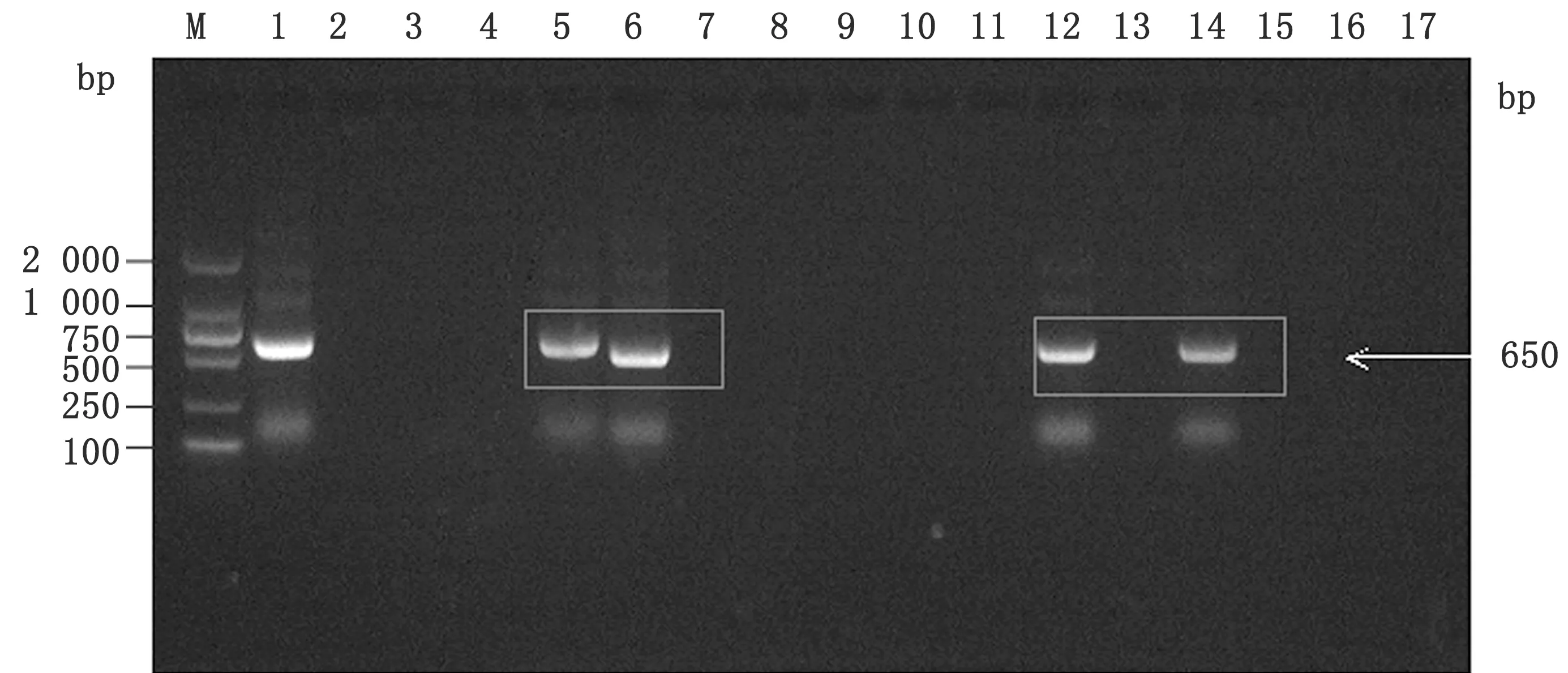
图1 部分PCR检测结果 M.DL2000 DNA Marker;1.阳性对照;2.阴性对照;3~17.临床样品
2.2 基于基因组的序列分析选取1份阳性样品DNA经PCV3-1F/R和PCV3-2F/R等2对引物分别进行PCR扩增,目的片段分别为1 300 bp和1 100 bp(图2)。并对获得的目的片段进行回收,克隆和测序。利用DNAstar软件进行拼接。结果显示目的片段核苷酸序列长度为2 000 bp,将该毒株命名为PCV3/Guangxi-5 (GenBank:MH916639.1)。将PCV3/Guangxi-5 序列与NCBI公布的PCV3的参考序列进行同源性比对,结果显示Guangxi-5与参考序列的全基因序列同源性为98.9%~100.0%,其中PCV3/Guangxi-5与DE27.16(GenBank:MG014370.1)株同源性最低,与PCV3/CN/Chongqing-148/2016(GenBank:KY075991.1))同源性最高(图3)。此外对ORF2基因的氨基酸序列进行比对发现,第24至第27位氨基酸有6种形式,分别为VRRK、ARRR、ARKR、LRRK、VRRR和ARRK。
2.3 系统进化树分析
2.3.1基于ORF2基因的系统发育分析 基于ORF2基因的系统发育分析(图4A),结果表明本试验获得的PCV3/Guangxi-5(GenBank:MH916639.1)为PCV3a亚型,与PCV3/CN/Liaoning-23/2016(GenBank:KY354060.1)亲缘关系最近。此外,本试验获得的犬源PCV3/Guangxi-5与NCBI公布的犬源CCV-A、CCV-B、CCV-C毒株不在同一基因亚型,这暗示PCV3毒株可能没有明显的物种差异。
2.3.2基于全基因组的系统进化分析 同样使用Maximum Likelihood (ML) 法p-distance模式构建基于全基因组序列的系统进化树(图4B),结果显示本试验获得的PCV3毒株基因型为PCV3a,且与CN/chongqing-148/2016(GenBank:KY075991.1)亲缘关系较近,与CNFJ-1(GenBank:KY753912.1)等毒株亲缘性较远。

图2 目的片段PCR扩结果 M.DL2000 DNA Marker;1.PCV3-1F/R产物;2.PCV3-2F/R产物
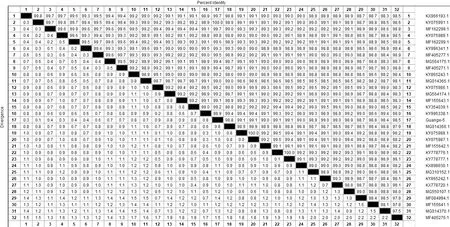
图3 PCV3全基因组序列分析
3 讨论
猪圆环病毒(porcine circovirus,PCV)是一种环状、单链和无包膜的DNA病毒,是圆环病毒科(Circoviridae)圆环病毒属(Circovirus)的重要成员之一[14]。该病毒在2016年前被认为只存在2个基因型,即PCV1和PCV2[15-16],其中PCV1被认为对动物没有致病性;PCV2则被认为与多种临床疾病相关。PCV2可引起患猪淋巴细胞和组织细胞凋亡[17],出现免疫抑制问题[14]。虽然单独感染PCV2的临床症状轻微,但是当与其他病毒混合感染时,有利于其他病毒的感染和增殖,如与PRRSV、PRV、PPV等病毒混合感染出现PMWS症状[14]。此外在跨物种传播方面,PCV2已被证实可感染牛、羊和犬[18],具有跨种传播能力[19]。
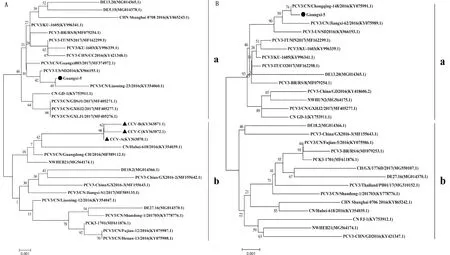
图4 基于PCV3 ORF2基因的系统发育树
2016年美国学者从患病母猪和仔猪的体内检测到一种新型圆环病毒——猪圆环病毒3型(PCV3)[2-3]。自PCV3被正式报道以来,在欧洲和亚洲各国和地区也相继报道了PCV3感染的情况[4-8],这表明PCV3在世界范围内广泛存在。对PCV3基因组研究发现PCV3具有和PCV1和PCV2相似的基因结构,均存在ORF1和ORF2等2个开放阅读框,2个阅读框分别编码ORF1(Rep)蛋白和ORF2(Cap)蛋白[2]。氨基酸序列比对分析发现PCV3与PCV2的Cap蛋白氨基酸序列同源性仅为30%[11],推测PCV2和PCV3相互之间不具有交叉保护的特性。但在跨物种传播方面,近期的一项研究令人十分惊讶。ZHANG等[12]从犬群中检测到PCV3,推测PCV3可能与PCV2类似,具备的跨种传播能力。
本试验对ORF2基因编码的Cap蛋白氨基酸进行比对分析发现,Cap蛋白的氨基酸位点突变主要集中在第24位至第27位氨基酸上,且有6种形式(VRRK、ARRR、ARKR、LRRK、VRRR和ARRK)。据报道,PCV2的ORF2编码的Cap发生变异可能导致新的变异毒株出现,虽然PCV3和PCV2的Cap蛋白同源性较低,但考虑Cap蛋白作为PCV主要结构蛋白,可诱导动物机体产生特异性免疫应答[20-23],由此推测PCV3毒株的变异与其Cap蛋白氨基酸突变也可能存在一定关联。
结合氨基酸序列和系统进化树进行分析,发现第24至27位氨基酸序列为LRRK和VRRK的PCV3毒株主要集中在PCV3a中,氨基酸序列为ARRR,VRRR,ARKR,VRRR和一小部分VRRK的毒株集中在PCV3b,推测Cap蛋白的第24位至27位氨基酸的形式与基因型之间可能存在一定联系。此外,分析发现犬源PCV3毒株之间的同源性并不是最高的,且PCV3/Guangxi-5与CCV-A、CCV-B、CCV-C处不同基因亚型,这暗示PCV3毒株可能没有明显的物种差异。
综上所述,本试验从犬血清样品中检测到PCV3的基因组,证实了广西地区的犬群中已经存在PCV3感染的情况,并完成1株犬源PCV3的全基因序列测定,理论上丰富了广西地区PCV3的流行病学资料,为PCV3的防治措施的制定和流行病学研究提供一定的参考依据。
