猪瘟Erns蛋白在杆状病毒表达系统中的表达及其抗体间接ELISA方法的建立
2020-05-18李润成黎满香李岱霞余兴龙
任 杰,葛 猛*,李润成,郑 金,凌 同,黎满香,李岱霞,张 磊,余兴龙*
(1.湖南农业大学 动物医学院,湖南 长沙 410128;2.湖南中岸生物药业有限公司 工程技术中心,湖南 长沙 410100)
猪瘟(classical swine fever,CSF)是由猪瘟病毒(classical swine fever virus,CSFV)引起的一种高度接触性传染病,对养猪业危害严重,被世界动物卫生组织(Office International Des Epizooties,OIE)列为必报的动物传染病,我国将其列为一类动物疫病[1-2]。因为猪瘟兔化弱毒疫苗在我国长期使用,基本控制了CSF大规模流行。但是,一些低毒力毒株感染引起的慢性猪瘟及持续性感染还普遍存在[2],仍然严重危害我国养猪业的健康发展。对该病的控制和净化一直是我国动物疫病防治的重要目标,根据《国家中长期动物疫病防治规划(2012—2020)》的要求,我国要逐步实现猪瘟的净化。国外多个发达国家通过停止使用疫苗结合野毒的免疫监测及扑杀,实现了猪瘟的净化,而我国目前完全停止使用疫苗的条件还不成熟,通过疫苗免疫结合鉴别诊断筛选并扑杀野毒感染猪的综合措施更加适合现阶段我国的猪瘟净化工作。在E2亚单位疫苗被成功开发并且逐步应用于临床的情况下,适用于临床大规模、高通量检测的免疫学鉴别诊断方法成为猪瘟净化工作的一个关键。
CSFV属黄病毒科瘟病毒属成员,是有囊膜的单股正链RNA病毒,CSFV基因组约为12.3 kb[3],编码1个由3 898个氨基酸组成的多聚蛋白[4],在病毒蛋白酶和宿主细胞酶的作用下被加工成12个成熟蛋白[5],其中Erns和E2为猪瘟的2个主要保护性抗原[6],而E2诱导中和抗体的能力最强,目前,CSFV基因工程疫苗主要基于E2蛋白进行研究和开发。CSFV Erns蛋白是除E2蛋白之外具有较强抗原反应性的蛋白[6],是一个潜在的用于建立猪瘟野毒感染的血清学鉴别诊断方法的抗原。目前国外已经有针对Erns抗体检测的商品化试剂盒,但是普遍存在检测敏感性不足的问题[7]。最近,QIAGEN公司新开发的Erns抗体检测试剂盒开始进入我国,但是其具体的检测效果还有待临床验证。无论如何,进口试剂盒的价格昂贵,不利于临床大规模应用,因此,研究Erns抗体检测方法及试剂盒仍然十分有必要。
1 材料与方法
1.1 菌株、质粒和主要试剂连接有完整CSFV Erns基因的质粒pET28a-Erns由南京金斯瑞公司合成;大肠杆菌 DH5α由本实验室保存;大肠杆菌DH10Bac、杆状病毒转移载体pFastBac1,购自Invitrogen公司;EcoRⅠ、SalⅠ限制性内切酶、T4DNA连接酶购自大连宝生物工程有限公司;Pfu DNA 聚合酶、DNA 聚合酶均购自北京天恩泽基因科技有限公司;转染试剂Cellfectin Reagent和优级胎牛血清购自GIBCO公司,ECL显色试剂盒购自MILLIPORE公司,辣根过氧化物酶(HRP)标记的羊抗猪IgG(酶标二抗)、TMB均为KPL公司产品;96孔酶标板以及细胞培养板为Corning公司产品;Ni-IDA为武汉汇研生物科技有限公司产品。
1.2 细胞与培养基Sf9昆虫细胞、High Five昆虫细胞购自Invitrogen公司;Grace's培养基、Express Five培养基购自GIBCO公司。
1.3 血清与试剂盒血清包括CSFV阴性血清56份、免疫CSFV弱毒疫苗临床猪血清126份、CSFV野毒攻毒试验猪血清45份和免疫CSFV E2亚单位疫苗猪血清92份,共319份。除CSFV野毒攻毒试验猪血清(已灭活)由军事医学科学院惠赠外,其他血清均由湖南农业大学分子生物与免疫学实验室保存。
IDEXX CSFV抗体检测试剂盒为美国IDEXX公司产品,检测CSFV E2抗体(批号:M301);pigtype CSFV Erns抗体检测试剂盒为德国QIAGEN公司产品,检测CSFV Erns抗体(批号:254110828)。
1.4 重组转移载体pFastBac-Erns的构建与鉴定根据pET28a-Erns质粒序列,设计1对引物,上游引物5′端包含EcoRⅠ酶切位点、3个保护性碱基和Kozak序列,含有原有信号肽。下游引物在终止密码子前加入了编码6个组氨酸的碱基序列和SalⅠ酶切位点。预计PCR扩增产物长度为705 bp。
Erns-F:5′-CGCGAATTCACCATGGAAAAA-GCCCTATTGGCTTG-3′;
Erns-R:5′-CCGGTCGACTTAATGGTGATGGTGATGATGGGCCCTTGCCGCACCCTGCC-3′。
以pET28a-Erns质粒为模板,Erns-F和Erns-R为引物,用Pfu DNA 聚合酶扩增表达片段。循环参数为:94℃预变性4 min;94℃变性30 s,55℃退火30 s,68℃延伸90 s,共30个循环;68℃延伸10 min。取5 μL PCR产物用10 g/L琼脂糖凝胶(含0.5 mg/L EB)进行电泳检测。
将目的基因PCR扩增片段进行胶纯化,用EcoRⅠ和SalⅠ进行消化后连接到经同样酶消化的pFastBacⅠ载体质粒上,转化DH5α感受态细胞,在氨苄抗生素平板上进行筛选,挑取阳性克隆进行扩增,小量提取质粒,进行EcoRⅠ和SalⅠ酶切鉴定,筛选得到阳性转移载体质粒。序列测定以验证插入序列的正确性,将鉴定正确的重组质粒命名为pFastBac-Erns。
1.5 表达Erns重组杆状病毒的构建与鉴定将pFastBac-Erns转化DH10Bac大肠杆菌,蓝白斑筛选提取杆粒,PCR鉴定重组杆粒rBacmid-Erns。采用Cellfectin Reagent将rBacmid-Erns转染对数期生长的Sf9昆虫细胞,经5~7 d直至细胞出现病变时,提取重组杆状病毒基因组DNA,用Erns-F和特异性M13下游引物进行PCR扩增,鉴定重组杆状病毒,扩增种毒,空斑测定病毒滴度,将获得的重组杆状病毒命名为rBac-Erns,4℃避光保存。
1.6 Erns的表达、纯化与WB鉴定重组杆状病毒rBac-Erns接种对数期生长的High Five昆虫细胞,27℃表达96 h,收集上清,10 000×g离心后,通过Ni-IDA进行亲和层析纯化。取表达产物直接进行SDS-PAGE电泳,电转印至PVDF膜,用含0.2%明胶的PBST室温封闭1 h,以1∶2 000稀释的鼠抗Erns抗体为一抗,4℃孵育过夜,PBST洗涤,1∶5 000稀释的HRP标记羊抗鼠IgG为二抗,作用45 min,ECL显色试剂盒检测。
1.7 间接ELISA方法(Erns-iELISA)的建立
1.7.1最适抗原工作浓度和血清稀释度的确定 用碳酸盐缓冲液(pH9.6)将纯化的重组蛋白倍比稀释到2.4,1.2,0.6 mg /L后,以每孔100 μL加入到96孔酶标板,4℃包被24 h。将经IDEXX CSFV E2抗体检测试剂盒和pigtype CSFV Erns抗体检测试剂盒共同确认为阳性和阴性的血清分别以1∶50,1∶100,1∶200进行倍比稀释后,进行方阵滴定;HRP标记的羊抗猪IgG以1∶6 000稀释,用TMB显色,2 mol/L的H2SO4终止反应,测定D450 nm值,P/N值最大时的抗原浓度和血清稀释度作为最适抗原工作质量浓度和血清稀释度。
1.7.2反应条件的优化 选用确定的最适抗原浓度和血清稀释度,分别对酶标二抗的工作浓度、封闭时间、底物反应时间等进行优化,每次检测D450 nm值,按P/N值最大的原则确定最佳反应条件。
1.7.3判断标准的设定 在ELISA反应条件确定后,选取经IDEXX CSFV抗体检测试剂盒、pigtype CSFV Erns抗体检测试剂盒和PCR确认为病毒核酸阴性的CSFV抗体阴性血清56份,按照上述最佳工作条件进行检测,计算其平均S/P值{S/P值=(样品检测D450 nm值-参考阴性血清D450 nm值)÷(参考阳性血清D450 nm-参考阴性血清D450 nm值)}和标准偏差s值,根据公式(平均S/P值+3×s值)计算临界值,确定其结果判定标准。
1.8 敏感性和灵敏度试验选取经pigtype CSFV Erns抗体检测试剂盒或IDEXX CSFV抗体检测试剂盒检测为阳性的171份血清,其中免疫CSFV弱毒疫苗临床猪血清126份,CSFV野毒攻毒试验猪血清45份,用Erns-iELISA方法进行检测,以上述2种试剂盒检测结果为参照,根据检测结果的阳性率来分析其检测敏感性;再选取2份上述2种试剂盒检测均为阳性的血清分别从1∶100开始,倍比稀释至1∶6 400,按最佳检测条件进行ELISA检测,确定该方法的灵敏度。
1.9 特异性和交叉反应性试验选取经pigtype CSFV Erns抗体检测试剂盒检测为阴性的92份血清,用Erns-iELISA方法进行检测,以pigtype CSFV Erns抗体检测试剂盒结果为参考,分析Erns-iELISA方法的检测特异性;再用Erns-iELISA方法分别检测猪流行性腹泻病毒(PEDV)、猪繁殖与呼吸系统综合征病毒(PRRSV)、猪圆环病毒2(PCV2)的阳性血清,每份血清做3个平行重复,分析Erns-iELISA与其他病毒血清的交叉反应性。
1.10 重复性选取CSFV抗体阳性和阴性的猪血清12份,每个样品做3孔重复,分别在同一块抗原包被板上和3块不同批次的抗原包被板上检测,计算每份血清的变异系数以及所有血清的平均变异系数,值越小表示差异越小,其中同一块板上的结果表示批内差异,不同板上的检测结果表示批间差异。
2 结果
2.1 重组转移载体pFastBac-Erns的构建PCR产物经琼脂糖电泳,在705 bp左右出现特异性条带,大小与预期相同(图1A),经EcoRⅠ和SalⅠ消化的Erns与经同样酶消化的pFastBacⅠ载体进行连接,转化后挑取菌落扩菌,提取质粒进行PCR和酶切鉴定,结果均出现与预期大小一致的目的条带(图1B)。
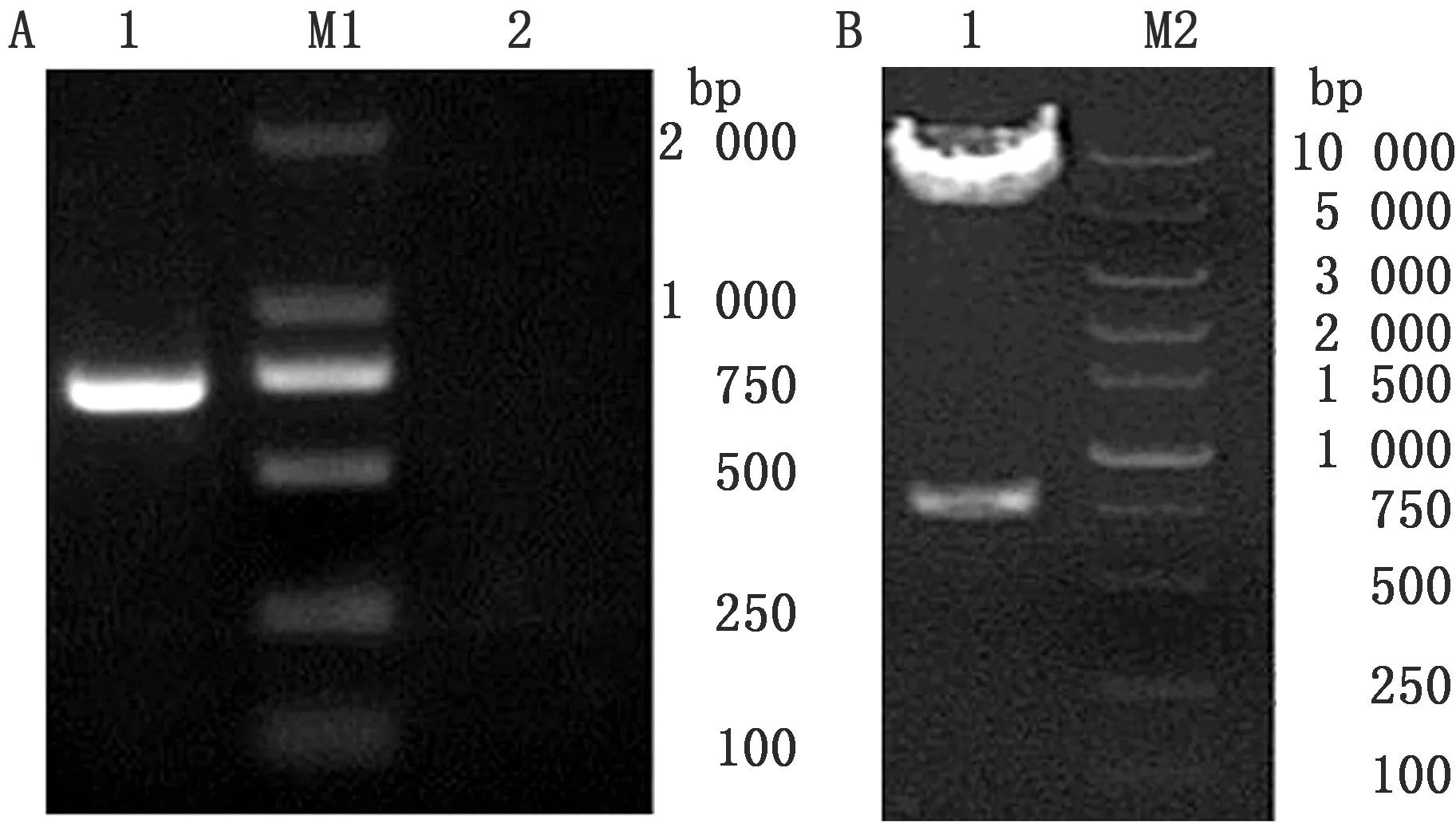
图1 Erns的PCR扩增和pFastBac-Erns双酶切鉴定 A.Erns的PCR扩增,A1.目的基因PCR结果;M1.DL2000 DNA Marker;A2.阴性对照;B.pFastBac-Erns质粒双酶切,M2:DL10000 DNA Marker;B1.pFastBac-Erns双酶切产物
2.2 重组杆状病毒PCR鉴定重组杆粒转染rBacmid-Erns转染Sf9昆虫细胞,细胞出现病变后提取重组杆状病毒基因组DNA,用Erns-F和M13下游引物PCR扩增,出现特异性条带(图2)。
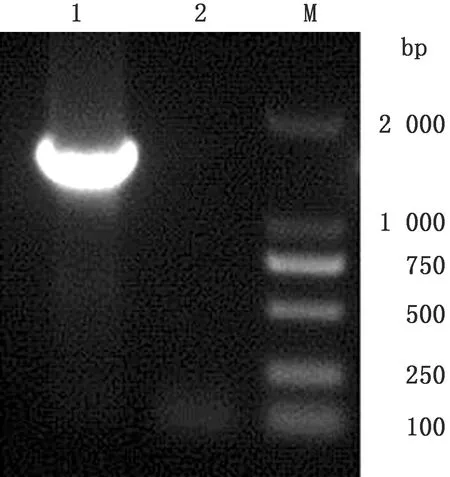
图2 重组杆状病毒PCR鉴定 1.重组杆状病毒PCR产物;2.阴性对照;M.DL2000 DNA Marker
2.3 表达产物的SDS-PAGE和Western blot检测收集重组杆状病毒感染High Five细胞96 h后上清进行SDS-PAGE,转膜,以鼠抗Erns抗体为一抗,Western blot显示特异性条带(图3A)。全部上清经亲和层析纯化(图3B),用BCA法测定重组蛋白质量浓度约为0.12 g/L。
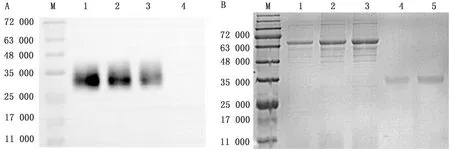
图3 表达产物Western blot检测和纯化后SDS-PAGE M.蛋白分子量标准;A.表达产物Western blot检测;A1~A3.表达产物;A4.阴性对照;B.表达产物经镍亲和层析纯化后SDS-PAGE;B1.表达产物;B2.流穿;B3.洗涤;B4、B5.洗脱
2.4 间接ELISA方法的反应条件根据方阵滴定及各项试验条件优化的结果,最终确定ELISA的程序如下:抗原包被量为120 ng/孔,血清稀释倍数为100倍 (表1),封闭30 min,酶标二抗稀释倍数为6 000 倍,底物作用15 min,临界值为0.329。
2.5 特异性试验经pigtype CSFV Erns抗体检测试剂盒检测为阴性的92份血清,用Erns-iELISA方法检测的结果为阴性81份,阳性11份,检测特异性为88.04%。
Erns-iELISA方法对PCV2、PRRSV、PEDV阳性血清检测的S/P值均小于0.3,判定为阴性,显示Erns-iELISA方法与PCV2、PRRSV、PEDV无交叉反应(表2)。
2.6 敏感性试验对171份CSFV阳性血清,Erns-iELISA检测结果为阳性159份,检测敏感性为92.98%;对其中45份CSFV野毒攻毒试验猪血清,Erns-iELSIA、pigtype CSFV Erns抗体检测试剂盒、IDEXX CSFV抗体检测试剂盒的敏感性分别为:93.33%、95.56%和95.56%。对于126份CSFV弱毒疫苗免疫猪血清,Erns-iELISA、pigtype CSFV Erns抗体检测试剂盒、IDEXX CSFV抗体检测试剂盒的敏感性分别为92.86%,49.21%和100%(表3)。
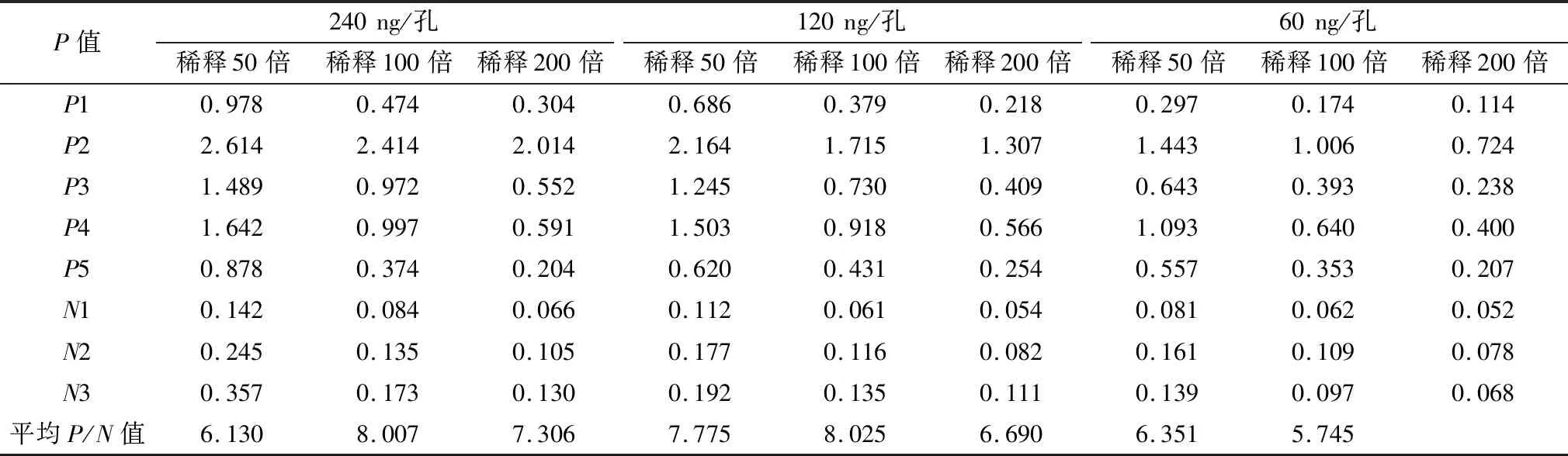
表1 ELISA方阵滴定结果

表2 血清交叉反应检测结果
注:“+”为阳性,“-”为阴性。下同
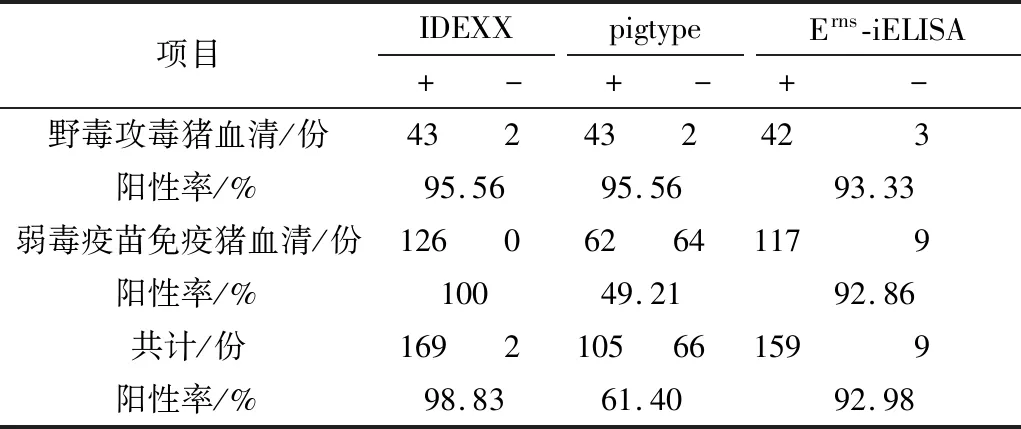
表3 敏感性试验
对选取的2份CSFV抗体阳性血清,分别从1∶100开始,倍比稀释至1∶6 400,按最佳ELISA检测条件进行检测。结果显示,当2份血清分别稀释至1∶3 200和1∶800时,其对应S/P值分别为0.34和0.32,仍为阳性。该方法对选取的2份CSFV阳性血清的敏感度分别为1∶3 200和1∶800,表明Erns-iELISA方法具有较高的敏感度(表4)。
2.7 重复性试验批内差异分析显示,12份阳性血清变异系数为5.27%~9.53%,平均7.4%,而批间差异分析显示,变异系数为8.35%~13.13%,平均10.74%;12份阴性血清的批内和批间差异较小,表明Erns-iELISA方法具有较好的重复性。

表4 敏感度检测
3 讨论
Erns蛋白由CSFV多聚蛋白的第268位谷氨酸至第494位丙氨酸的227个氨基酸组成[8],其碳骨架约为26 000,第2、7、11、65、95、143、158位氨基酸为潜在糖基化位点[9-10],是一个高度糖基化蛋白,其相对分子质量随糖基化程度不同而改变,天然Erns蛋白相对分子质量为44 000~48 000,主要以相对分子质量约为90 000的同源二聚体形式存在[11-12],N-糖苷约占其相对分子质量的50%,且有助于蛋白的正确折叠加工和分泌[13]。
虽然有研究者证明经原核表达系统所表达的不同Erns片段也具有较好的抗原反应性[14-15],但是一般来说病毒结构蛋白的糖基化会影响蛋白的构象和抗体的产生。研究证明,只有糖基化的Erns蛋白才能对致死量CSFV的攻击形成保护[10]。因此,获得具有正确构象和糖基化的Erns蛋白对于保证其抗原活性并建立Erns抗体检测方法至关重要。据报道,使用原核和酵母表达系统表达CSFV Erns蛋白,并且建立相应的抗体检测ELISA方法,具有一定的效果[16-17]。杆状病毒表达系统与原核和酵母表达系统相比,在外源蛋白的翻译后修饰与哺乳动物细胞更为相似[18],表达出的外源蛋白更接近其天然结构,且外源蛋白的表达量一般较哺乳动物细胞表达系统更高。因此,本试验选择杆状病毒表达系统来表达CSFV Erns蛋白并建立Erns抗体检测间接ELISA方法。
我国CSFV遗传变异情况相对稳定,CSFV 2.1b亚型是我国当前的优势流行毒株[19],与CSFV疫苗毒株Erns蛋白的核苷酸同源性为82.3%~84.3%,推导氨基酸序列同源性为86.4%~89.5%[20],存在一定的差异。为了增加Erns-iELISA方法对CSFV流行毒株的敏感性,本试验选择国内CSFV流行毒株的Erns基因序列进行人工合成并表达。试验发现,直接取表达产物进行SDS-PAGE,考马斯亮蓝染色后看不见目的条带,但是Western blot能检测到目的蛋白,说明Erns蛋白在杆状病毒表达系统中表达量不高,但是通过亲和层析方法依然能成功纯化到。
在对Erns-iELISA进行敏感性分析的时候,我们发现对于野毒感染血清,该方法及pigtype CSFV Erns抗体检测试剂盒与IDEXX CSFV抗体检测试剂盒都有较高的检测敏感性。而对于弱毒疫苗免疫猪血清,Erns-iELISA与IDEXX CSFV抗体检测试剂盒的检测敏感性明显高于pigtype CSFV Erns抗体检测试剂盒。因此提示pigtype CSFV Erns抗体检测试剂盒可能存在对于部分类似疫苗毒毒株的抗体检测敏感性偏低的问题。综合野毒感染血清和弱毒疫苗免疫猪血清的检测结果分析,Erns-iELISA具有较高的检测敏感性(92.98%)。
对于免疫E2亚单位疫苗的猪群,理论上在没有感染野毒的情况下,猪群的Erns抗体呈阴性,因此本试验选择CSFV E2亚单位疫苗免疫猪的血清对Erns-iELISA的特异性进行评价。参考pigtype CSFV Erns抗体检测试剂盒的结果,Erns-iELISA的检测特异性为88.04%,少部分血清用Erns-iELISA方法检测呈阳性的原因可能是由于国内长期使用CSFV弱毒疫苗,免疫E2亚单位疫苗的猪群可能残留弱毒疫苗抗体,以及Erns-iELISA检测弱毒疫苗抗体的敏感性高于pigtype CSFV Erns抗体检测试剂盒所致。为了进一步确定该方法的检测特异性,我们选择了PCV2、PRRSV、PEDV阳性血清进行了交叉反应性试验,结合2个方面的试验,证明Erns-iELISA具有较好的检测特异性。但是,与牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)猪阳性血清的交叉反应性还有待验证。
综上所述,本试验通过杆状病毒表达系统表达的CSFV Erns蛋白具有良好的抗原反应活性,且用其作为诊断抗原建立了检测Erns抗体的Erns-iELISA方法,初步分析和评估表明该方法对CSFV疫苗毒和国内流行毒株抗体都具有较高的检测敏感性,同时具有较高的检测特异性,且重复性好,具有潜在的开发和应用价值。
