猪SLA-1体外表达及其结合多肽的筛选
2020-05-17巴利民王振豹喻长远
巴利民 , 王振豹 , 齐 鹏 , 汪 明 , 肖 进 , 喻长远
(1. 北京化工大学生命科学与技术学院 , 北京 朝阳 100029 ; 2. 中牧实业股份有限公司 农业部兽用生物制品与化药重点实验室 北京市兽用多肽疫苗设计与制备工程技术中心 , 北京 海淀 100095 ; 3. 中国农业大学动物医学院 , 北京 海淀 100193)
SLA分为3个类群SLA I、SLA II和SLA III。SLA I有10个基因座,其中的SLA-1、SLA-2和SLA-3为经典的功能基因座[1]。SLA-1表达水平最高[2-3],暗示了SLA-1分子在病毒抗原呈递、CD8+T细胞识别甚至异种器官移植方面扮演了更加重要的角色。本试验对猪群中表达频率较高的猪SLA-1(SLA-1*1301)等位基因进行原核表达纯化,利用蛋白质体外复性法进行口蹄疫病毒抗原多肽的体外结合筛选试验。本试验通过高频等位基因筛选体外结合病毒抗原多肽,有助于阐明适合该型猪的细胞毒性T淋巴细胞(Cytotoxic T lymphocyte, CTL)表位多肽及其递呈规律,将为设计出依赖细胞免疫的、多种病毒病的合成肽疫苗提供科学基础,另外对于加强现有市场口蹄疫合成肽疫苗免疫效力有重要的辅助作用。
1 材料与方法
1.1 表达载体与菌株E.coliTrans(DE3)、DH5α,均购自北京全式金生物技术有限公司。含有猪β2m胞外成熟肽全长基因的重组表达质粒和含有猪SLA-1*1301等位基因胞外成熟肽的pET21a-β2m和pET21a-SLA-1*1301重组表达质粒由中美泰和生物科技有限公司合成和提供。
1.2 分子生物学试剂与配制 预测多肽合成由中科亚光生物科技有限公司合成;酵母提取物、胰蛋白胨,均购自OXOID公司;L-精氨酸盐酸盐(L-Arginine hydrochloride)、氧化型谷胱甘肽(Glutathione oxidized,GSSG)、还原型谷胱甘肽(Glutathione reduced,GSH)以及盐酸胍、氨苄青霉素(Amp)、异丙基硫代半乳糖苷(IPTG)、二硫苏糖醇(DTT),均购自Merk公司;其他试验所用到的试剂均为分析纯试剂,购自国内化学试剂公司。
1.3 蛋白的诱导表达和包涵体的提取纯化 表达质粒转化到BL21(DE3)中,挑取单克隆菌落接种至100 mL氨苄抗性LB培养基中,于摇床缓慢摇至8~10 h 后。取1%上述发酵液转接到4 L氨苄抗性LB液体培养基中,37 ℃摇床,220 r/min,培养至OD值为0.4~0.6后,加入终浓度为1 mmol/L的IPTG,170 r/min,继续培养5 h。发酵液在4 ℃,8 000 r/min离心3 min,弃上清液,用40~60 mL PBS进行悬浮,悬浮混匀的菌体进行超声裂解。超声后的菌液4 ℃, 12 000 r/min离心10 min后,可见白色致密菌块即为包涵体。Washing Buffer 20 mL悬浮沉淀,4 ℃, 12 000 r/min离心10 min,倒掉上清。取新的50 mL的离心管称重预冷备用,将离心后的样品倒掉Washing Buffer,用Resuspension Buffer约20 mL悬浮并将悬浮液转至已称重的新的离心管中。4 ℃, 12 000 r/min离心10 min,弃去上清,按30 mg/mL 用盐酸胍溶解包涵体,并在4 ℃条件下搅拌均匀。最后在4 ℃条件下,12 000 r/min离心10 min, 将上清液分装成每管1 mL,-20 ℃保存备用。
1.4 蛋白的复性和纯化
1.4.1 蛋白复性 配制50 mL Refolding Buffer,4 ℃ 冰箱预冷后加入GSH和GSSG。复性过程在4 ℃ 条件下进行。将转子放在装有Refolding Buffer 的150 mL烧杯中,置于磁力搅拌器上,并设置350 r/min 的转速。吸取100 μL β2m包涵体缓缓滴入Refolding Buffer内。搅拌2 h后直接加入15 μL DMSO溶解的多肽;30 min后,将300 μL SLA-1*1301重链包涵体分3次缓缓滴入Refolding Buffer内,每次间隔30 min左右,4 ℃冰箱复性12 h。
1.4.2 蛋白浓缩 将复性液转移至15 mL的超滤浓缩管中(截留分子量为10 kDa)。4 ℃,2 400 r/min于水平离心机上浓缩,浓缩至1 mL以下,加入5倍体积配好的分子筛缓冲液换液,继续浓缩至体积在1 mL 以下。吸取浓缩好的蛋白至1.5 mL的离心管中,4 ℃,12 000 r/min离心10 min,弃去沉淀,将上清转移到新的1.5 mL离心管中,准备上样。
1.4.3 分子筛层析 蛋白浓缩好以后,将SuperdexTM200 increase 10/300 GL凝胶层析柱组装到高效液相色谱仪(HPLC)上,用预冷的分子筛 Buffer平衡凝胶层析柱,调节柱压至3 MPa,流速为0.7 mL/min, 大约35 min后平衡好。此时可设定相关参数。将EP管中准备好的蛋白样品缓慢吸入AKTA 快速蛋白液相色谱(FPLC)进行分子筛层析。在层析柱上根据柱压设置相应的流速,收集相应分子量的目的峰处的蛋白,进行SDS-PAGE和浓缩备用。
2 结果
2.1 SLA-1*1301(α1~α3区)及SLA-β2m表达载体构建 对SLA-1*1301胞外区及SLA-β2m基因序列分别进行大肠杆菌密码子优化,优化后的序列委托中美泰和生物科技有限公司合成,合成后的片段直接连接到本实验室保存的pET21a(+)原核表达载体上,构建出SLA-1*1301(α1~α3区)及SLA-β2m表达载体。将该表达载体转化到E.coliDH5α感受态细胞,涂板挑取单克隆,利用LB培养后再提质粒进行基因测序,测序结果分析后确认正确无误。
2.2 蛋白的诱导表达 pET21a-SLA-1*1301与pET21a-SLA-β2m使用4 L的蛋白诱导表达体系进行表达,IPTG终浓度为1 mmol/L,37 ℃摇床170 r/min 诱导5 h。收集菌体对其进行破碎,离心分离包涵体,对包涵体进行纯化,SDS-PAGE鉴定纯度如图1、2所示,显示提取纯化的SLA-1*1301和SLA-β2m蛋白包涵体纯度较好。
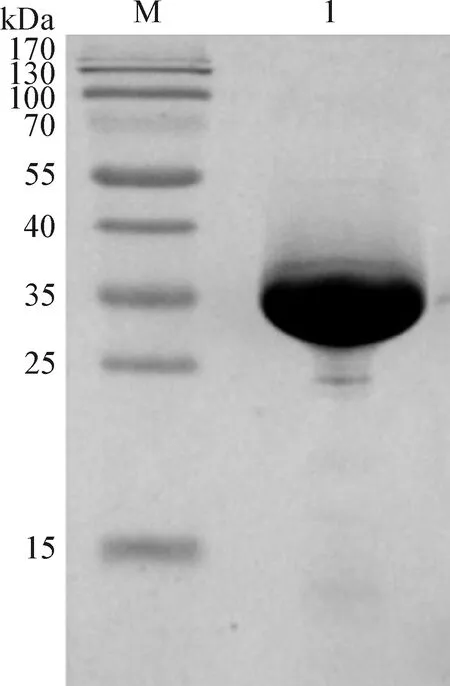
图1 SLA-1*1301表达的SDS-PAGE分析

图2 SLA-β2m表达的SDS-PAGE分析
2.3 体外多肽的筛选 利用http://www.cbs.dtu.dk/services/NetMHC/软件对猪口蹄疫病毒序列进行预测分析,获得6条可能的CTL表位,具体见表1。
SLA-1*1301(α1~α3区)蛋白、SLA-β2m蛋白和预测多肽分别共复性、浓缩,通过蛋白纯化仪纯化检测结果如图3。由图3可以看出,体外复性试验鉴定多肽GD-1、GD-2、GD-4和GD-6的图谱在流出15 mL处,均有明显的尖峰出现,表明这些多肽抗原与猪SLA-1*1301分子有很强的结合能力,这些多肽是含有该SLA-1型猪的有效CTL表位。多肽GD-3和GD-5鉴定图谱15 mL处未出现明显的尖峰,表明结合力不强,不能产生较强的细胞免疫应答。

图3 体外复性试验鉴定多肽与SLA-1*1301分子的结合能力
3 讨论
20世纪80年代,Townsend等首次提出了流感病毒源性的多肽孵育未感染的淋巴细胞之后,流感病毒特异性的T细胞能够对这些淋巴细胞实现杀伤[4]。通过结构生物学分析,研究者发现这些抗原短肽在参与抗原识别与递呈,激活免疫应答过程中起到关键作用。这些短肽现在被证实为可以激发细胞免疫的CTL表位,对感染病毒的细胞起到杀伤作用。现有研究表明,激活细胞毒性T细胞必须有TCR与MHC I-多肽三分子复合物提供的抗原识别信号,此为该细胞被激活的第一信号。因而通过构建MHC I-表位多肽复合体来鉴定CTL表位多肽有很重要的意义。
目前国内外猪口蹄疫疫苗主要为灭活疫苗和合成肽疫苗2种。这2种疫苗均为体液免疫为主的防护疫苗,很难激发细胞免疫。尤其是新型的猪口蹄疫合成肽疫苗的研究主要集中于B细胞表位肽疫苗,即使T细胞表位研究也主要着眼于通用T-helper 表位[5]。而对SLA I分子递呈的CTL细胞表位的研究很少,更缺乏其CTL细胞表位合成肽疫苗的相关研究报道。本文前期通过大量猪群SLA I等位基因分析,并成功表达猪群中分布比较高的SLA-1(SLA-1*1301)等位基因,通过体外构建SLA I-β2m-表位多肽复合体的方法筛选出了4条可能的口蹄疫CTL表位,为开发口蹄疫CTL表位多肽疫苗提供科学依据,具有较好的开发前景。
