溶剂和外电场下N-羟乙酰神经氨酸的理论光谱研究
2020-05-15曾雪峰朱秋劲
常 瑞,曾雪峰,朱秋劲
(1.贵州省农畜产品贮藏与加工重点实验室,贵阳 550025;2.贵州大学 酿酒与食品工程学院,贵阳 550025)
1 引 言
非人源性的N-羟乙酰神经氨酸是燕窝酸(N-乙酰神经氨酸)的乙酰基羟化产物,主要存在于猪肉、牛肉等畜产原料中[1],流行病学研究表明其和结肠癌等癌症密切相关[2].目前对Neu5Gc常用的检测手段是液相色谱-荧光检测法和液相质谱法,但该类方法样品处理过程繁琐、衍生化过程干扰因素很大且不稳定[3].
分子特殊基团的振动信息可以产生特定的光谱指纹信息,从而实现复杂基质样品中目标物质的无损检测、分子结构变化分析.理论化学中的密度泛函理论是基于分子结构研究分子振动及光谱性质的重要工具,已经广泛用于环境、化工、食品领域风险物质的鉴定[4]、光谱拟合、光谱常数等研究[5].溶剂和外电场能影响分子的结构和光谱信息.食品加工中涉及多种不同极性和有机酸类溶剂环境,以及电刺激等物理外场[6].王莹等通过荧光光谱表征了高压脉冲电场处理抗氧化肽后其结构的变化,获得了最佳处理强度[7].为探究不同加工环境对Neu5Gc分子光谱性质的影响,运用密度泛函理论对Neu5Gc的分子光谱性质(红外,拉曼,紫外)进行研究,为检测和表征不同加工条件下的结构稳定性提供理论参考.
2 计算方法
溶剂化效应主要由分子间作用力主导,液体分子间的作用力包括静电作用、氢键、分子轨道相互作用.溶剂的偶极矩,诱导偶极矩,供体受体作用等都可以影响分子间作用力[8].
溶剂极性对吸收光谱也有一定影响,其过程可以通过线性溶解自由能方程表述[9]:
ν=ν0+sπ*+bβ+aα
其中,π*是溶剂极化率,β是溶剂氢键受体(HBA)碱度大小,α是溶剂氢键供体(HBD)酸度的标度,ν0是参比溶剂环己烷溶质性质的回归值.回归系数s,b和a表示溶剂参数对吸收频率的影响程度.
外电场作用下分子体系的哈密顿量H为H=H0+Hint,H0为无外电场下的哈密顿量,Hint为外电场与目标分子相互作用产生的哈密顿量.在偶极近似下,目标分子与外场F的相互作用能为Hint= -μF.μ为分子偶极矩,F为电场强度[10].其中,1 a.u.=5.14225×1011Vm-1.
Neu5Gc的分子结构取自Pubchem数据库.根据极性和介电常数选择不同溶剂(苯ε=2.27、乙酸ε=6.25、乙醇ε=24.85、甲酸ε=51.10、水ε=78.35),在笛卡尔坐标轴X正方向施加不同强度电场(0.005,0.01,0.015,0.02,0.025 a.u).几何优化采用M062X泛函,气相和溶剂下基组水平为6-311+G(d,p),使用SMD隐式溶剂模型,外电场下基组水平为6-311G(d,p).红外、拉曼光谱计算和优化水平一致,频率校正因子为0.944,紫外光谱采用含时密度泛函TD-DFT,理论水平为PBE1PBE/TZVP,考察激发态数目N=30.红外振动模式归属以气相下优化结构为基础进行PED势能分布分析,并结合振动动画进行光谱指认.为考察紫外最大吸收波长处激发过程,采用Multiwfn3.5[11]进行轨道跃迁分析.本文量化计算均在贵州大学云计算平台Gaussian16 (Revision A.03)上完成[12].
3 结果与讨论
3.1 结构优化
气相下对Neu5Gc几何优化得到无虚频的能量极小结构如图1所示,红色代表氧原子,白色代表氢原子,蓝色代表氮原子,黑色代表碳原子,标注出每个原子的NBO电荷值大小.
从结构图1可以看出,Neu5Gc分子主要由丙醇侧链、酰胺基团、羧基基团、吡喃环、以及醇羟基组成.NBO电荷分布显示氧原子主要分布负电荷,表明其是易于接受亲电试剂攻击的位点.与羧基和酰胺基相连的碳原子分布正电荷,因氮原子电负性小于氧原子,氮原子上电荷值(-0.681)小于氧原子(-0.568),表明其是易于接受亲核试剂攻击的位点.从图中还可看出,X轴正方向是沿着乙酰基团到羧基基团的方向.
3.2 不同溶剂下Neu5Gc红外光谱
溶剂(苯,乙酸,乙醇,甲酸,水)下Neu5Gc的理论红外光谱如图2所示.结合光谱数据可知,图2中左边第一个尖峰为O-H收缩峰,吸收波长在甲酸下最小为3545.18 cm-1,气相下为3599.86 cm-1.2000-1500 cm-1波数范围内三个强吸收峰依次为羧基振动,酰胺基振动,C-N收缩,吸收波长分别为苯相(1795.26,1653.88,1501.83 cm-1),乙酸(1737.91,1627.20,1496.49 cm-1),乙醇(1728.57,1619.20,1500.50 cm-1),甲酸(1715.23,1605.86,1500.50 cm-1),水(1719.23,1608.53,1508.50 cm-1).可知,随溶液极性增强吸收波长发生蓝移,甲酸和水相下波数较低.对1000 cm-1附近C-O收缩峰,气相下吸收波长为1120.37 cm-1,乙醇下C-O振动频率最高且波长最短1053.68 cm-1,表明溶剂条件下C-O强度小于气相.还可看出,随着介电常数的增加,溶剂下的振动吸收峰向短波长方向发生蓝移,这可能是由于羟基氧与溶剂分子产生分子间氢键,使得振动频率增加[13].由上可知,Neu5Gc在乙醇、甲酸、水相下结构稳定性较差,表明其在加工中易受到强极性和酸性溶剂影响,这和陈等检测到乳酸发酵制品中Neu5Gc的含量明显低于其他动物性食品的结果一致[14].
3.3 不同电场强度下的红外图
沿X轴方向施加不同强度(0,0.005,0.01,0.015,0.020,0.025 a.u.)的外电场,得到红外光谱图如图3所示.由图可知,由于电场对分子的极化作用,导致分子在电场下振动光谱发生变化.第一个O-H收缩峰在0.00-0.015 a.u.范围内吸收波长分别为3509.16,3381.12,3593.19,3582.52 cm-1,吸收峰产生了红移.当场强增加到0.01 a.u.时,第二个O-H收缩峰吸收强度迅速增强;在0.001-0.025范围内其吸收波长分别为3239.74,3113.03,3131.71,2815.60 cm-1,在0.025 a.u.时最小.表明电场对Neu5Gc的O-H键之间的相互作用具有明显的减弱作用,导致振动频率增加,吸收波长变短.这和何君博等对外电场作用下黄曲霉素B1红外光谱研究结论一致,吸收峰随场强度增大呈现先红移后蓝移[15].
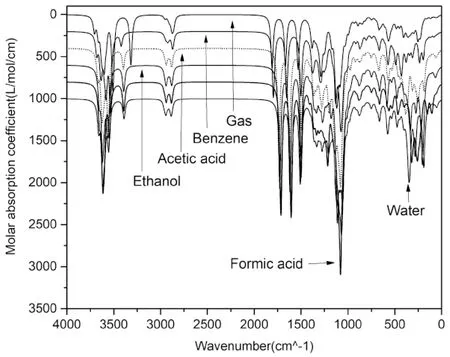
图2 不同溶剂下红外谱图Fig.2 IR spectra in different solvents
电场下2000-1500 cm-1范围内未观察到明显的C-N收缩吸收峰,而羧基摆动吸收峰波长随电场强度依次为:1817.93,1804.60,1799.26,1793.93,1775.25,1771.25 cm-1.酰胺基团摆动吸收峰波长依次为:1675.22,1675.22,1679.22,1664.55,1669.89,1645.88 cm-1,两种基团的吸收波长均发生一定的蓝移,表明其基团稳定性有一定增强.对于C-O收缩,无外电场时吸收波长为1085.69 cm-1,0.025a.u电场下减弱到最小为 1048.34 cm-1,发生一定蓝移,表明强电场下吡喃环结构之间作用力明显减弱,结构稳定性降低.
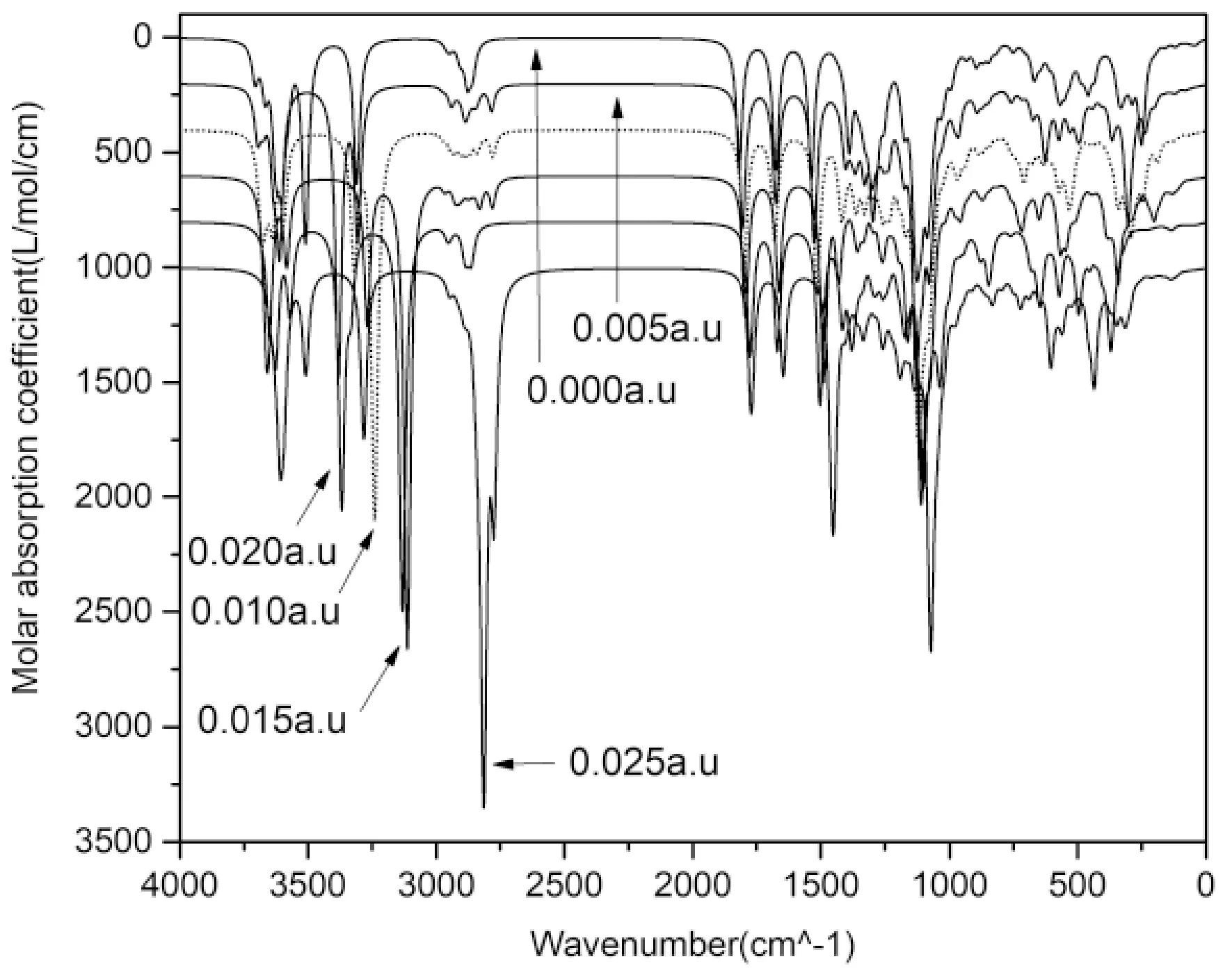
图3 不同外电场下红外谱图Fig.3 IR spectra under different external electric fields
3.4 红外振动模式归属
非线性分子红外振动模式为3N-6 种,Neu5Gc(C11H19NO10)有117种振动模式,在气相几何优化结果基础上进行振动模式势能分布(PED)分析,结果如表1所示.从表可以看出,在3706.22-3509.62 cm-1范围内主要是O-H收缩,2960.91-1159.72 cm-1波数范围内主要是C-H和CH2的收缩与摆动[16].其中羧基和酰胺基团振动分别为1808.71 cm-1和1665.88 cm-1.1136.53-508.19 cm-1和156.68-17.62 cm-1波数范围内主要是Neu5Gc环和支链的呼吸振动.581.20-223.72 cm-1范围内主要是羟基的摆动.(注:ν伸缩振动,γ面外弯曲振动,β面内弯曲振动,τ扭转振动,ω面外摇摆振动,r面内摇摆振动,anti sym表示不对称收缩,sym表示对称收缩).
3.5 不同溶剂下Neu5Gc拉曼光谱
不同溶剂下的拉曼光谱如图4所示.图4两个较强的拉曼吸收峰分别为C-H收缩峰和羧基O-H收缩峰.C-H收缩峰吸收波长和拉曼活性值在气相下分别为2859.87 cm-1(191.85),在溶液中随着介电常数增加,吸收波长产生红移,且极性中明显高于非极性条件.拉曼活性在甲酸下最大为511.60,苯相中最低为262.26,表明甲酸中稳定性较苯相下差.O-H收缩峰吸收波长和拉曼活性值在气相和溶剂下分别为:3619.26 cm-1(140.57),3582.91(179.80),3560.25(176.77),3556.43(182.02),3545.47(180.45),3553.83 cm-1(177.19),随着溶剂极性增加,吸收波长产生蓝移,拉曼活性则在质子性溶剂下变化不大.
表1 Neu5Gc 红外振动势能分布归属
Table 1 Neu5Gc IR vibration potential energy distribution attributions

模式校正后振动归属模式校正后振动归属1173706.22υOH(90)1163665.44υOH(81)1153633.28υOH(81)1143619.26υOH(86)1133599.81υOH(77)1123578.40υOH(82)1113509.62υOH(73)1103316.01υNH(64)1092960.91υCH2(55)antisym1082949.32υCH2(59)antisym1072911.58υCH(67)antisym1062908.11υCH2(57)sym1052900.30υCH(44)1042879.12υCH2(28)sym+υCH(36)1032877.86υCH(44)1022867.25υCH2(34)sym+υCH(29)1012861.23υCH2(63)sym1002859.87υCH(45)992858.41υCH(46)981808.71υC=O(59)971665.88υC=N(38)961530.65υCN(31)+βNH(24)951432.07βCH(70)941418.69βCH(77)931404.64βCH(64)921403.46βCH(33)+βCH2(12)911384.27βCH2(33)+βOH(16)901380.05βCH(40)891372.34βCH2(30)881354.27βCH(42)871345.44βCH2(19)+βCH(30)861332.52βCH(50)851327.27βCH(61)841314.85βCH(30)831297.89βCH(29)821294.99βCH(47)811288.31βOH(7)+βCH2(11)801274.89βCH(27)续表1模式校正后振动归属模式校正后振动归属

791272.94βCH(34)781253.57βCH(42)+βCH2(13)771243.74ωCH(21)+βCH(15)761241.21βCH(39)751227.49βCH2(23)+βOH(11)741207.10βCH(11)+τCH2(17)731199.49βCH(8)+ωCH(36)721190.31βCH2(47)711181.72βCH(8)+τCH2(29)701172.20τCH2(25)691159.72ωCH2(16)+βCH(25)681136.53υCOC(25)671128.16βCH(6)+υCCC(18)661122.16βOH(12)+υCO(15)651114.61υCC(10)+τCH2(15)641107.99υCO(18)631089.11βCH(7)+τCH2(22)621085.39υCC(19)+τCH2(14)611082.6βOH(10)+υCC(16)601070.67υCN(15)+υCC(23)591064.27υCO(27)+τCH2(12)581053.82rCH2(63)571033.71υCC(16)561025.37υCC(12)551015.57υCC(24)54991.92τCC(14)53977.30τCH2(23)52970.06τCH2(11)51932.55υCC(22)50893.91υCC(14)49864.13υCCO(8)+τCH2(39)48844.41τCC(27)47815.10τCH2(49)46749.00ωO=C-O(53)45704.1ωCH2(39)44668.21βO-C=O(12)43653.12υCCC(18)+γNH(12)42641.92ωNH(53)41609.02τCH2(15)续表1模式校正后振动归属模式校正后振动归属

40581.20γOH(14)39566.72γOH(10)38553.22τCH2(16)+ωNH(24)37532.55γOH(33)36511.14γOH(18)35508.19τCO(45)34483.41γOH(31)33465.74τCH2(20)32449.75γOH(17)31408.71γOH(27)30400.38γOH(27)29390.50γOH(7)+τCH2(15)28374.72γOH(29)27368.21γOH(17)26360.46γOH(31)25348.64γOH(27)24335.16γOH(32)23321.44γOH(15)22308.56ωOH(20)21294.74ωOH(23)20285.28ωOH(17)19264.64ωOH(10)18254.36ωOH(62)17234.14ωOH(37)16223.72ωOH(49)15204.44βC=O=N(19)14197.37ωOH(10)13156.68τCCC(17)12138.01τCCC(15)11119.12τCH2(41)10117.99τCCC(32)9110.83τCCC(47)888.86τC=N(24)767.27τCCC(45)666.05τCCC(28)561.05ωCH2(31)446.34ωO-C=O(22)+τCCC(31)342.97ωO-C=O(18)+τCCC(30)234.25τCC(37)117.62τCC(39)+τCN(10)

图4 溶剂下拉曼谱Fig.4 Raman spectra in solvents
3.6 不同电场强度下Neu5Gc拉曼光谱
不同电场强度下的拉曼图如图5所示,图5两个强吸收峰和溶剂下相同.对C-H收缩峰,其吸收波长和拉曼活性在无电场下分别为2859.01 cm-1(138.84),随着电场强度增加,吸收波长先蓝移后红移,拉曼活性逐渐增加,0.02 a.u.时吸收波长最大(2852.02 cm-1),0.025 a.u.时拉曼活性最大(160.15),表明电场使得C-H键强度减弱.这和Masunov等对甲烷电场下计算结论一致[17].O-H收缩峰吸收波长和拉曼活性在电场下分别为3638.96(140.55),3650.88(129.27),3656.60(151.99),3657.36(133.02),3655.7(116.43),波长发生一定红移,在0.02 a.u.下波长最长,拉曼活性值在0.015 a.u.时最大,表明O-H键在0.015 a.u.电场下强度最低.
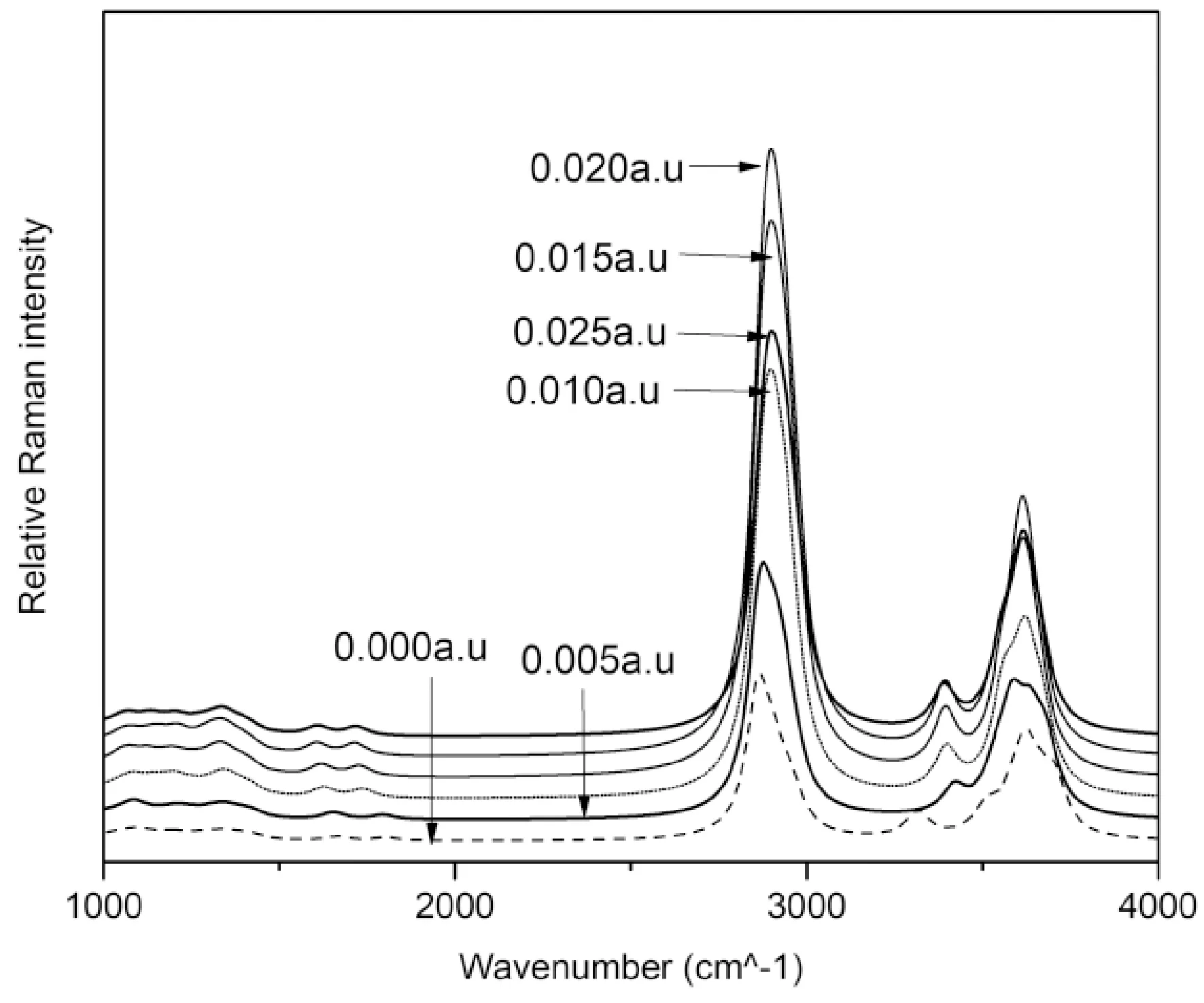
图5 外电场下拉曼谱Fig.5 Raman spectra under external electric fields
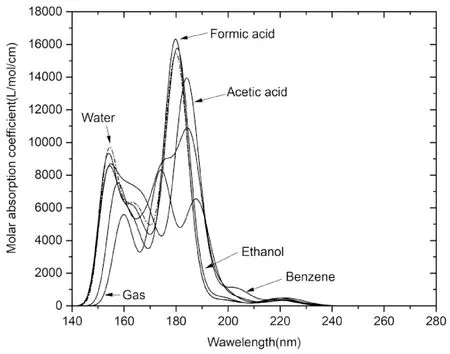
图6 不同溶剂下紫外光谱Fig.6 UV spectra in different solvents
3.7 不同溶剂下Neu5Gc紫外光谱
分子轨道能级的变化受到溶剂的极性影响,因此不同环境下σ→σ* ,π →π* ,n→σ*,n→π* 等的跃迁所需要的能量不同,使紫外吸收有差异.5种溶剂下紫外理论光谱如图6所示.最大吸收峰处激发过程分析结果如表2所示.从图6可以看出,溶剂下紫外吸收系数均明显大于气相,且随着介电常数增大而增大.极性溶剂乙酸下的最大吸收波长比非极性苯相下轻微红移.这和Popoola等对2-甲基吲哚紫外吸收在非极性溶剂下比极性条件下红移是一致的[18].乙酸条件下有最大吸收波长183.26 nm,已知实验值为210 nm[19],表明模拟的紫外光谱产生了一定蓝移.
由表2可以看出,溶剂介电常数增加,振子强度和激发能逐步增加,激发波长逐步下降.最大振子强度在水、甲酸、乙醇下大于非极性条件,表明极性条件下Neu5Gc容易激发.气相下跃迁主要由HOMO-1到LUMO+1贡献,在水相下则主要由HOMO-1到LUMO+6贡献,表明基态和激发态的能级差减少,向更高的能级激发.这和Bakhouche等对生育酚不同溶剂下吸收光谱激发参数变化一致[20].乙酸条件下轨道跃迁分析结果如图7所示,可以看出电子从HOMO轨道激发到LUMO+1时,羧基上的电子转移到了Neu5Gc的酰胺基团上,该过程的贡献值为84.53%,能级差为 7.567 eV,激发类型是σ→σ*.
3.8 不同外电场下Neu5Gc紫外光谱
不同电场强度下的理论紫外光谱如图8所示,最大吸收峰处的激发过程分析结果如表3所示.从图8可以看出,吸收波长比无外电场时产生了一定的红移,且在0.025 a.u.时红移最大.吴学科等对MMTD在外电场下电子光谱分析发现其最大吸收波长也发生红移[21].徐国亮等对外场作用下蒽分子的紫外激发分析也表明,外电场使得紫外光谱产生红移[22].值得注意的是,在0.02 a.u.时具有最大吸收峰,表明该电场强度下,跃迁能级差较小.从表3可知,激发波长、振子强度随电场明显增加,呈现出斯塔克效应.外电场下紫外激发轨道跃迁主要由HOMO-2,HOMO-4到LUMO+1,LUMO贡献,这是由于外电场下分子受到明显的电场诱导偶极效应和电荷转移影响,跃迁能级差比溶剂下的更低.场强为0.025 a.u.时,振子强度最大,吸收波长最大189.63 nm,对其跃迁轨道分析如图9所示,可以看出HOMO-4,HOMO-1轨道上电子激发到LUMO+1时,羧基上的电子转移到了Neu5Gc的酰胺基团上,贡献值分别为22.99%,51.20%,能级差分别为7.964 eV,7.207 eV,该激发类型是σ→σ*.由此可以看出,随着电场强度增加,其对分子诱导偶极矩的影响越来越大,相比较于极性较强的乙酸环境下的跃迁能级差最大可降低0.34 eV,表明强诱导偶极、极化效应发生环境的存在可降低Neu5Gc分子基态到激发态的能垒,使其反应活性增加,稳定性降低[23].
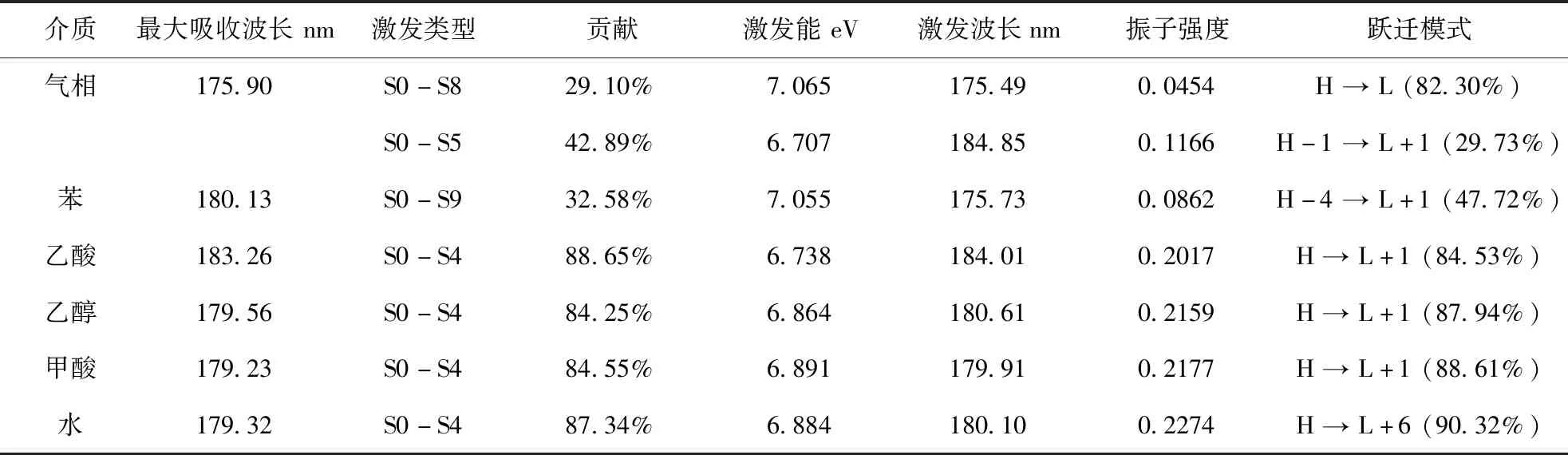
表2 不同溶剂下Neu5Gc紫外激发过程Table 2 Neu5Gc UV excitation processes in different solvents
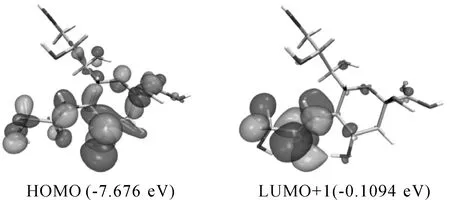
图7 乙酸下轨道跃迁Fig.7 Orbital transition under acetic acid

图8 不同外电场下紫外光谱Fig.8 UV spectra under different external electric fields
4 结 论
通过密度泛函理论对红肉致癌因子Neu5Gc在不同环境下分子光谱进行研究.主要结论如下,(一)气相下117种红外振动模式归属分析得到O-H、C-H和CH2的收缩和摇摆振动、O=C=O和O-C=N振动和摇摆构成了Neu5Gc主体振动模式.随着溶剂介电常数的增加,Neu5Gc红外振动峰向短波长方向发生一定的蓝移,振动频率增加,表明溶剂下Neu5Gc分子稳定性减弱.(二)在0.001-0.025 a.u 电场范围内振动谱峰蓝移,羧基振动、酰胺基振动强度均明显减弱.C-H收缩和羧基O-H收缩振动拉曼强度较大,其中C-H收缩在溶剂条件下发生红移,电场下发生蓝移;而O-H收缩峰在溶剂下发生蓝移,电场下则发生红移,表明电场下O-H之间相互作用减弱.(三)随着溶剂极性增加,Neu5Gc振子强度和激发能逐步增加,激发波长逐步下降.溶液相最大吸收波长为乙酸下183.26 nm处,其跃迁模式为HOMO到LUMO+1激发,能级差为 7.567 eV.电场下0.025 a.u.时具有最大吸收波长189.63 nm,跃迁模式为HOMO-4,HOMO-1到LUMO+1激发,能级差分别为7.964 eV,7.207 eV.以上结论表明,Neu5Gc在不同加工环境下的分子光谱可以一定程度上反映其结构稳定性和能级跃迁变化,这为探究不同加工环境对食品中危害因子的影响和解离提供了一定的参考.
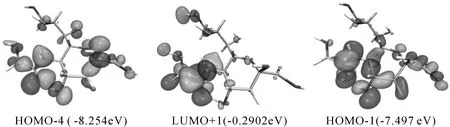
图9 电场0.025 a.u下轨道跃迁Fig.9 Orbital transition of electric field 0.025 a.u
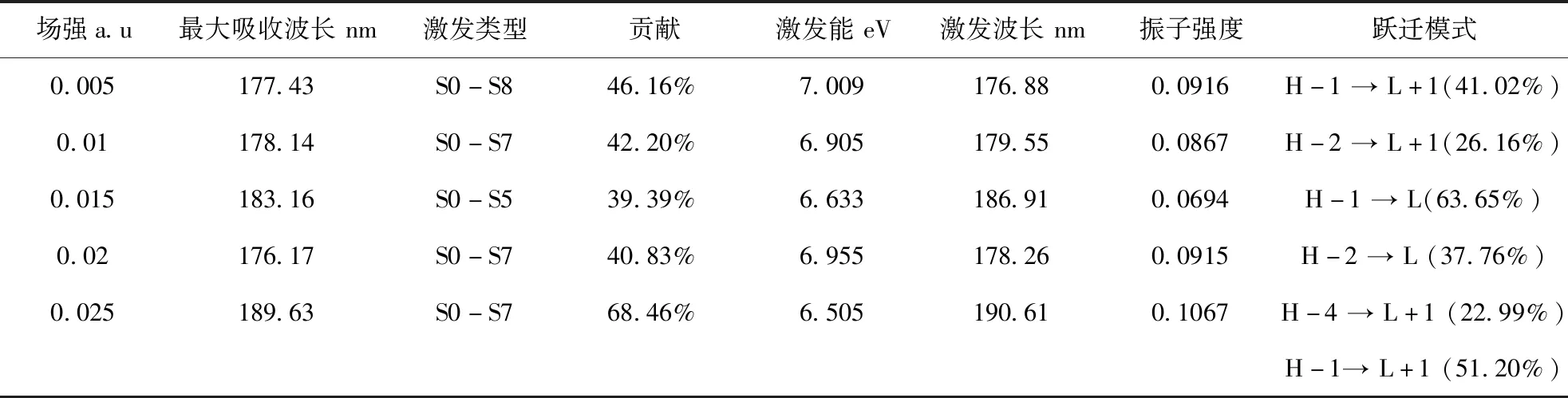
表3 不同外电场下Neu5Gc紫外激发过程Table 3 Neu5Gc UV excitation processes under different external electric fields
