胰高血糖素样肽-1对高糖条件下肾小球血管内皮细胞损伤的调节作用及机制研究
2020-05-15黄强韩强
黄强 韩强
糖尿病肾病(diabetic nephropathy,DN)是糖尿病患者常见的微血管并发症、也是导致终末期肾脏病的主要病因。近年来,我国糖尿病的发生率逐年升高且糖尿病患者的血糖控制达标率较低,这也直接导致了DN发患者数的增加[1,2]。DN的发病机制复杂,其中高糖环境下肾小球系膜细胞增生、内皮细胞损害、细胞外基质增厚及重塑是公认的与DN发生直接相关的病理环节,针对以上病理环节进行干预也是DN治疗的潜在靶点。胰高血糖素样肽-1(glucagon like peptide-1,GLP-1)是由空肠和回肠L细胞分泌的小分子多肽,能够以葡萄糖依赖性的方式刺激胰岛素分泌并起到降糖作用。新近的多项细胞实验研究证实,GLP-1对高糖、过氧化氢、缺氧等病理因素引起的内皮细胞损伤具有保护作用[3-5],也有动物实验证实GLP-1对糖尿病大鼠的肾功能具有改善作用,但GLP-1是否能够减轻高糖环境下肾小球内皮细胞的损伤尚未明确。为此,本研究选择人源肾小球微血管内皮细胞(HRGEC)作为实验对象,具体分析了GLP-1对高糖条件下HRGEC损伤的调节作用及机制。
1 材料与方法
1.1 材料
1.1.1 实验试剂:HRGEC细胞购自ATCC公司,DMEM培养基、胎牛血清(FBS)、青霉素、链霉素、胰蛋白酶均购自Gibco公司,GLP-1购自Sigma公司,TUNEL染色试剂盒、一氧化氮(NO)检测试剂盒购自上海碧云天公司,丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH)检测试剂盒购自南京建成研究所,培养细胞/细菌总RNA提取试剂盒、FastKing一步法除基因组cDNA第一链合成预混试剂、Talent荧光定量检测试剂盒购自北京天根公司。
1.1.2 实验仪器:细胞培养箱、高速离心机购自Thermo公司,荧光显微镜购自Nikon公司,荧光定量PCR仪购自Bio-rad公司。
1.2 实验方法
1.2.1 细胞培养及分组干预方法:HRGEC细胞用含有10%FBS、1%青霉素、1%链霉素的DMEM培养,细胞融合至80%后用0.25%胰蛋白酶进行消化传代。传代后得到足够数量的对数生长期HRGEC细胞,进行分组处理,具体如下:①对照组用含有5.5 mol/L葡萄糖的DMEM处理;②高糖组:用含有30 mmol/L葡萄糖的DMEM处理;③GLP-1组:用含有30 mmol/L葡萄糖及30 nmol/L GLP-1的DMEM处理。
1.2.2 细胞凋亡率的检测方法:不同条件处理后24 h,用4%多聚甲醛固定细胞过夜后采用TUNEL试剂盒中的TUNEL染色液和DAPI染色液对细胞进行染色,在显微镜下观察TUNEL阳性染色细胞数目及DAPI阳性染色细胞数目后计算凋亡率。
1.2.3 细胞中基因mRNA表达的检测方法:不同条件处理后24 h,收集细胞后采用北京天根公司的试剂盒分离细胞中的总RNA,以RNA为模板反转录合成cDNA,取cDNA 1 μl、5 μmol/L的上游引物溶液及下游引物溶液各0.5 μl、Talent荧光定量检测试剂盒中的反应液10 μl及去离子水8 μl,混匀后在PCR仪中进行荧光定量PCR反应,根据荧光曲线并以β-actin为内参计算FasL、Fas、Bax、Bcl-2、Caspase-3、SIRT1、eNOS、NOX4的mRNA表达水平。
1.2.4 培养基中氧化应激指标及NO的检测方法:不同条件处理后24 h,收集细胞培养基后采用南京建成研究所的试剂盒测定MDA、SOD、GSH的含量,采用上海碧云天的试剂盒测定NO含量。
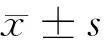
2 结果
2.1 3组间细胞凋亡率的比较 对照组、高糖组和GLP-1组的细胞凋亡率分别为(6.23±0.94)%、(26.62±5.28)%、(11.75±2.03)%。高糖组的细胞凋亡率明显高于对照组,GLP-1组的细胞凋亡率明显低于高糖组,差异均有统计学意义(P<0.05)。见图1。
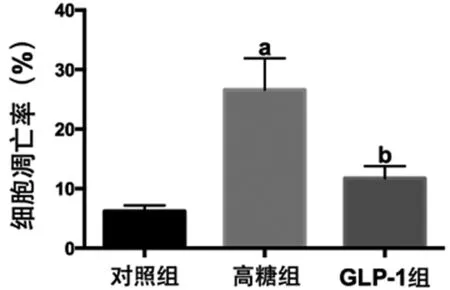
图1 3组间细胞凋亡率的比较;与对照组比较,aP<0.05;与高糖组比较,bP<0.05
2.2 3组间凋亡基因表达比较 高糖组细胞中FasL、Fas、Bax、Caspase-3的mRNA表达水平明显高于对照组(P<0.05),Bcl-2的mRNA表达水平明显低于对照组(P<0.05);GLP-1组细胞中FasL、Fas、Bax、Caspase-3的mRNA表达水平明显低于高糖组(P<0.05),Bcl-2的mRNA表达水平明显高于高糖组(P<0.05)。见表1。
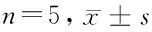

组别FasL/β-actinFas/β-actinBax/β-actinBcl-2/β-actinCaspase-3/β-actin对照组 1.02±0.161.04±0.180.97±0.131.01±0.150.99±0.12高糖组 1.89±0.28*2.05±0.37*2.18±0.41*0.51±0.09*1.78±0.26*GLP-1组1.44±0.22#1.55±0.21#1.61±0.29#0.78±0.12#1.38±0.19#
注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05
2.3 3组间氧化应激指标的比较 高糖组细胞培养基中MDA的含量明显高于对照组(P<0.05),SOD、GSH的含量明显低于对照组(P<0.05);GLP-1组细胞培养基中MDA的含量明显低于高糖组(P<0.05),SOD、GSH的含量明显高于高糖组;组间差异有统计学意义(P<0.05)。见表2。
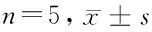
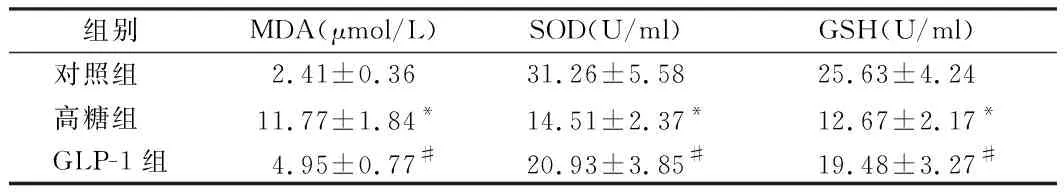
组别MDA(μmol/L)SOD(U/ml)GSH(U/ml)对照组 2.41±0.3631.26±5.5825.63±4.24高糖组 11.77±1.84*14.51±2.37*12.67±2.17*GLP-1组4.95±0.77#20.93±3.85#19.48±3.27#
注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05
2.4 3组间SIRT1信号通路比较 高糖组细胞中SIRT1、eNOS的mRNA表达水平及细胞培养基中NO的含量明显低于对照组(P<0.05),细胞中NOX4的mRNA表达水平明显高于对照组(P<0.05);GLP-1组细胞中SIRT1、eNOS的mRNA表达水平及细胞培养基中NO的含量明显高于高糖组(P<0.05),细胞中NOX4的mRNA表达水平明显低于高糖组(P<0.05)。见表3。
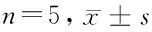

组别SIRT1/β-actineNOS/β-actinNO(μmol/L)NOX4/β-actin对照组 1.03±0.171.01±0.158.48±1.211.05±0.17高糖组 0.44±0.09*0.53±0.09*3.44±0.61*2.19±0.36*GLP-1组0.76±0.12#0.82±0.12#6.86±0.94#1.44±0.20#
注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05
3 讨论
肾小球血管内皮细胞在高糖环境下发生损伤是DN发病的重要病理环节,针对高糖诱导的肾小球血管内皮细胞损伤进行干预是治疗DN的有效靶点[6,7]。GLP-1是一类新型的降糖药物,通过葡萄糖依赖性的方式刺激胰岛素分泌来起到降糖作用;新近也有研究表明,GLP-1对血管内皮细胞具有保护作用,能够减轻高糖、过氧化氢、缺氧等病理因素引起的内皮细胞损伤。但是,GLP-1对高糖引起的肾小球血管内皮细胞损害是否具有保护作用并未阐明。本研究以HRGEC细胞作为实验对象,用高糖培养基处理后观察到:高糖组的细胞凋亡率明显高于对照组,提示HRGEC细胞在高糖环境下发生了过度凋亡;在高糖诱导HRGEC细胞凋亡的基础上联合使用GLP-1进行干预后观察到:GLP-1组的细胞凋亡率明显低于高糖组,表明GLP-1对高糖诱导的HRGEC细胞凋亡具有显著抑制作用,进而也表明GLP-1对HRGEC具有保护作用。
死亡受体凋亡途径和线粒体凋亡途径是内皮细胞发生凋亡的两种不同机制,前者受到Fas/FasL的调控、后者受到Bcl-2/Bax的调控。FasL与Fas结合后通过细胞内的FADD结构域来招募Caspase-8,促进Caspase-8及下游信号发生级联激活,最终引起Caspase-3活化[8,9];Bcl-2和Bax通过调节线粒体内细胞色素C的释放来影响Caspase-9的激活,前者阻碍Caspase-9激活、后者促进Caspase-9激活,进而改变下游信号的级联激活及Caspase-3的活化。两种不同机制均最终引起Caspase-3的活化并启动细胞凋亡[10,11]。本研究对HRGEC细胞中以上凋亡基因表达的分析显示:高糖组细胞中FasL、Fas、Bax、Caspase-3的mRNA表达水平明显高于对照组,Bcl-2的mRNA表达水平明显低于对照组,提示高糖能够使HRGEC细胞的死亡受体凋亡途径和线粒体凋亡途径均发生过度活化。在使用GLP-1干预后观察到:GLP-1组细胞中FasL、Fas、Bax、Caspase-3的mRNA表达水平明显低于高糖组,Bcl-2的mRNA表达水平明显高于高糖组,表明GLP-1对高糖诱导的死亡受体凋亡途径和线粒体凋亡途径激活具有抑制作用。
高糖环境除了能够通过促进细胞凋亡来引起内皮细胞损伤外,还能通过增加氧自由基的生成来引起内皮细胞发生氧化应激损伤。氧自由基具有极强的氧化性,能够与内皮细胞膜结构中的多种成分发生氧化反应并造成膜结构的破坏,细胞膜的破坏会造成细胞结构损害、线粒体膜及内质网膜的破坏会造成细胞功能损害[12]。细胞膜及细胞器膜中含有丰富脂质,与氧自由基发生氧化反应后生成MDA;细胞本身含有SOD、GSH等抗氧化物,在催化氧自由基发生发生还原反应的过程中大量消耗[13,14]。本研究对HRGEC细胞培养基中上述氧化应激产物的分析显示:高糖组细胞培养基中MDA的含量明显高于对照组,SOD、GSH的含量明显低于对照组,提示高糖能够引起HRGEC细胞中氧化应激反应的过度激活。在使用GLP-1干预后观察到:GLP-1组细胞培养基中MDA的含量明显低于高糖组,SOD、GSH的含量明显高于高糖组,表明GLP-1对高糖诱导的氧化应激具有抑制作用。
内皮细胞凋亡及氧化应激的调控与细胞内多条信号通路有关,其中SIRT1通路既能通过调节eNOS的表达及NO的生成来发挥抗凋亡作用,也能通过抑制NOX4的表达来起到抗氧化应激作用。eNOS是特异性表达于内皮细胞的NOS分子,在催化精氨酸代谢的过程中产生NO并通过NO 的活性来保护内皮、抑制凋亡[15,16];NOX4是内皮细胞中催化活性氧产生的NOX家族分子,SIRT1通过抑制NOX4的表达、减少活性氧的产生来抑制内皮的氧化应激损伤[17,18]。本研究对HRGEC细胞培养基中上述SIRT1通路的分析显示:高糖组细胞中SIRT1、eNOS的mRNA表达水平及细胞培养基中NO的含量明显低于对照组,细胞中NOX4的mRNA表达水平明显高于对照组;而GLP-1干预后GLP-1组细胞中SIRT1、eNOS的mRNA表达水平及细胞培养基中NO的含量明显高于高糖组,细胞中NOX4的mRNA表达水平明显低于高糖组。这一结果表明GLP-1能促进高糖条件下HRGEC细胞中SIRT1通路的激活,这也可能是GLP-1发挥抗凋亡及抗氧化应激的分子机制。
综上所述,GLP-1能够减轻高糖条件下HRGEC的凋亡及氧化应激,同时也能促进SIRT1信号通路的激活;激活SIRT1信号通路可能是GLP-1发挥抗凋亡及抗氧化应激的分子机制。
