阿司匹林对脑缺血损伤大鼠JAK/STAT信号通路的影响
2020-05-15孙永孙辉姚凯华李志锋李永文
孙永 孙辉 姚凯华 李志锋 李永文
缺血性脑血管病因其具有高发病率、高致残率、高死亡率和高复发率等特点对人类的生命和健康威胁甚大,已成为危害人类生命的第三大杀手[1]。脑缺血性损伤是缺血性脑血管病中重要的病理生理过程[2]。阿司匹林是临床最常用的具有解热镇痛的非甾体类抗炎药物;研究表明阿司匹林可增强脑部血流循环,防止因脑缺血造成脑梗死的发生[3]。另有研究表明,阿司匹林还可改善缺血部位的能量代谢,参与抑制神经细胞的凋亡过程[4]。近年来,研究发现JAK/STAT信号转导通路与脑缺血有密切关联,是调节脑缺血后肿瘤坏死因子-α、白介素等造成脑缺血后细胞损伤的细胞因子反应的关键通路[5]。JAK2/STAT3通路的激活可能介导缺血脑损伤神经元的凋亡过程。阿司匹林对脑缺血损伤大鼠JAK/STAT信号通路的影响笔者所见鲜有报道。因此本实验通过建立大鼠局灶性脑缺血性损伤模型,研究大鼠局灶性脑缺血性损伤后以及不同浓度阿司匹林干预后JAK2、磷酸化 JAK2(pJAK2)、STAT3、磷酸化 STAT3 (pSTAT3)蛋白水平表达变化及神经细胞凋亡的情况,旨在探讨阿司匹林对脑缺血性损伤大鼠JAK/STAT信号通路的影响。
1 材料与方法
1.1 实验材料 12~15周龄的无特定病原体(specific pathogen free,SPF)级健康SD雄性大鼠100只(合格证号:SCXK京2006-0009),体重200~220 g,购自北京维通利华实验动物技术有限公司;阿司匹林购自上海先声药业有限公司;JAK2、pJAK2、STAT3、pSTAT3 多克隆抗体均来自美国 Bioworld 公司;辣根过氧化物酶(HRP)标记的山羊抗兔/兔抗小鼠IgG购自美国 Sigma公司,小鼠抗大鼠 β-actin抗体、TUNEL法细胞凋亡检测试剂盒 、DAB显色试剂盒购自赛默飞世尔科技(中国)有限公司;磁共振扫描仪购自德国西门子公司;凝胶成像仪购自美国Bio-Rad公司;BXM-950光学显微镜购自上海炳宇光学仪器有限公司;CM1850石蜡切片机购自北京德泉兴业商贸有限公司;蛋白印迹设备购自美国Bio Rad公司。
1.2 模型构建与分组处理 将80只大鼠进行编号,随机分为4组,每组20只,分别为假手术组、模型组、阿司匹林低剂量组(10 mg/kg)、阿司匹林高剂量组(50 mg/kg)。模型构建:大鼠麻醉后,取0.285 mm直径的尼龙线,参照文献[6],用丝线将颈外动脉和颈总动脉结扎,将准备好的尼龙绳沿颈总动脉插入右侧颈内动脉后,松开血管夹,推进线栓约 9 mm 左右阻塞同侧的大脑中动脉;在右侧颈总动脉切口上方固定线栓,完成大鼠大脑中动脉阻塞(MCAO)造模。假手术组不做血管结扎或阻塞,其余操作同模型组。4组大鼠灌注术后第1天开始腹腔注射给予相应药物,每天1次,连续给药7 d,假手术组和模型组腹腔给予等量无菌0.9%氯化钠溶液。见图1。
1.3 神经功能缺损程度(mNNS)评分 第7天给药30 min后,参考文献[6]采用改良的mNNS评分方法,将大鼠行为分为7个等级,评分标准:0分:大鼠爬行正常,没有不对称活动;1分:大鼠尾部垂直提起时前肢或后肢弯曲;2分:大鼠在1分的基础上伴有不能直线行走;3分:大鼠爬行时向左侧转圈;4分:大鼠自由活动时向左侧倾倒;5分:大鼠在4分的基础上出现左前爪后拖;6分:大鼠肢体完全不能支撑身体,无法自发爬行。

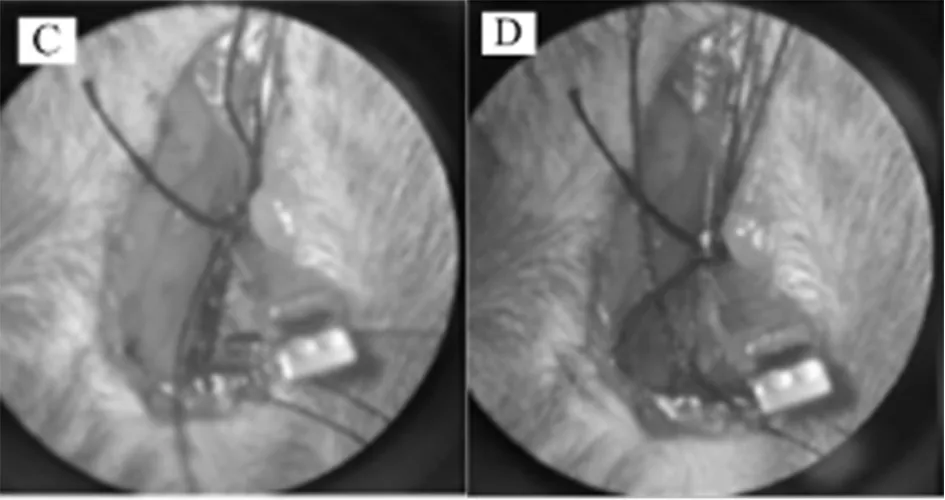

图1 线栓法制备MCAO手术过程;A:仔细分离颈总动脉、颈外动脉和颈内动脉;B:结扎颈总动脉和颈外动脉;C:夹住颈内动脉;D:后切开颈总动脉,从颈总动脉插入螺纹,然后松开动脉夹,将线插入颈内动脉;E:固定线;F:缝合皮肤
1.4 磁共振(MRI)法测量脑梗死体积 大鼠经神经功能缺损程度评分结束后,使用磁共振扫描仪检测脑梗死体积,大鼠取仰卧位,找到标准轴位后,在横断面T2-加权成像的基础上进行冠状面3层扫描,层厚度1.5 mm,间距0.2 mm。T2-加权成像检测大鼠脑梗死体积,梗死区域为苍白色,正常脑组织区域为灰色。利用Image J分析软件计算脑梗死体积(%)=(梗死区体积/全脑组织体积)×100%。
1.5 TUNEL 法检测细胞凋亡 取大鼠梗死部位脑组织,放入 4%多聚甲醛中固定24 h,石蜡常规包埋并在组织切片机上做连续6 μm 切片按试剂盒步骤进行TUNEL染色。主要步骤为切片脱蜡水化后, 蛋白酶 K(10 mmol/L)处理20 min,PBS 清洗5 min×3次,将载玻片浸入TUNEL反应混合物在37℃下避光温育60 min,PBS清洗5 min×3 次;在 37℃ 下,用POD反应液避光温育30 min;PBS 清洗 5 min×3 次;滴加 DAB 底物溶液显色,室温孵育10 min,乙醇梯度脱水,二甲苯透明,中性树脂封片,光镜下观察神经元凋亡情况。以显示蓝色的核染色为正常细胞,细胞核中有棕黄色颗粒为阳性细胞(凋亡细胞)。凋亡神经元所占百分比(凋亡率):每只大鼠取 4 张切片,每张切片在200 倍视野下随机选取 3 个不重叠视野,每个视野计数阳性细胞占总细胞的比例,取平均值。
1.6 Western Blot检测JAK2、pJAK2、STAT3、pSTAT3 取新鲜梗死部位脑组织加入RIPA组织裂解液中匀浆器打碎,冰浴5 min后离心,离心条件:13 000 r/min,4℃,时间10 min,获得上清,BCA蛋白定量试剂盒进行上清中蛋白浓度的定量检测,用2×电泳缓冲液稀释蛋白至相同浓度。10%的聚丙烯酰胺凝胶电泳 (SDS-PAGE)分离蛋白,用Tris/甘氨酸缓冲液将蛋白转移至PVDF膜上,5%TBST液中室温封闭2 h,将PVDF膜放入相应一抗稀释液(均为1∶1 000)中孵育,4℃过夜。次日,将膜取出,TBST液洗涤10 min,加入辣根过氧化物酶标记的山羊抗兔IgG二抗稀释液(均为1∶10 000),室温孵育2 h,加入DAB发光液,凝胶成像仪下读取读取灰度值,以GAPDH作为内参,计算目的蛋白相对表达水平。
2 结果
2.1 神经功能学评分 假手术组大鼠评分为0,即无明显神经功能萎缩现象;其他组都存在不同程度的神经功能缺损,还出现了精神萎靡、反应迟钝和进食减少等状况。与假手术组相比,模型组大鼠神经功能损伤评分明显升高,差异有统计学意义(P<0.05),与模型组相比,阿司匹林高、低剂量组神经功能损伤评分出现明显下降,差异均有统计学意义(P<0.05),阿司匹林高剂量组效果更为明显,与低剂量组相比差异有统计学意义(P<0.05)。见表1。

表1 阿司匹林对大鼠症状学评分的影响 n=20,分,
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与阿司匹林低剂量组比较,△P<0.05
2.2 阿司匹林对MCAO大鼠脑梗死体积的影响 假手术组大鼠两侧脑组织未发现梗死区域,与假手术组相比,模型组脑梗死体积明显增大(P<0.05);与模型组相比,阿司匹林高、低剂量组脑梗死体积明显下降,差异均有统计学意义(P<0.05),阿司匹林高剂量组效果更为明显,与低剂量组比较差异有统计学意义(P<0.05)。见表2,图2。


组别脑梗死体积假手术组 0.00模型组 53.51±4.31*阿司匹林低剂量组36.81±3.21#阿司匹林高剂量组25.12±3.10#△
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与阿司匹林低剂量组比较,△P<0.05
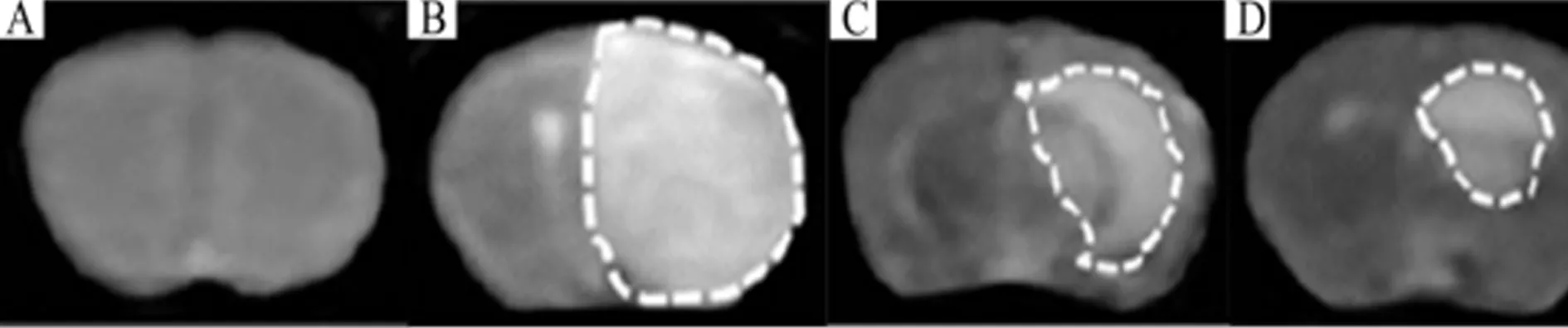
图2 阿司匹林对MCAO大鼠脑梗死体积的影响;A假手术组;B模型组;C阿司匹林低剂量组;D阿司匹林高剂量组
2.3 阿司匹林对MCAO大鼠脑内神经细胞凋亡的影响 假手术组大鼠中出现少量凋亡细胞;与假手术组相比,缺血性模型组于术后24 h可见大量凋亡细胞,差异有统计学意义(P<0.05),阿司匹林治疗后,与模型组相比,阿司匹林高、低剂量组凋亡细胞数明显下降,差异均有统计学意义(P< 0.05),阿司匹林高剂量组效果更为明显,与低剂量组相比差异有统计学意义(P< 0.05)。见图3,表3。
2.4 阿司匹林对MCAO大鼠JAK2、pJAK2、STAT3、pSTAT3蛋白表达的影响 为了进一步观察阿司匹林对大鼠缺血脑梗死的作用机制,本研究采用蛋白免疫印迹法检测了缺血区脑组织中JAK2、pJAK2、STAT3、

图3 阿司匹林对MCAO大鼠神经细胞凋亡的影响;A假手术组;B模型组;C阿司匹林低剂量组;D阿司匹林高剂量组


组别凋亡率假手术组 10.23±2.19模型组 46.24±3.24*阿司匹林低剂量组35.67±3.02#阿司匹林高剂量组24.78±3.22#△
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与阿司匹林低剂量组比较,△P<0.05
pSTAT3蛋白表达,结果显示与假手术组相比,模型组中pJAK2、pSTAT3表达水平明明显升高(P<0.05);阿司匹林治疗后,与模型组相比,阿司匹林高、低剂量组pJAK2、pSTAT3表达水平明显下降,差异均有统计学意义(P< 0.05),阿司匹林高剂量组下降更为明显,与低剂量组相比差异有统计学意义(P< 0.05)。见图4,表4。

图4 阿司匹林对MCAO大鼠JAK2、pJAK2、STAT3、pSTAT3蛋白表达的影响

组别JAK2pJAK2STAT3pSTAT3假手术组 0.41±0.050.11±0.024.49±0.136.15±0.15模型组 0.38±0.040.58±0.07*4.46±0.0415.21±0.12*阿司匹林低剂量组0.42±0.050.39±0.06#4.48±0.1112.35±0.26#阿司匹林高剂量组0.41±0.060.14±0.03#△4.51±0.118.71±0.22#△
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与阿司匹林低剂量组比较,△P<0.05
3 讨论
大脑供血的动脉发生狭窄或阻断时,会导致脑组织因供血供氧不足出现局部缺血甚至坏死,大脑功能受到损害,对机体的生理活动产生严重不良影响[7]。缺血性脑梗死与心血管疾病和恶性肿瘤并列成为对人类生命构成极大威胁的致死性疾病[8]。
阿司匹林的神经保护机制与改善脑组织的能量代谢、减少自由基生成、抑制兴奋性氨基酸的神经毒性有关,临床研究发现阿司匹林可显著降低心肌梗死及脑卒中的发病率[9]。本研究给予MCAO大鼠不同浓度阿司匹林治疗后,与模型组相比,脑梗死体积明显缩小,神经功能损伤程度明显减轻,同时抑制了神经细胞凋亡的数量,大鼠局部脑缺血损伤得到缓解,该结果与既往实验结果[10]一致,再次证实了药物的治疗效果。
JAK/STAT信号通路将来自细胞外的化学信号传递给细胞核,导致与免疫、增殖、分化和凋亡等相关的基因的DNA转录和表达[11]。在JAK/STAT信号通路中,细胞外信号与细胞膜上的细胞因子受体结合后活化JAK催化受体发生酪氨酸磷酸化形成pJAK,pJAK与细胞膜上的受体相偶联后发生酪氨酸磷酸化,STAT蛋白与受体结合,在pJAK的催化下发生磷酸化形成pSTAT[12]。pSTAT与受体亲和力较低,因此pSTAT与受体分离,形成二聚体的活性形式转移到细胞核内,并结合到启动子上诱导相应基因表达,完成信号传导过程,可直接影响相关基因的表达,进而改变靶细胞的增殖或分化状态[13]。JAK2/STAT3是JAK/STAT信号通路的一种,已有研究表明脑缺血性脑损伤会释放大量的炎性细胞因子如IL-2、IL-6可使 JAK2/STAT3信号通路激活[14]。研究发现,磷酸化的JAK2、STAT3蛋白表达量与神经元凋亡的时间段和部位基本一致[15]。Yu等[16]发现大鼠脑缺血性24 h后海马CA1区神经元凋亡数随着pSTAT3 蛋白表达的增加而增多。Huang等[17]通过对STAT3基因敲除小鼠的研究发现STAT3在小鼠脑缺血中会干扰基因转录,影响突触传递,改变细胞结构及影响细胞代谢等。因此,抑制JAK2/STAT3信号通路激活抑制能够显著减少神经细胞凋亡,缩小脑梗死体积,改善神经功能缺损,具有明显的脑保护作用。
研究药物的分子机制,探寻药物作用的靶点有利于药物的使用及药物的优化。阿司匹林的神经保护机制具体机制上不清楚。Shen等[18]发现大鼠脑缺血性损伤后经灌胃阿司匹林,大鼠脑梗死体积减小,且JAK2磷酸化水平下降,推测阿司匹林可能通过JAK2介导的信号通路发挥大脑神经的保护作用。本研究通过对JAK2、pJAK2、STAT3、pSTAT3蛋白水平检测发现,大鼠脑缺血性损伤后,脑组织中pJAK2、pSTAT3 表达显著上调。与模型组比较,阿司匹林干预后pJAK2、pSTAT3表达降低,细胞凋亡减少,神经功能缺损得到明显改善,与既往研究结果相似。
综上所述,大鼠脑缺血性损伤后可能引发了 JAK2、STAT3的活化;阿司匹林可能通过抑制JAK2/ STAT3 信号通路的活化,从而抑制神经细胞凋亡,改善缺血性对大鼠的神经功能缺损,减轻脑神经细胞的损伤,发挥神经保护作用。但阿司匹林是否还能通过调节其他通路来影响疾病进程,仍需进一步的研究。
