鹌鹑MyoG基因多态性与早期生长性能的关联分析
2020-05-15白俊艳时坤鹏卢小宁陈梦柯马永康巩慧荣董智豪庞有志安肖凯常世增侯伟晓付学言樊红灯
白俊艳,时坤鹏,卢小宁,杨 帅,陈梦柯,马永康,巩慧荣,董智豪,庞有志,雷 莹,曹 慧,安肖凯,常世增,侯伟晓,付学言,樊红灯,曹 恒
(1.河南科技大学 动物科技学院,河南 洛阳 471023; 2.洛阳市动物遗传育种重点实验室,河南 洛阳 471023)
肌细胞生成素(Myogenin,MyoG)是一种生肌调节因子(MRFs),与生肌决定因子(MyoD)、生肌调节因子4(MRF4)、肌细胞生成素和生肌因子5(MYF5)共同调控肌肉的生长[1]。MyoD和MyoG均为肌调节蛋白,MyoD决定肌源性的发生,MyoG可诱导骨骼肌的末端分化[2]。WEINTRAUB等[3]研究发现,单独敲除MyoG基因的小鼠会因骨骼肌发育出现缺陷而死亡,如果同时只敲除其他3个生肌调节因子基因,小鼠骨骼肌发育都未出现缺陷。MyoG作为转录调节因子,其表达启动了一系列骨骼肌特异的胚胎性受体和收缩蛋白的合成。因此 ,MyoG是唯一的无可替代的生肌调节因子[4]。近年来,国内外对MyoG基因的研究比较广泛,多集中在生长性能的关联性、肌肉形成机制、MyoG基因的遗传表达和调控方面[5-9],而MyoG基因与鹌鹑的生长性能的关联分析尚未见报道。为此,利用PCR-SSCP法对MyoG基因与鹌鹑的早期生长性能进行了关联分析,以期为鹌鹑的早期生长性能标记辅助选择提供参考。
1 材料和方法
1.1 试验材料
试验用的鹌鹑包括中国黄羽鹌鹑、北京白羽鹌鹑、朝鲜鹌鹑各80只,均来自河南省鹌鹑养殖基地,全部为雌性鹌鹑。翅静脉采血0.4~1 mL,装于肝素钠抗凝管中,充分混匀后置于-20 ℃冰箱中保存。采用家禽全血DNA试剂盒(购自郑州鼎国生物有限公司)提取DNA,用0.5%的琼脂糖凝胶电泳检测,置于-20 ℃保存备用。
1.2 MyoG基因的引物合成
MyoG基因5′调控区A、B位点的引物分别为MyoG-5P1、MyoG-5P2,引物设计参考王琼等[10]的方法,由北京鼎国昌盛生物技术有限责任公司进行合成(表1)。
1.3 MyoG基因的PCR扩增反应
PCR反应体系:扩增总体积为20 μL,其中灭菌水7.6 μL、Mix 10 μL、上下游引物(10 μmol/L)各0.7 μL、DNA模板1 μL。PCR反应循环参数:95 ℃预变性5 min;95 ℃变性40 s,57.2 ℃或61.9 ℃退火45 s,72 ℃延伸35 s,35个循环;72 ℃再次延伸5 min。
1.4 MyoG基因的PCR-SSCP检测
将5 μL变性上样缓冲液(98%甲酰胺、2%甘油、10 mmol/L的EDTA、0.025%溴酚蓝、0.025%二甲苯青)和5 μL的PCR产物混合均匀,98 ℃水浴变性10 min,立即0 ℃冰水浴10 min。制备10%的丙烯酰胺凝胶(蒸馏水24 mL,50%丙烯酰胺8 mL,5×TBE溶液8 mL,10%过硫酸铵400 μL,四甲基乙二胺40 μL)。220 V电压条件下电泳15 min,后改为90 V电泳6 h,硝酸银染色,将结果在灯光下拍照保存。
1.5 数据分析
利用PopGene软件计算基因频率、基因型频率、杂合度(He)、有效等位基因、多态信息含量(PIC)。利用SPSS 17.0软件对MyoG基因多态性与鹌鹑早期生长性能进行关联分析,分析模型:yijkl=μ+Bi+Wj+Mk+eijkl。式中,yijkl为性状表型值,μ为总体均值,Bi为第i个品种效应(i=1,2,3),Wj为第j周龄效应(j=1,2,3,4,5,6,7),Mk为第k种基因型效应,eijkl为残差效应。
2 结果与分析
2.1 鹌鹑MyoG基因5′调控区A、B位点的PCR产物检测
从图1可以看出,鹌鹑MyoG基因5′调控区A位点扩增获得的目的片段大小为203 bp,B位点扩增获得的目的片段大小为236 bp,这与预期相一致,具有较好的特异性,可以进行后续的试验。
2.2 MyoG基因5′调控区A、B位点在鹌鹑群体中的多态性检测
在3个鹌鹑群体中MyoG基因5′调控区A点共发现6种基因型,分别为AA、BB、CC、AB、AC、BC基因型,其中在朝鲜鹌鹑群体中没有发现AB、BC基因型(图2)。
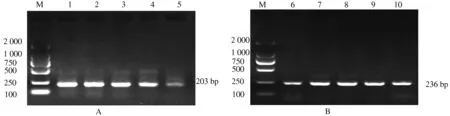
A为MyoG基因5′调控区A位点;B为MyoG基因5′调控区B位点;M为Marker 2000;1、2、6、7为中国黄羽鹌鹑;3、4、8、9为北京白羽鹌鹑;5、10为朝鲜鹌鹑

A为中国黄羽鹌鹑;B为北京白羽鹌鹑;C为朝鲜鹌鹑;4、12、14、17、19、23、24为AA基因型;5为AB基因型;1、3、13、20为AC基因型;7、9为BB基因型;10为BC基因型;2、6、8、11、15、16、18、21、22为CC基因型
对3个品种鹌鹑的MyoG基因5′调控区B位点基因型检测,结果见图3。在3个品种鹌鹑群体中共发现AA、BB、CC、DD、EE、AB、AC、AD、AE等9种基因型,A、B、C、D、E等5个等位基因,其中朝鲜鹌鹑群体中缺少等位基因C。

A为中国黄羽鹌鹑;B为北京白羽鹌鹑;C为朝鲜鹌鹑;3、4、7、10、11、15、17、18、19、20、21、23为AA基因型;2为BB基因型;1、6为DD基因型;5为EE基因型;8、12、13、16为AB基因型;9、14、22为AE基因型
2.3 MyoG基因5′调控区A、B位点在鹌鹑群体中的遗传多态性
从表2和表3可以看出,对于A位点来说,中国黄羽鹌鹑、北京白羽鹌鹑和朝鲜鹌鹑的CC基因型频率均为最高,CC基因型频率分别为0.323、0.366、0.444;中国黄羽鹌鹑、北京白羽鹌鹑和朝鲜鹌鹑的遗传多样性较为丰富(He>0.5),3个品种鹌鹑群体都为中度多态(0.25

表2 鹌鹑MyoG基因5′调控区A位点和B位点的基因型频率Tab.2 Genotype frequencies of A and B loci in 5′regulatory region of quail MyoG gene

表3 鹌鹑MyoG基因5′调控区A位点和B位点的等位基因频率和多态信息含量Tab.3 Allele frequencies and polymorphic information content of A and B loci in 5′regulatory region of quail MyoG gene
2.4 MyoG基因5′调控区A、B位点的多态性与鹌鹑生长性能的关联分析
MyoG基因5′调控区A位点的多态性与蛋用鹌鹑早期生长发育的关联分析结果见表4,由于BB基因型和BC基因型个体比较少,因此,关联分析时未考虑这2个基因型,蛋用鹌鹑早期生长发育性能只对AA、AB、AC、CC这4种基因型进行关联分析。由表4可知,在体质量、胫长、胸宽、胸深、胸骨长、体长等性状上,AB基因型显著高于AA、AC、CC基因型(P<0.05),AA、AC、CC基因型个体间不存在显著性差异(P>0.05)。胫围在AA、AB、AC、CC基因型间无显著性差异(P>0.05)。

表4 MyoG基因5′调控区A位点与鹌鹑早期生长性能的关联分析Tab.4 Association of 5′regulatory region A site of MyoG gene of quail with early growth and development
注:同行数据后不同小写字母表示差异显著(P<0.05)。
Note: The different lowercase letters in the same row mean significant difference (P<0.05).
MyoG基因5′调控区B位点的多态性与蛋用鹌鹑早期生长发育的关联分析结果见表5。由于AC、CE、BD基因型个体比较少,关联分析时未考虑这3个基因型。从表5可以看出,CC基因型体质量显著高于AD、AE、BB、DD基因型(P<0.05),DD基因型的体质量最低。CC基因型胫长显著高于AA、AD、AE、BB、DD基因型(P<0.05)。CC基因型胸宽显著高于其他基因型(P<0.05)。CC基因型胸深显著高于其他基因型(P<0.05)。CC基因型胸骨长显著高于AA、AB、AD、AE、BB、DD、EE基因型(P<0.05),AA、AB、EE基因型胸骨长显著高于AD、AE、DD基因型(P<0.05)。CC、EE基因型体长显著高于AD、AE基因型和DD基因型(P<0.05)。

表5 MyoG基因5′调控区B位点与鹌鹑早期生长性能的关联分析Tab.5 Association of 5′ regulatory region B site of MyoG gene of quail with early growth and development
注:同列数据后不同小写字母表示差异显著(P<0.05)。
Note:The different lowercase letters in the same column mean significant difference(P<0.05).
3 结论与讨论
3.1 MyoG基因的多态性
在禽类研究中,赵忠海等[11]在三穗鸭MyoG基因的外显子1、2、3中分别发现了1个、2个和3个突变位点。王琼[12]在肉鸡的MyoG5′调控区A位点发现了1个突变位点,共3种基因型,B位点发现了3个SNPs位点,共6种基因型。魏岳等[13]在边鸡的MyoG基因第3外显子中发现了2处突变位点,共6种基因型。唐莹等[14]在京海黄鸡的MyoG基因外显子1上共发现了3种基因型。可见,MyoG基因在禽类中存在丰富的多态性。本研究中,使用MyoG基因5′调控区A、B位点在3个品种的鹌鹑群体中进行多态性检测,A位点中出现了6种基因型;在B位点中检测到了9种基因型。可见,MyoG基因在鹌鹑群体中存在丰富的多态性。
3.2 MyoG基因的多态性与生长性能的关联分析
关于MyoG基因与生长性能关系的研究大多集中在猪上,在禽类中也有少量的研究。在MyoG多态性与禽类生长性能关联性的研究中,赵忠海等[11]研究发现,MyoG基因的2种突变分别对鸭的胸肌率、体质量和全净膛质量有显著影响,其所对应的纯合子基因型 CC、GG型为优势基因。王琼[12]发现,MyoG基因对鸡的肌纤维生长发育有显著影响。魏岳等[13]在MyoG基因上发现2处同义突变位点,MyoG基因在胸肌中的表达量极显著高于腿肌。唐莹等[14]在京海黄鸡的MyoG基因外显子1上共发现了3种基因型,分别为 AA、AB、BB,BB基因型的2、4、6周龄体质量显著高于 AB基因型(P<0.05), BB基因型的8周龄体质量显著高于 AA基因型(P<0.05)。王琼[12]在肉鸡的MyoG5′调控区A位点和B位点都发现了基因的多态性与肉鸡的屠宰性存在显著的相关性(P<0.05),其中B位点的多态性与鸡的肌纤维发育存在显著的正相关。魏岳等[13]研究发现,MyoG基因的多态性对边鸡生长发育性能和屠宰性能表现出显著或极显著的影响(P<0.05或P<0.01)。唐莹等[14]研究发现,MyoG基因外显子1的多态性与京海黄鸡早期生长发育性能存在显著的相关性(P<0.05)。
在MyoG基因5′调控区A位点的多态性与鹌鹑生长性能关联的研究中,AB基因型的蛋用鹌鹑在体质量、胫长、胸宽、胸深、胸骨长、体长等早期生长发育性状上都显著性高于AA、AC和CC基因型(P<0.05)。在MyoG基因5′调控区B位点的多态性与鹌鹑生长性能关联的研究中,蛋用鹌鹑在体质量、胫长、胸宽、胸深、胸骨长、体长、等多个早期生长发育性状上都出现了显著性差异(P<0.05)。MyoG基因5′调控区A、B位点的多态性与鹌鹑早期生长发育性能存在关联性,这与王琼[12]、魏岳等[13]、唐莹等[14]的研究结果相似。早期生长性能与MyoG基因5′调控区B位点的多态性存在关联,但由于基因型较多,还不能确定优势基因型,需要后续进一步研究。综上,MyoG基因5′调控区A、B位点关联分析显示,不同基因型与早期蛋用鹌鹑的体质量、胫长、胸宽、胸深、胸骨长、体长存在关联性,且差异显著(P<0.05),说明MyoG基因5′调控区A、B位点对鹌鹑的早期生长性能有一定影响。
