厚朴酚对功能性消化不良小鼠消化液分泌和胃肠运动功能的影响
2020-05-15王振奋黄平蔡国豪
王振奋,黄平,蔡国豪
功能性消化不良是临床上多发的胃肠动力不足类疾病,主要表现为持续性(周期性)上腹部疼痛、灼烧感、餐后恶心呕吐等[1]。随着生活节奏的加快和饮食习惯的变化,功能性消化不良的发病率呈逐年上升的趋势,而且功能性消化不良具有反复发作、病程迁延的特点,对患者生理及心理均造成极大的影响[2]。目前,功能性消化不良的治疗主要以促进胃动力、保护胃黏膜并抑制胃酸分泌的为主,但整体疗效不佳[3]。厚朴酚是厚朴药材中的重要成分,而治疗功能性消化不良的中药方中常有厚朴组分[4-5],但其具体作用机制尚不明确。本研究拟建立功能性消化不良小鼠,观察厚朴酚对小鼠消化液分泌和胃肠运动功能的影响,为厚朴药材的相关应用提供理论基础。
1 材料与方法
1.1 动物
清洁级昆明种小鼠84只,4周左右,体重18~22 g,均为雄性,购于湖南斯莱克景达实验动物有限公司,动物合格证号:SCXK(湘)2019-0020。
1.2 药物、试剂与仪器
厚朴酚、潘多立酮(HPLC≥98%,上海源叶生物科技有限公司),左旋精氨酸片(上海熹垣生物科技有限公司)。苏木素、伊红染液(上海经科化学科技有限公司),ELISA试剂盒(美国R&D公司),基因引物序列(上海钰博生物科技有限公司),Trizol裂解液、RIPA裂解液(美国Sigma公司),逆转录试剂盒(美国GeneCopoeia公司),蛋白一抗(美国Cell Signaling公司)。光学显微镜(日本奥林巴斯公司),全自动酶标仪(美国Thermo Fisher公司),荧光定量PCR仪(美国Bio-Rad公司),全自动凝胶成像仪(北京大龙兴创实验仪器有限公司)。
1.3 方法
1.3.1 功能性消化不良小鼠模型制备
小鼠适应性喂养3 d后,采用不规律进食结合腹腔注射L-Arg构建功能性消化不良小鼠[6],具体方法如下:以2 d进食、1 d禁食为1个循环,共循环10 d,对照组自由进食;第11 d腹腔注射0.1 g/kg的L-Arg,对照组以生理盐水替代;禁食24 h,每组随机抽取3只小鼠称重,腹腔注射0.5 g/只的碳末半固体糊;30 min后检测胃内残留率及小肠推进率,并观察胃组织病理学改变,若模型组与对照组比较,胃残留率、小肠推进率差异有统计学意义(P<0.05),且胃组织出现功能性病变,即可判定功能性消化不良小鼠复制成功。
1.3.2 分组给药
将84只小鼠随机分为对照组、模型组、厚朴酚组(5、10、20、40 mg/kg)及潘多立酮组(10 mg/kg),每组小鼠分笼饲养;建模成功后,厚朴酚组和多潘立酮组分别灌胃相应剂量药物,连续灌胃7 d,对照组和模型组以生理盐水替代。末次给药后,禁食24 h,腹腔注射0.5 g/只的碳末半固体糊;30 min后采血2 mL,离心取血清;解剖腹腔,迅速取出胃及小肠组织。
1.3.3 大体观察
观察小鼠一般状况(被毛光泽度、大便性状以及活动情况等),记录其进食、饮水量及体重,进食/饮水量=给食/水前的重量/体积-次日给食/水前剩余的重量/体积,体重增加量=处理结束后称重量-入组处理时称重量。
1.3.4 胃组织病理观察
将胃组织沿胃大弯剪开,制成石蜡切片,进行常规苏木素-伊红染色,光学显微镜下观察组织病理变化。
1.3.5 胃肠激素检测
严格参照ELISA说明书步骤进行操作,免疫反应结束后,于450 nm处检测各孔吸光值,根据标准品曲线,计算血清胃泌素(gastrin,GAS)和胃动素(motilin,MTL)的含量。
1.3.6 胃肠运动功能检测
将胃组织沿胃大弯剪开,冲洗净胃内容物后,称量胃净重,胃内容物残留率=[(胃全重-胃净重)/固体糊状物重]×100%;取出小肠组织,测量胃部幽门切迹至碳糊最前端的距离、幽门切迹至回盲部全长,小肠推进率=(胃部幽门切迹至碳糊最前端的距离/幽门切迹至回盲部全长)×100%。
1.3.7 胃窦组织中SCF和c-kit mRNA表达的检测
取适量胃窦组织,加入Trizol裂解液,冰上匀浆,提取组织中总RNA;参照逆转录试剂盒合成cDNA,混入荧光Mix后,进行荧光定量PCR分析。基因引物序列见表1[7],反应条件:95 ℃ 10 min,40个循环(95 ℃ 15 s、60 ℃ 1 min、72 ℃ 30 s)。采用2-ΔΔCT法,计算SCF和c-kit mRNA的相对表达量。

表1 基因引物序列
1.3.8 胃窦组织中SCF和c-kit蛋白表达的检测
取适量胃窦组织,加入RIPA裂解液,冰上匀浆,提取组织中总蛋白;经稀释后配制10% SDS-PAGE分离胶+5%浓缩胶,进行电泳;根据目标蛋白的分子量切割凝胶,电转至PVDF 膜;将PVDF 膜正面朝下浸于5%脱脂奶粉中,室温下孵育1 h;过夜孵育蛋白一抗(SCF1∶1 500,c-kit 1∶1 000,β-actin 1∶1 000),置于4 ℃湿盒中;孵育二抗(1∶10 000)40 min,置于室温湿盒中;应用全自动凝胶成像仪显色,计算SCF和c-kit蛋白的相对表达量。
1.4 统计学方法

2 结果
2.1 厚朴酚对功能性消化不良小鼠大体情况的影响
对照组小鼠毛发致密鲜亮,食欲较好,较为活跃,大便正常、呈颗粒状;模型组小鼠毛发稀释、无光泽,食欲消退,活跃度降低,偶尔有便溏;厚朴酚组和多潘立酮组上述症状明显改善。各组小鼠进食、饮水量及体重增加量见表2,与对照组相比,模型组小鼠进食、饮水量及体重增加量明显降低(P<0.05);与模型组相比,20 mg/kg和40 mg/kg厚朴酚组和多潘立酮组进食、饮水量及体重增加量明显升高(P<0.05),其中仅40 mg/kg厚朴酚组体重增加量明显高于5 mg/kg厚朴酚组和10 mg/kg厚朴酚组(P<0.05),而厚朴酚各组进食、饮水量比较均无明显差异(P>0.05)。
2.2 厚朴酚对功能性消化不良小鼠胃组织病理变化的影响
如图1,各组小鼠胃窦组织结构规则、完整;对照组胃窦
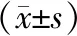
表2 各组小鼠进食、饮水量及体重增加量的比较
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与40 mg/kg厚朴酚组比较,cP<0.05
黏膜层有少量淋巴细胞浸润,模型组胃腺体扩张,炎性细胞浸润增加,但胃肌层无明显的病理变化;厚朴酚和多潘立酮组炎性细胞浸润和胃腺体扩张程度轻于模型组。
2.3 厚朴酚对功能性消化不良小鼠消化液分泌的影响
各组小鼠消化液含量见表3,与对照组相比,模型组小鼠GAS和MLT水平明显降低(P<0.05);与模型组相比,10、20、40 mg/kg厚朴酚组和多潘立酮组GAS和MLT水平明显升高(P<0.05);40 mg/kg厚朴酚组GAS和MLT水平明显高于5 mg/kg厚朴酚组和10 mg/kg厚朴酚组(P<0.05),而厚朴酚组内其他剂量组比较无明显差异(P>0.05)。
2.4 厚朴酚对功能性消化不良小鼠胃肠运动功能的影响
各组小鼠胃内容物残留率和小肠推进率见表4,与对照组相比,模型组小鼠胃内容物残留率和小肠推进率明显降低(P<0.05);与模型组相比, 40 mg/kg厚朴酚组和多潘立酮组胃内容物残留率和小肠推进率明显升高(P<0.05)。其中厚朴酚组内胃内容物残留率的比较中,仅5 mg/kg厚朴酚组和10 mg/kg厚朴酚组间无明显差异,其他剂量组比较均具有统计学意义(P<0.05);而厚朴酚组内其他剂量组比较无明显差异(P>0.05);厚朴酚组内小肠推进率的比较均无统计学意义(P<0.05)。
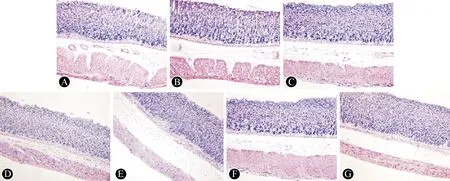
图1 厚朴酚对功能性消化不良小鼠胃组织病理变化的影响,HE×200 A:对照组;B:模型组;C:5 mg/kg厚朴酚;D:10 mg/kg厚朴酚;E:20 mg/kg厚朴酚;F:40 mg/kg厚朴酚;G:10 mg/kg多潘立酮
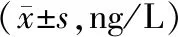
表3 厚朴酚对功能性消化不良小鼠消化液分泌的影响
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与40 mg/kg厚朴酚组比较,cP<0.05
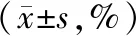
表4 厚朴酚对功能性消化不良小鼠胃肠运动功能的影响
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与40 mg/kg厚朴酚组比较,cP<0.05;与20 mg/kg厚朴酚组比较,dP<0.05
2.5 厚朴酚对功能性消化不良小鼠胃窦组织中SCF及c-kit表达的影响
各组小鼠胃窦组织中SCF及c-kit的表达见表5、图2,与对照组相比,模型组小鼠胃窦组织中SCF、c-kit mRNA和蛋白的表达明显降低(P<0.05);与模型组相比,厚朴酚组和多潘立酮组SCF、c-kit mRNA和蛋白的表达明显升高(P<0.05);其中厚朴酚组内比较中,40 mg/kg厚朴酚组SCF mRNA和蛋白水平高于其他剂量组,20 mg/kg厚朴酚组高于5 mg/kg厚朴酚组(P<0.05);c-kit mRNA在厚朴酚组各剂量组间比较中均有统计学意义(P<0.05);厚朴酚组内c-kit蛋白水平的比较中,仅5 mg/kg厚朴酚组和10 mg/kg厚朴酚组间无明显差异,其他剂量组比较均具有统计学意义(P<0.05)。

表5 厚朴酚对功能性消化不良小鼠胃窦组织中SCF及c-kit mRNA表达的影响
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与40 mg/kg厚朴酚组比较,cP<0.05;与20 mg/kg厚朴酚组比较,dP<0.05;与10 mg/kg厚朴酚组比较,eP<0.05

图2 厚朴酚对功能性消化不良小鼠胃窦组织中SCF及c-kit蛋白表达的影响 A:对照组;B:模型组;C:5 mg/kg厚朴酚;D:10 mg/kg厚朴酚;E:20 mg/kg厚朴酚;F:40 mg/kg厚朴酚;G:10 mg/kg多潘立酮
3 讨论
由于功能性消化不良缺乏器质性病变,临床主要依据患者症状进行诊断,但该疾病尚缺乏公认的动物模型[8]。本研究采用不规律进食联合L-Arg处理小鼠,不规则进食符合功能性消化不良的病因;而且L-Arg和氧在特异性一氧化氮合成酶作用下,可合成一氧化氮,对胃肠道运动具有抑制性[9]。同时,本研究结果显示,造模后小鼠出现明显的进食减少、体重减轻等消化不良症状,组织病理学观察也未发现有明显的器质性病变,符合功能性消化不良动物模型的要求。
临床实践表明,厚朴中药复方治疗功能性消化不良有较好的疗效[10-11]。唐荣伟等[12]研究指出,厚朴温中汤加味配伍吗丁啉可缓解功能性消化不良临床症状,有助于改善血浆胃动素及生长抑素水平,提高临床疗效。杜奕奇等[13]研究指出,厚朴排气合剂治疗有腹部胀满症状的功能性消化不良患者,有较好的疗效和安全性。但尚缺乏厚朴与功能性消化不良的机制研究,厚朴酚是厚朴中的活性成分,具有抗肌肉松弛、抗炎、抗菌、抗肿瘤等药理药效[14]。本研究以不同剂量厚朴酚处理功能性消化不良小鼠,发现厚朴酚可以缓解模型小鼠消化不良症状,与文献报道结果相符[15]。
GAS和MTL是主要的胃肠激素,可促进胃酸分泌和胃排空、降低胃窦和幽门括约肌紧张性等。据报道,胃肠激素的紊乱与功能性消化不良的发病密切相关[16]。本研究结果显示,厚朴酚可明显提高模型小鼠血清GAS和MTL水平,但并未超过对照组,提示厚朴酚可恢复胃肠激素GAS和MTL的分泌,但并未引起GAS过高所致的胃酸相关疾病。另外,胃肠动力障碍是功能性消化不良的病理基础之一,临床治疗主要围绕调节胃肠动力展开,其中多潘立酮、莫沙必利是常用药物[17]。本研究结果显示,厚朴酚对模型小鼠有促胃肠动力的作用,其高剂量与多潘立酮促进效果。
SCF因子是多功能细胞生长因子,是c-kit受体的天然配体,两者结合形成二聚体复合物,活化细胞内的酪氨酸激酶,从而促进胃肠活动起搏细胞(Cajal间质细胞)的增殖[18]。Ren H等[19]研究发现,当SCF/ c-kit信号通路受损时,Cajal间质细胞的数量、形态及功能均会发生异常,最终导致胃肠动力障碍性疾病。本研究结果显示,厚朴酚可上调SCF、c-kit的表达,提示厚朴酚可能通过上调SCF和c-kit的表达,启动SCF/ c-kit信号通路,促进胃动力,与文献报道结果相似[20]。
综上所述,厚朴酚可减轻功能性消化不良小鼠症状,恢复小鼠进食,体重明显增长,胃肠激素、胃肠动力均有显著提高,其作用机制可能与上调SCF和c-kit的表达有关。但胃肠激素的种类、作用机制、相互关联等尚未详尽,未来有关厚朴酚与胃肠激素的相关研究还需要深入分析。
