松毛菇多酚抗氧化及抑菌活性研究
2020-05-14李彦坡程璐洁孙怡婷
李彦坡 - 黄 艳 程璐洁 - 孙怡婷 -
(1.温州市农业科学研究院,浙江 温州 325000;2.武夷学院茶与食品学院,福建 武夷山 354300;3.福建农林大学食品科学学院,福建 福州 350002)
松毛菇又名灰离褶伞、千佛头、北风菌、一窝鸡等[1],主要分布于中国吉林、黑龙江、河南、青海、云南、西藏及福建北部地区[2-4]。研究[5-7]表明,松毛菇具有助消化、防治胃肠胀满和便秘等功效,其提取物对肉瘤和艾氏癌的抑制率高达 80%~90%。目前松毛菇收获后除鲜食外,大部分被制成干菇、罐头等加工品,但松毛菇中天然有效成分的研究和开发却鲜见研究报道,极大地制约了松毛菇的产业发展。
多酚类化合物是广泛存在于植物中的一类活性物质[8],不仅具有较强的抗氧化作用[9],还具有抗炎抑菌[10]、抗癌[11]、抗老化[12]、降血压和预防心血管疾病[13]等功效,近年来对多酚类物质的研究已引起研究者的广泛关注[14]。目前已见番石榴[15]、海棠[16]、洋葱[17]等果蔬多酚及柠檬果皮[18]、玉米须[19]等来源于果蔬副产物的多酚抗氧化和抑菌活性报道,而关于松毛菇中多酚类化合物的抗氧化及抑菌活性的研究尚未见报道。试验拟在前期松毛菇多酚提取纯化研究的基础上,探究松毛菇粗多酚及纯化多酚的体外抗氧化活性及抑菌活性,以期为松毛菇多酚的功能特性及高值化利用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验原料
松毛菇:武夷山食用菌技术开发有限公司;
大肠埃希氏菌(Escherichiacoli)、伤寒沙门氏菌(Salmonellatyphi)、金黄色葡萄球菌(Staphylococcusaureus)、枯草芽孢杆菌(Bacillussubtilis)、酿酒酵母(Saccharomycescerevisiae):广东环凯微生物科技有限公司。
1.1.2 主要试剂
没食子酸、硫酸亚铁、过氧化氢、邻苯三酚:分析纯,上海展云化工有限公司;
1,1-二苯-2-苦基肼(DPPH):生物试剂,梯希爱(上海)化成工业发展有限公司;
抗坏血酸:分析纯,国药集团化学试剂有限公司;
平板计数培养基:广东环凯微生物科技有限公司。
1.1.3 仪器设备
电子分析天平:AE224C型,上海舜宇恒平科学仪器有限公司;
数控超声波清洗器:KQ-500DE型,昆山市超声仪器有限公司;
循环水真空泵:SHZ-DS-Ⅲ型,巩义市予华仪器有限责任公司;
旋转蒸发器:RE2000A型,上海亚荣生化仪器厂;
紫外可见分光光度:UC-6100型,上海元析仪器有限公司;
冷冻干燥机:LGJ-10D型,湖南湘仪实验仪器开发有限公司;
手提式压力蒸汽灭菌锅:YXQ-LS-18SI型,上海博迅实业有限公司医疗设备厂;
气浴恒温振荡器:SHZ-82A型,江苏省金坛市荣华仪器制造有限公司;
单人单面净化工作台:SW-CJ-1FD型,苏州净化设备有限公司;
高速粉碎机:6202型,欣镇精密企业有限公司。
1.2 方法
1.2.1 松毛菇多酚干品的制备 参照课题组[2]前期研究的方法进行松毛菇粗多酚的提取及纯化。粗多酚及纯化多酚溶液经真空浓缩、冷冻干燥后分别获得松毛菇粗多酚和纯化多酚干品。
1.2.2 松毛菇多酚体外抗氧化活性
(1)清除·OH能力测定:采用芬顿(Fenton)反应法[20-21],配制9.0 mmol/L的FeSO4、9.0 mmol/L的水杨酸和8.8 mmol/L的H2O2,以及不同浓度的松毛菇多酚样品和VC待测液于试管中。分别加入1 mL不同浓度的松毛菇多酚待测液,然后依次加入1 mL FeSO4和2 mL水杨酸溶液,再加入2.0 mL H2O2,充分混合后置于37 ℃下水浴30 min,510 nm处测定吸光度值A1;等体积去离子水替代 H2O2,其余条件一致,测定吸光度值A0;用等体积去离子水替代样品测定吸光度值A2。以VC为阳性对照,每组试验平行测定3次,结果取平均值。按式(1)计算·OH清除率。
c={[A0-(A1-A2)]/A0}×100%,
(1)
式中:
c——·OH清除率,%;
A0——无样品加H2O2(空白对照组)的吸光度值;
A1——加样品和H2O2测得的吸光度值;
A2——加样品不加H2O2测得的吸光度值。
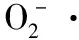
c=[(A2-A1)/A2]×100%,
(2)
式中:

A1——含样品溶液的吸光度值;
A2——不含样品溶液的吸光度值。
(3)清除DPPH·能力测定:采用DPPH比色法[23]。配制不同浓度的多酚样品和VC待测液、0.2 mmol/L的DPPH乙醇溶液,在试管中依次加入2.0 mL的待测液和DPPH乙醇溶液,对照管中依次加入2.0 mL的待测液和无水乙醇,空白管中依次加入2.0 mL的DPPH乙醇溶液和无水乙醇。溶液充分摇匀,室温下避光放置30 min,于517 nm处测定吸光度值,依次记为A1、A2、A0。每组试验平行测定3次,结果取平均值。按式(3)计算DPPH·清除率。
c={[1-(A1-A2)]/A0}×100%,
(3)
式中:
c——DPPH·清除率,%;
A1——样品待测液和DPPH乙醇溶液的吸光度值;
A2——样品待测液和无水乙醇的吸光值;
A0——无水乙醇和DPPH乙醇溶液对应测得的吸光值。
1.2.3 松毛菇多酚抑菌活性
(1)松毛菇多酚溶液制备:称取一定质量的粗多酚及纯化多酚粉末干品,在无菌操作台上加入无菌蒸馏水溶解,各配制成30 mg/mL的原液,置于冰箱中遮光保存,后续试验根据需要可配制成相应浓度。
(2)菌悬液及滤纸圆片制备:每次试验前预先对大肠埃希氏菌、伤寒沙门氏菌、金黄色葡萄球菌、枯草芽孢杆菌、酿酒酵母5种供试菌进行活化,挑取活化过的各种供试菌的单菌落,接种于装有10 mL无菌生理盐水及无菌玻璃珠的锥形瓶中,振荡10 min。采用OD600 nm值法对菌悬液浊度进行调整,得到108CFU/mL的菌悬液,进行梯度稀释后制备107CFU/mL的菌悬液,备用。
用打孔器打出直径为6 mm的滤纸小圆片,121 ℃灭菌15 min后烘干、备用。
(3)松毛菇多酚抑菌活性测定:采用滤纸片扩散法[24]。在无菌操作台中,将无菌滤纸圆片分别置于浓度为10,20,30 mg/mL的松毛菇粗多酚和纯化多酚水溶液中浸泡10 h,将无菌培养基倒入无菌培养皿,凝固后用无菌移液管准确吸取0.2 mL的5种供试菌菌悬液于培养基平板上,用涂布棒涂布均匀,静置10 min。用无菌镊子夹取出经不同浓度松毛菇多酚溶液浸泡过的滤纸圆片,沥干,均匀置于含供试菌的培养基表面,以浸有无菌生理盐水的滤纸圆片为空白对照,每个平皿均匀放置4片滤纸,编号标记,将含细菌的培养皿置于37 ℃条件下培养24 h,含有酵母的培养皿置于28 ℃条件下培养48 h,观察滤纸圆片周围是否出现抑菌圈,采用十字交叉法量取抑菌圈直径,比较不同浓度多酚溶液的抑菌效果。每组试验平行测定3次,结果取平均值。
(4)松毛菇多酚最低抑菌浓度(MIC)的测定:参照李芬芳等[25]的方法并根据实际情况有所调整。将松毛菇粗多酚和纯化多酚原液配分别制成2.5,5.0,10.0,15.0,20.0,25.0,30.0 mg/mL 7个浓度,用移液管准确吸取各浓度多酚溶液1 mL置于无菌平板内,注入50 ℃无菌培养基后充分混匀,待培养基凝固后,分别滴加5种供试菌的菌悬液各0.1 mL,用涂布棒涂布均匀,静置10 min,对含细菌和酵母菌的培养皿进行培养。将完全无菌生长的平板所对应的松毛菇多酚浓度记为最小抑菌浓度(MIC)。每组试验平行测定3次。
(5)松毛菇多酚最低致死浓度(MBC)测定:依次将MIC测定中未见菌生长对应的各培养皿的培养菌,各吸取0.1 mL涂布于相应平板培养基上,静置10 min,对含细菌和酵母菌的培养皿进行培养。平板菌落总数<5的最小稀释浓度记为最低致死浓度(MBC)。
2 结果与分析
2.1 松毛菇多酚体外抗氧化活性
2.1.1 清除·OH能力 由图1可知,松毛菇粗多酚、纯化多酚和VC的浓度越高,对·OH的清除率越大,即清除能力越强,且影响显著。当质量浓度为0.6 mg/mL时,粗多酚、纯化多酚和VC对·OH清除率均达到最大值,分别为66.44%,69.37%,68.80%,此时纯化多酚的清除率最高,且高于VC。当浓度<0.3 mg/mL时,粗多酚和纯化多酚对·OH的清除率均低于VC;当浓度≥0.3 mg/mL时,松毛菇纯化多酚对·OH的清除率均高于VC。相同浓度下,松毛菇纯化多酚对·OH的清除率均高于粗多酚。综上,松毛菇粗提及纯化多酚均具有较强的·OH清除能力,且清除能力与多酚浓度呈正相关,当浓度>0.3 mg/mL时,纯化多酚的清除能力强于VC。比较相同质量浓度的粗提多酚、纯化酚与VC对·OH清除率的效果可知,当纯化多酚浓度达到0.2 mg/mL后,纯化多酚与VC对·OH清除率的效果无显著差异,浓度达到0.5%以上后,三者清除·OH的效果无显著差异。
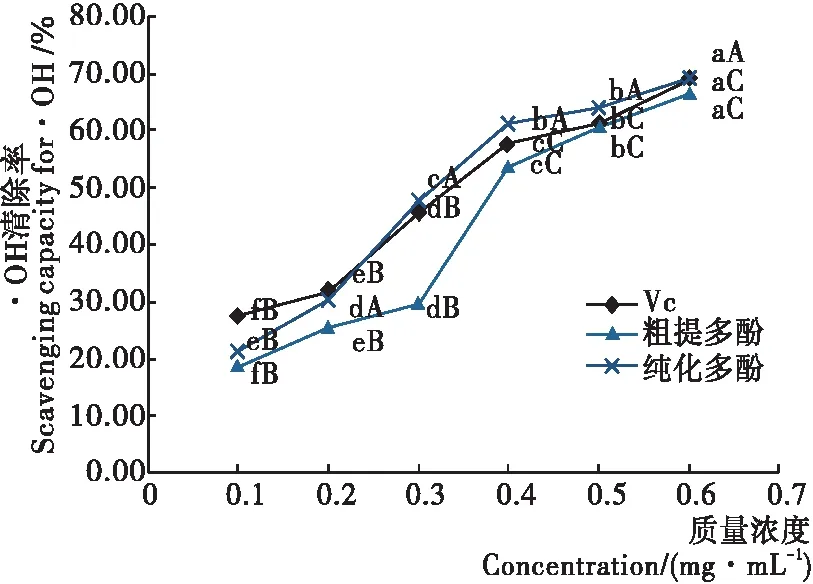
小写字母不同表示组内差异显著(P<0.05),大写字母不同表示组间差异显著(P<0.05)
图1 不同浓度的松毛菇多酚溶液对·OH的清除能力
Figure 1 The scavenging capacity of polyphenols fromLyophyllumCinoraseensfor ·OH
·OH几乎能与所有生物大分子(蛋白质、脂质、核酸等)发生反应,其存在与人体衰老、癌症等多种疾病相关,因此对人体危害极大[26]。作为一种天然多酚提取物,在一定浓度下松毛菇纯化多酚对·OH的清除能力强于VC,因此可以考虑将松毛菇纯化多酚作为一种外源性自由基清除剂加以利用。

小写字母不同表示组内差异显著(P<0.05),大写字母不同表示组间差异显著(P<0.05)



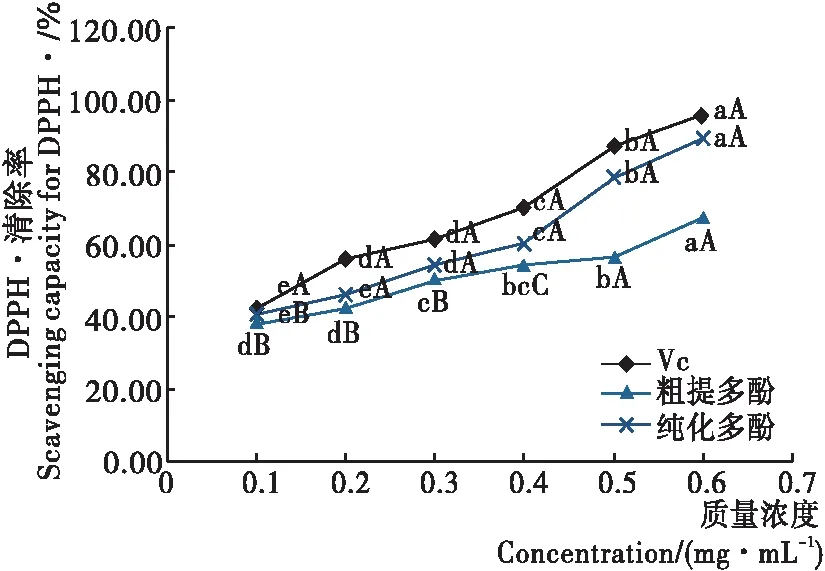
小写字母不同表示组内差异显著(P<0.05),大写字母不同表示组间差异显著(P<0.05)
图3 不同浓度的松毛菇多酚溶液对DPPH·的清除能力
Figure 3 The scavenging capacity of polyphenols fromLyophyllumCinoraseensof different concentrations for DPPH·
2.2 松毛菇多酚抑菌活性
2.2.1 不同浓度松毛菇多酚的抑菌效果 由表1可知,3种浓度(10,20,30 mg/mL)的松毛菇粗多酚对大肠埃希氏菌无抑制作用,除革兰氏阴性的伤寒沙门氏菌外,各浓度的粗多酚对革兰氏阳性的金黄色葡萄球菌和枯草芽孢杆菌、酿酒酵母均有抑制作用,且抑菌圈直径大小与多酚浓度存在明显的剂量效应关系,即抑菌效果随着多酚浓度的增大而增强。当粗多酚浓度为20,30 mg/mL时对伤寒沙门氏菌亦呈现抑制作用。相比松毛菇粗多酚,除对大肠埃希氏菌的抑菌效果无显著变化外,纯化多酚对其他4种供试菌的抑菌圈直径均明显增大。不论是粗多酚还是纯化多酚,相同浓度下对酿酒酵母的抑菌圈直径均最大,说明对酿酒酵母的抑菌效果最好,30 mg/mL时对应的抑菌圈直径分别为(10.9±0.2),(14.7±0.2)mm。综上,相同浓度条件下,粗多酚及纯化多酚均对酿酒酵母的抑菌作用最强,且纯化多酚对同一供试菌的抑菌作用均强于粗多酚。
2.2.2 最低抑菌浓度和最低致死浓度 由表2可知,在5种供试菌中,松毛菇粗多酚对酿酒酵母和枯草芽孢杆菌的MIC最低,均为5.0 mg/mL,对大肠埃希氏菌的最高,为20.0 mg/mL。松毛菇纯化多酚亦对酿酒酵母和枯草芽孢杆菌的MIC最低,均为2.5 mg/mL。粗提及纯化多酚对酿酒酵母的MBC最小,分别为10.0,2.5 mg/mL,对大肠埃希氏菌的MBC最大,分别为30.0,15.0 mg/mL。纯化多酚对各菌种的MIC和MBC均小于粗多酚,表明纯化多酚的抑菌活性强于粗多酚。综上表明,在5种供试菌中,松毛菇粗多酚及纯化多酚对酿酒酵母的抑菌能力最强,对大肠埃希氏菌的抑菌效果最弱,且纯化多酚对各供试菌的抑菌作用均强于粗多酚。
表1 松毛菇多酚对供试菌的抑菌效果
Table 1 Bacteriostatic effect of polyphenols fromLyophyllumCinoraseenson the tested bacteria(n=3) mm
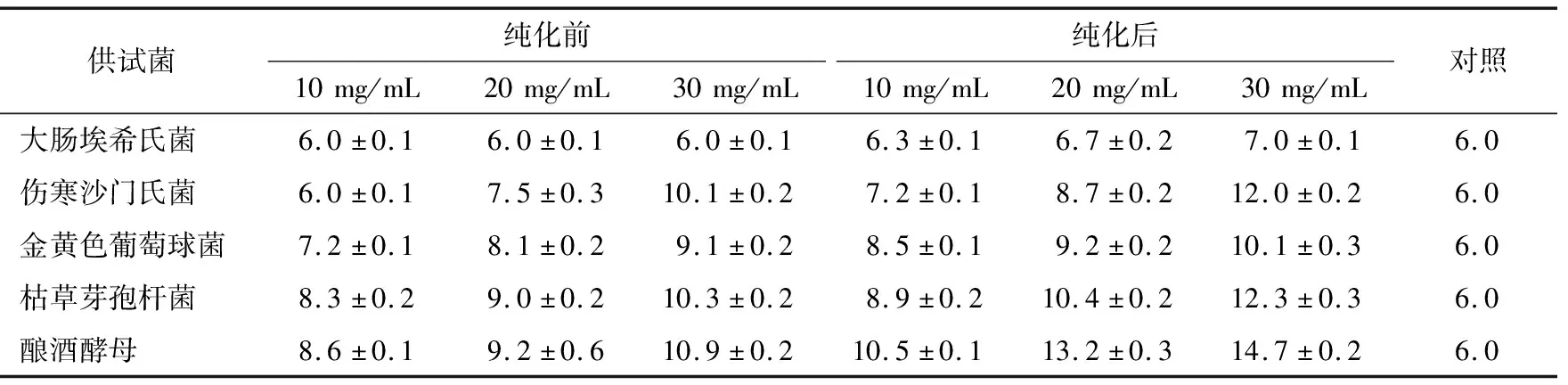
供试菌 纯化前 纯化后 10mg/mL20mg/mL30mg/mL10mg/mL20mg/mL30mg/mL对照大肠埃希氏菌6.0±0.16.0±0.16.0±0.16.3±0.16.7±0.27.0±0.16.0伤寒沙门氏菌6.0±0.17.5±0.310.1±0.27.2±0.18.7±0.212.0±0.26.0金黄色葡萄球菌7.2±0.18.1±0.29.1±0.28.5±0.19.2±0.210.1±0.36.0枯草芽孢杆菌8.3±0.29.0±0.210.3±0.28.9±0.210.4±0.212.3±0.36.0酿酒酵母8.6±0.19.2±0.610.9±0.210.5±0.113.2±0.314.7±0.26.0
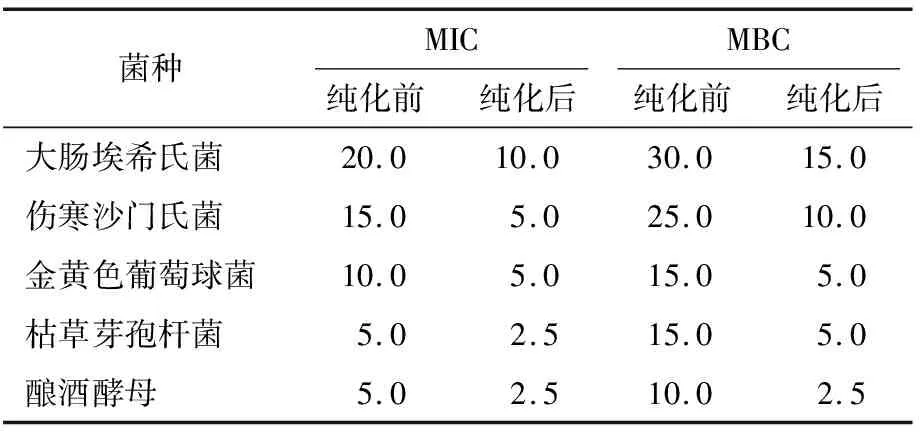
表2 松毛菇多酚的MIC和MBC
3 结论
松毛菇多酚具有良好的抗菌活性,可作为天然抗氧化剂及天然植物抗菌剂应用于食品加工与医疗保健中。后续试验可利用现代分析方法(HPLC、红外光谱技术等),对松毛菇多酚化合物进行结构鉴定和组分分析,进一步明确其中抗氧化和(或)抑菌效果的主要生物活性成分,探究其作用机制,并进一步将其应用于油脂、肉制品、饮料等食品加工中,从而促进松毛菇的高值化利用。
