小黑药亲电成分干预混合游离脂肪酸诱导的人肝癌细胞株HepG2脂肪变性研究
2020-05-14董文乐蒋羽鸽夏淑芳曹丛丛成向荣
董文乐 - 蒋羽鸽 - 夏淑芳 - 曹丛丛 - 赵 蔚 成向荣 -
(江南大学食品学院,江苏 无锡 214122)
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是以肝脏脂质过量累积与细胞脂肪变性为主要特征的代表性疾病[1]。目前对于该病的内在机制尚未,普遍接受的发病机制是Day等[2]提出的“二次打击”学说,该学说涉及了影响非酒精性脂肪肝发展的多种因素,其中细胞内活性氧过多引起的氧化应激是该病发生发展的一个重要因素。氧化应激可损伤线粒体内脂肪酸β氧化相关酶,影响β氧化进程,从而导致脂质过量累积,诱导NAFLD的发生[3-4]。
当机体内生成过多活性氧时,体内抗氧化系统清除自由基的能力下降,需要补充外源性抗氧化剂。外源抗氧化剂基于性质及作用机制分为直接抗氧化剂和间接抗氧化剂,间接抗氧化剂可通过上调各种细胞保护蛋白的表达起到抗氧化作用,具有不易降解、半衰期长以及不易促氧化的特点[5]。膳食源亲电化合物是一类广泛存在于日常膳食中,普遍具有α,β-不饱和羰基或环张力的间接抗氧化剂[6],其可通过烷基化修饰Nrf2-Keap1信号通路中Keap1的半胱氨酸残基使Nrf2摆脱Keap1的结合,释放入核,促进下游抗氧化物质的表达[7]。研究已证实,生姜中的花姜酮[8]和胡萝卜中的炔醇类化合物[9]可以修饰Keap1的半胱氨酸残基激活Nrf2-Keap1信号通路,促进下游细胞保护性蛋白和抗氧化酶的表达,进而调控细胞氧化还原稳态。氧化应激在非酒精性脂肪肝发生、发展中扮演了重要角色,笔者推测膳食源亲电化合物是一类潜在的非酒精性脂肪肝干预因子。
小黑药是菊科旋覆花属植物显脉旋覆花(InulanervosaWall.)的根茎[10],于2010年被批准为新食品原料。小黑药具有抗氧化[11]、抑菌[12]等作用,还能通经络,祛风除湿,健胃消食,祛痰止咳[13],目前尚无其他功效的报道,小黑药干预肝细胞脂肪变性的作用尚未明确。严岚[14]21-61的研究结果表明显脉旋覆花地上部分含有苯丙素类、二萜类、百里香酚类成分;贺安娜等[11]的研究结果表明显脉旋覆花地下部分中多酚类和黄酮类成分的含量分别为1.3%~2.3%,0.018%~0.028%;张虹等[15]的研究结果表明显脉旋覆花根中黄酮类成分的含量为1.0%~2.3%。此外,同属近缘的旋覆花植物具有抗氧化、抗炎、抗肿瘤活性的亲电性倍半萜内酯类成分[16],但目前关于小黑药的化学成分,特别是亲电化合物的研究较少,小黑药干预肝细胞脂肪变性的作用尚未明确。
研究拟根据亲电天然产物易与富电子的巯基发生亲电加成的特点,设计巯基功能化磁珠对小黑药醇提物、各极性部位中的亲电成分进行靶向敲出,并基于游离脂肪酸(FFA)诱导的HepG2细胞评价小黑药亲电成分对肝细胞脂肪变性的干预作用,以期为小黑药功能产品的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
人肝癌细胞株HepG2:中国科学院典型培养物保藏委员会细胞库;
小黑药:2018年9月采自云南昆明梁王山;
DMEM高糖培养基、PBS缓冲液:美国Hyclone公司;
胎牛血清、胰酶和双抗:美国Gibco公司;
活性氧检测试剂盒、RIPA裂解液(弱)、BCA蛋白浓度测定试剂盒:上海碧云天生物科技有限公司;
甘油三酯测定试剂盒、总胆固醇检测试剂盒、总抗氧化能力检测试剂盒、总超氧化物歧化酶检测试剂盒、过氧化氢酶测定试剂盒、谷胱甘肽过氧化物酶测定试剂盒、总谷胱甘肽/氧化型谷胱甘肽测定试剂盒:南京建成生物工程研究所;
RNA easy Isolation Reagent:南京诺唯赞生物科技有限公司;
MonScriptTMRTIII All in One Mix逆转录试剂盒、MonAmpTMFast SYBR®Green qPCR Mix(None ROX)实时荧光定量聚合酶链式反应试剂盒:中国莫纳生物科技有限公司;
油酸钠:北京迈瑞达科技有限公司;
棕榈酸钠:上海麦克林生化科技有限公司;
尼罗红:北京索莱宝科技有限公司;
无脂肪酸的牛血清白蛋白:上海翊圣生物科技有限公司;
羧基磁性琼脂糖微球:上海英芮诚生化科技有限公司;
其他化学药品和试剂均为分析纯。
1.1.2 仪器与设备
细胞培养箱:Thermo BB15型,美国Thermo公司;
酶标仪:BioTek Synergyh1型,美国biotek公司;
高效液相色谱仪:LC20A型,岛津(上海)商贸有限公司;
质谱仪:MALDI SYNAPT MS型,美国沃特世公司;
荧光分光光度计:F98型,中国上海棱光技术有限公司;
实时荧光定量PCR系统:Monad Selected q225型,中国莫纳生物科技有限公司;
旋转蒸发仪:R-501型,上海申顺生物科技有限公司。
1.2 试验方法
1.2.1 小黑药提取与萃取 根据文献[11,17]稍作改动,具体如下:将小黑药粉碎成粉末,与95%乙醇按1∶20(g/mL)混合,45 ℃超声辅助提取30 min。过滤后收集上层清液,重复4次,取上清液用旋转蒸发仪减压浓缩蒸干得小黑药醇提物浸膏。浸膏分散在蒸馏水中,按体积比1∶2依次加入石油醚、乙酸乙酯萃取3次,分别获得石油醚部位、乙酸乙酯部位和水部位,旋转蒸发仪减压浓缩至干。
1.2.2 GSH功能化磁珠的制备
(1)取适量羧基磁性琼脂糖微球(体积分数为10%)于离心管中,磁性分离去除上清液;分别加入去离子水、0.1 mol/L MES缓冲液后混匀洗涤,磁性分离去除上清液,加入适量MES缓冲液混合重悬磁珠;加入20 mg/mL 偶联试剂EDC·HCl溶液,室温振荡30 min;加入1 mg/mL的MES缓冲液溶解的GSSG溶液,室温振荡混合12~16 h,磁性分离去除上清液;反应结束后以20 mmol/L pH 7.4 PBS洗涤4次,以10 mg/mL的浓度储存于4 ℃,即为GSSG功能化磁珠。
(2)取适量10 mg/mL GSSG功能化磁珠加入等体积4 mg/mL PBS缓冲液溶解的三(2-羧乙基)膦(TCEP)溶液进行反应;磁性分离去除上清液后将磁珠用PBS缓冲液洗涤3~5次;洗涤后的磁珠分散于1 mL PBS缓冲液中,即为GSH功能化磁珠(GSH-MNPs)。
1.2.3 小黑药亲电成分的定量表征 配制梯度浓度为0.1,0.2,0.4,0.8,1.6 mg/mL甲萘醌甲醇溶液,各取5.0 mL加入到95.0 mL GSH功能化磁珠溶液中,室温下振荡孵育30 min后,磁性分离,弃去上清液,剩余磁珠快速分散于适量PBS缓冲液中,清洗3~5次后,加入100.0 mL 25.0 mg/mL的FITC溶液继续孵育10 min后,在激发波长469 nm,发射波长523 nm,增益12档条件下,用荧光分光光度计测定上清液荧光值。根据甲萘醌浓度与上清液荧光值,绘制标准曲线。在相同条件下,以10 mg/mL的各极性萃取物的甲醇溶液作为待测样品,检测GSH功能化磁珠与各极性萃取物的甲醇溶液后FITC探针的荧光值,以表征各部位中亲电成分的含量。
1.2.4 小黑药亲电成分的靶向敲出 取GSH功能化磁珠190 mL与10 mL,20 mg/mL的各极性部位萃取物溶液,室温下反应30 min,获得亲电成分敲出后的小黑药石油醚部位(PE-H)、乙酸乙酯部位(AE-H)、水部位(W-H)样品。另取190 μL PBS与10 μL,20 mg/mL的各极性部位萃取物溶液,相同条件下反应,得到未被GSH功能化磁珠孵育后的上清液,得到石油醚(PE-Q)、乙酸乙酯部位(AE-Q)、水部位(W-Q)的对照样品。
1.2.5 小黑药AE和AEH的LC-MS分析 对GSH功能化磁珠处理前后的乙酸乙酯部位样品AE和AEH离心浓缩至干,配制成1.0 mg/mL的甲醇溶液,过0.22 mm滤膜后待LC-MS分析。
(1)液相条件:色谱柱为BEH C18柱(2.1 mm ×100 mm,1.7 mm);柱温45 ℃;进样量10 mL;流动相:A为100%乙腈,B为 0.1%甲酸水溶液;体积流速0.3 mL/min;检测波长200~600 nm。洗脱条件为:0~20 min,5%~100%乙腈;20~25 min,100%乙腈;25~30 min,5%乙腈。
(2)质谱条件:离子源为电喷雾离子源(ESI),扫描方式采用正、负离子模式。脱溶剂气流速700 L/h;脱溶剂气温度400 ℃;毛细管电压3 000 V;锥孔电压30 V;锥孔气速50 L/h;离子源温度100 ℃。
1.2.6 脂肪变性细胞模型的建立 根据文献[18—19]的方法稍作改动,具体如下:称取一定量的油酸钠和棕榈酸钠(摩尔比为2∶1),75 ℃水浴直至完全溶解,配成一定浓度的游离脂肪酸(FFA)溶液,用含无脂肪酸的牛血清白蛋白(d-BSA)的PBS溶液稀释,0.22 mm无菌滤膜过滤待用。FFA终浓度为1.2 mmol/L,d-BSA终浓度为1%,细胞共孵育24 h后,建立脂肪变性细胞模型。
1.2.7 细胞给药分组
(1)对照组:含终浓度为1% d-BSA的DMEM培养基培养。
(2)模型组:含终浓度为1% d-BSA +终浓度为1.2 mmol/L FFA的DMEM培养基培养。
(3)各极性部位萃取物组:含终浓度为1% d-BSA +终浓度为1.2 mmol/L FFA +0.5,1.0,2.0 mg/mL PE-Q、AE-Q、W-Q的DMEM培养基培养。
(4)亲电成分敲出后各极性部位萃取物组:含终浓度为1% d-BSA +终浓度为1.2 mmol/L FFA +0.5,1.0,2.0 mg/mL的PE-H、AE-H、W-H的DMEM培养基培养。
1.2.8 细胞内脂滴累积水平测定 根据文献[19]的方法稍作改动,具体如下:尼罗红粉末溶于DMSO溶液中,配成1.0 mg/mL浓度下的尼罗红染料溶液。取经不同给药处理的96孔板,弃原培养基,PBS清洗1次,加入尼罗红染料溶液,于37 ℃培养箱中染色15 min,弃去尼罗红染料,PBS清洗2次,在激发波长488 nm,发射波长550 nm的条件下,用酶标仪测定荧光值,计算细胞内相对脂滴含量。
1.2.9 细胞内ROS含量检测 取经不同给药处理的96孔板,弃去培养基,PBS洗两遍,加入DCFH-DA荧光探针,于37 ℃培养箱中孵育20 min,PBS清洗3次以充分去除未进入细胞内的DCFH-DA探针,在激发波长488 nm,发射波长525 nm的条件下,用酶标仪检测荧光强度。
1.2.10 细胞内脂代谢、氧化应激指标的测定 将细胞接种于6孔板中,分组给药孵育24 h后,每孔加入适量裂解液裂解细胞,按试剂盒说明书测定细胞裂解液中甘油三酯(TG)、总胆固醇(TC)、丙二醛(MDA)、还原型/氧化型谷胱甘肽(GSH/GSSG)、总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-px),细胞内总蛋白含量按试剂盒说明书测定。
1.2.11 实时荧光定量PCR测定相关基因表达
(1)RNA提取:将对数期的细胞消化后接种于6孔板中,分组给药孵育24 h后,按试剂盒说明书进行细胞样本处理、样本中RNA的提取和产物检测。
(2)RNA反转录成cDNA:按试剂盒说明书进行操作。
(3)实时荧光定量PCR分析:按试剂盒说明书进行操作,内参基因β-actin及目标基因引物序列见表1。

表1 PCR引物序列
1.2.12 统计学处理 应用 SPSS 16.0软件进行统计分析,结果以(平均数±标准差)表示,所有试验均重复3次,组间比较采用单因素方差分析和t检验。
2 结果与分析
2.1 基于GSH功能化磁珠定量表征小黑药亲电成分
为探究小黑药亲电成分对肝细胞脂肪变性的干预作用,首先对小黑药中的亲电成分含量进行表征。前期张潇雨等[20]报道了以游离GSH为探针、甲萘醌为对照物的天然提取物中亲电成分的定量方法,其检测原理为亲电性荧光探针FITC可以与反应体系内亲电成分竞争游离GSH,通过测定未结合FITC的荧光强度表征亲电成分含量。试验以亲和磁珠固定化的GSH代替游离GSH,建立天然提取物中亲电成分的定量方法。试验结果如图1所示,在0.3~1.2 mg/mL的浓度范围内,随着甲萘醌浓度的增加,上清液的荧光值逐渐增加,荧光值与甲萘醌浓度呈现良好的线性关系(R2=0.979 1),表明该方法可用于亲电成分含量的测定。
小黑药醇提物及其各极性部位萃取物经GSH亲和磁珠孵育后上清液的荧光值如图1所示。结果显示,样品上清液的荧光值均高于空白样品,各样品荧光值顺序为乙酸乙酯部位>石油醚部位>小黑药醇提物>水部位。表明小黑药醇提物及其各极性部位萃取物均含有亲电成分,小黑药亲电成分主要集中于乙酸乙酯部位。

图1 不同浓度甲萘醌、小黑药提取物与各极性部位萃取物的荧光值
Figure 1 Fluorescence intensity of different concentrations of menadione, extract and fractions ofXiaoheiyao
2.2 小黑药亲电成分对脂肪变性细胞内脂质累积与ROS生成的影响
基于FFA诱导的HepG2细胞模型分别评价了小黑药各极性萃取物经GSH功能化磁珠靶向敲出亲电成分前后的活性变化,结果如图2、3所示。模型组与对照组相比,细胞内脂质累积量和ROS生成量显著增加(P<0.05),表明给予1.2 mmol/L的FFA成功诱导了HepG2细胞脂肪变性,结果与文献[19-20]报道一致。与模型组相比,不同浓度的小黑药各极性萃取物可以浓度依赖性的降低细胞内脂质累积量和ROS生成量,其中以AE组效果最好。给予2.0 mg/mL AE,细胞内脂质累积量由模型组的(640.8±41.4)%显著降低至(316.1±37.1)%(P<0.05),ROS生成量由模型组的(136.6±6.2)%显著降低至(100.3±5.0)%(P<0.05)。而各极性萃取物中亲电成分被靶向敲出后,各萃取物的降脂活性和抗氧化活性均出现了不同程度的下降,乙酸乙酯部位活性下降幅度最大。在2.0 mg/mL浓度下,乙酸乙酯部位亲电成分被敲出后,AE抑制脂质累积和降低ROS生成的能力显著降低(P<0.05)。上述试验结果表明,小黑药亲电成分具有降低细胞内脂质累积和ROS生成的作用,乙酸乙酯部位的亲电成分干预肝脂肪变性的效果最好,可能与乙酸乙酯部位中亲电成分含量最高有关。

与对照组相比,### 表示P<0.001;与模型组相比,* 表示P<0.05,** 表示P<0.01,*** 表示P<0.001;磁珠孵育前后相比,& 表示P<0.05
图2 小黑药各极性部位萃取物亲电成分对FFA诱导HepG2细胞脂质累积的影响
Figure 2 Effect of electrophilic components from fractions ofXiaoheiyaoon lipid accumulation in FFA-induced HepG2 cells
试验结果显示,小黑药各极性部位萃取物经GSH亲和磁珠靶向敲出亲电成分后仍具有降低脂肪变性细胞ROS生成的作用。贺安娜等[11]的研究表明显脉旋覆花醇提物含有的黄酮、多酚类成分具有清除DPPH、ABTS及超氧阴离子自由基,提高D-半乳糖致衰小鼠肝脏、肾脏及血清抗氧化能力的作用,而多酚、黄酮类成分普遍不具有α,β-不饱和羰基的亲电化合物特征基团。因此,推测小黑药各极性部位萃取物经GSH亲和磁珠靶向敲出亲电成分后,可能是其中的多酚、黄酮类成分发挥了降低脂肪变性细胞ROS水平的作用。研究结果进一步说明了小黑药抗氧化活性成分的多样性,除了多酚、黄酮类直接抗氧化剂,还含有亲电性间接抗氧化剂。
2.3 乙酸乙酯部位亲电成分对脂肪变性肝细胞的干预作用
针对小黑药亲电成分含量最高、干预肝细胞脂肪变性最好的乙酸乙酯部位,进一步探究了其对脂肪变性肝细胞的脂代谢、氧化应激的影响(图4、5)。

与对照组相比,###表示P<0.001;与模型组相比,* 表示P<0.05,** 表示P<0.01,*** 表示P<0.001;磁珠孵育前后相比,& 表示P<0.05
图3 小黑药各极性部位萃取物亲电成分对FFA诱导HepG2细胞ROS生成的影响
Figure 3 Effect of electrophilic components from fractions ofXiaoheiyaoon ROS generation in FFA-induced HepG2 cells

与对照组相比,### 表示P<0.001;与模型组相比,* 表示P<0.05,*** 表示P<0.001;磁珠孵育前后相比,& 表示P<0.05
Figure 4 Effect of electrophilic components from ethyl acetate fraction ofXiaoheiyaoon lipid metabolism in FFA-induced HepG2 cells

与对照组相比,## 表示P<0.01;与模型组相比,* 表示P<0.05,** 表示P<0.01,*** 表示P<0.001;磁珠孵育前后相比,& 表示P<0.05
图5 小黑药乙酸乙酯部位亲电成分对FFA诱导HepG2细胞氧化还原状态的影响
Figure 5 Effect of electrophilic components from ethyl acetate fraction ofXiaoheiyaoon redox state in FFA-induced HepG2 cells
如图4所示,模型组与对照组相比,细胞内TG和TC含量显著上升(P<0.05);AE组、AEH组与模型组相比,细胞内TG和TC水平出现不同程度下降;AEH组细胞内TG和TC含量均高于相应给药浓度的AE组,给药浓度为2 mg/mL时,AEH组细胞内的TG含量与AE组相比显著性降低(P<0.05),但AEH组细胞内TC含量与AE组相比没有显著性降低(P>0.05)。以上结果表明小黑药乙酸乙酯部位的亲电成分可降低脂肪变性肝细胞内TG和TC的积累,并且降低TG积累活性优于降低TC积累活性。
小黑药亲电成分对脂肪变性细胞的氧化还原稳态的影响结果如图5所示。模型组与对照组相比,细胞内MDA含量显著上升(P<0.05),而反映抗氧化能力的T-AOC、GSH/GSSG和抗氧化酶活力的SOD、CAT、GSH-px出现显著下降(P<0.05);细胞给予不同浓度的AE和AEH后,FFA诱导的HepG2细胞氧化还原水平均出现不同程度的改善;对比AE组与AEH组,特别是在2 mg/mL浓度下,除GSH-px外,亲电成分靶向敲出前后细胞内MDA、T-AOC、GSH/GSSG、SOD、CAT水平均具有显著性差异(P<0.05)。试验结果表明,小黑药乙酸乙酯部位亲电成分通过提高细胞内源性抗氧化物质与抗氧化酶的水平,调节脂肪变性肝细胞的细胞氧化还原稳态。
2.4 乙酸乙酯部位亲电成分对氧化还原稳态与脂代谢相关基因表达的影响
氧化应激在NAFLD发生发展中扮演了重要角色,如损伤线粒体的正常功能(包括线粒体呼吸链活性和脂肪酸β-氧化能力)[21],致使细胞内脂质合成与分解失衡[22],最终导致细胞脂肪变性。膳食源亲电成分是一类可通过上调Nrf2信号通路,调控细胞内源性抗氧化酶表达的间接抗氧化剂[7],具有潜在的NAFLD干预作用。在揭示小黑药亲电成分对FFA诱导HepG2细胞的脂代谢、氧化还原稳态调控的基础上,进一步分析了乙酸乙酯部位中亲电成分对相关基因表达的影响。
小黑药乙酸乙酯部位亲电成分对氧化还原稳态相关基因表达的影响结果如图6所示。AE组与AEH组氧化还原稳态相关基因Nrf2、NQO1、GCLC的表达具有显著性差异(P<0.05),HO-1的表达虽有差异,但并不显著(P>0.05),表明小黑药乙酸乙酯部位中亲电成分发挥抗氧化活性主要与Nrf2、NQO1、GCLC表达上调有关。已有研究表明HO-1、NQO1和GCLC在调控肝脏ROS水平方面发挥着重要的作用,且HO-1、NQO1和GCLC受Nrf2-Keap1通路调控[23],其他抗氧化酶如SOD、CAT等也受到Nrf2-Keap1通路调控[24],生姜中的花姜酮、萝卜中的天然炔醇为天然亲电化合物,均已被报道可通过激活Nrf2-Keap1通路调节下游抗氧化酶和二相解毒酶的表达[8-9],提示小黑药乙酸乙酯部位中亲电成分发挥抗氧化活性可能与通过激活Nrf2-Keap1信号通路进而显著上调NQO1、GCLC的表达有关。小黑药乙酸乙酯部位亲电成分对脂代谢相关基因表达的影响结果如图7所示。AE组与AEH组细胞脂代谢相关基因表达存在差异,其中脂质合成相关基因SREBP1c、ACC1的表达差异显著(P<0.05)、FAS的表达差异不显著(P>0.05),而脂质氧化分解相关基因PPARα的表达差异显著(P<0.05)、CPT1A的表达差异不显著(P>0.05),表明小黑药乙酸乙酯部位亲电成分主要通过降低脂质合成相关基因和提高脂质氧化分解相关基因的表达调节细胞内脂代谢水平。SREBP1c是肝脏主要调节脂质合成的重要转录因子,其下游涉及FAS、ACC1等基因的调节,已有研究[25]表明Nrf2可以负反馈SREBP1c、PPARα进而影响下游脂合成基因的表达,亦有研究[26]指出Nrf2敲除鼠脂肪酸合成酶FAS和硬脂酰辅酶A去饱和酶SCD等脂质合成相关酶表达水平明显提高,提示小黑药乙酸乙酯中的亲电成分可能通过上调Nrf2的表达,下调SREBP1c和ACC1表达,降低脂质过量合成,上调PPARα表达,增加脂质氧化分解,进而降低细胞内脂质的累积。综合上述研究结果,小黑药亲电成分可能通过激活Nrf2细胞信号途径上调抗氧化酶的表达,同时抑制脂质合成和促进脂质氧化分解,从而调节FFA诱导的肝细胞氧化应激和脂代谢异常。
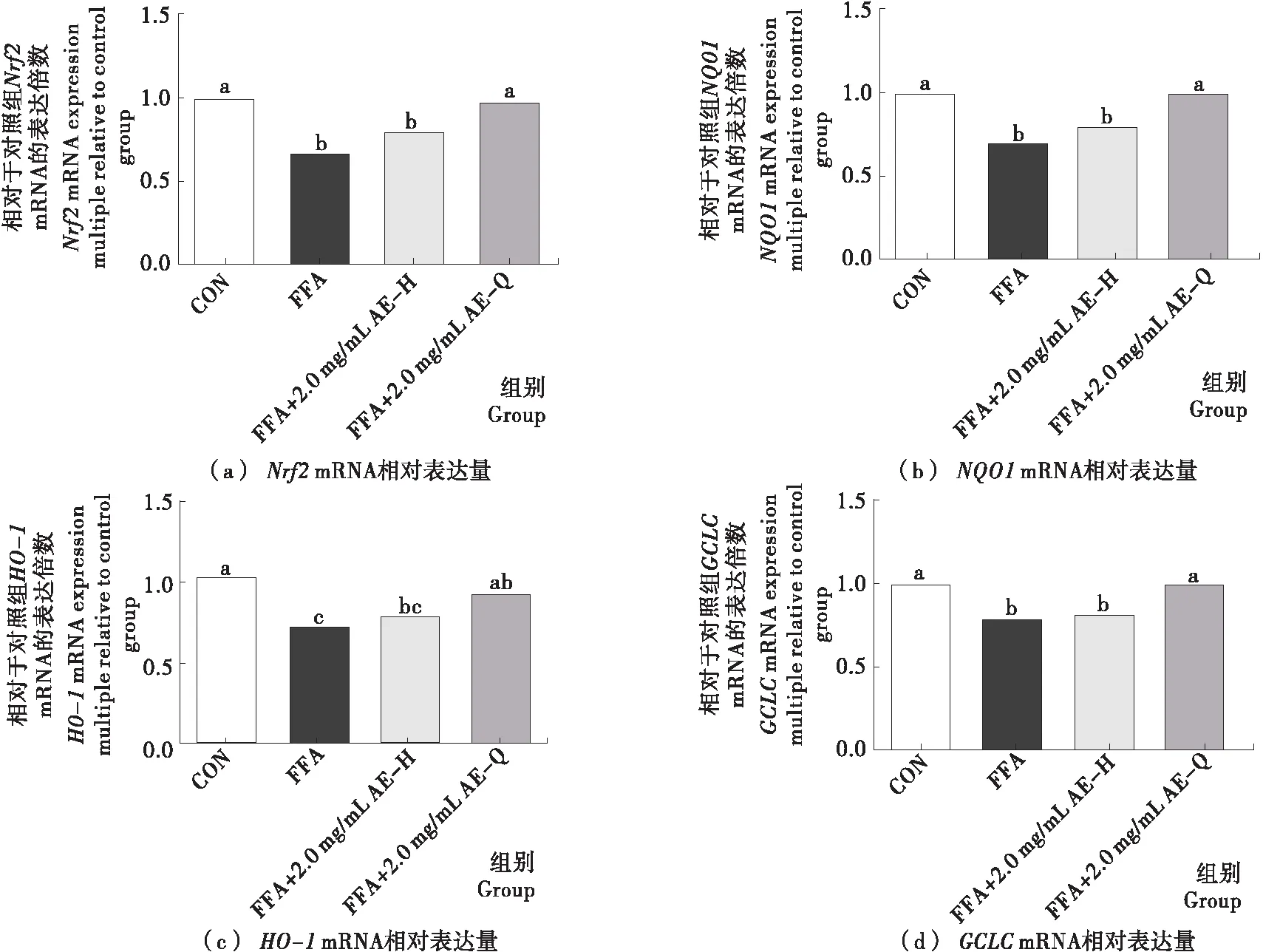
字母不同表示差异性显著(P<0.05)
Figure 6 Effect of electrophilic components from ethyl acetate fractions ofXiaoheiyaoon expression of Nrf2 pathway related genes in FFA-induced HepG2 cells
2.5 小黑药乙酸乙酯部位中亲电成分分析
基于小黑药各萃取部位中亲电成分含量与活性的比较,选取亲电成分含量最丰富、肝细胞脂肪变性干预作用最好的乙酸乙酯部位,采用LC-MS分析,比较亲电成分靶向敲出前后质谱的变化,从而表征乙酸乙酯部位中的亲电成分,结果如图8所示。对比正、负离子模式下的总离子流图各峰形,发现有7个变化的峰,对应的保留时间分别为4.03,7.49,7.87,8.44,9.93,16.98,19.93 min。分析其在正负离子模式下的准分子离子峰,显示1~7号离子流信号对应的分子量分别为472,292,426,370,428,420,248。通过高分辨信号推导和前期小黑药植物化学研究结果[14]23-56,推测2号峰为Nervolan B,3号峰为Nervoyan C,6号峰为Vanclevic acid methyl ester,7号峰为Tomentosin。其中Nervolan B和Tomentosin具有α,β-不饱和羰基结构,为亲电化合物,而Nervoyan C和Vanclevic acid methyl ester具有丙烯醇结构,为弱亲电化合物。

字母不同表示差异性显著(P<0.05)
Figure 7 Effect of electrophilic components from ethyl acetate fractions ofXiaoheiyaoon expression of lipid metabolism related genes in FFA-induced HepG2 cells

图8 小黑药乙酸乙酯部位经GSH功能化磁珠孵育前后成分的总离子流图
3 结论
针对小黑药亲电成分及其干预脂肪变性作用尚未明确的现状,结合亲电成分靶向敲出技术、体外肝细胞脂肪变性模型评价方法,研究发现小黑药含有亲电成分,主要分布在乙酸乙酯部位;小黑药亲电成分具有降低FFA诱导的HepG2细胞内脂质累积、氧化应激的作用,其中乙酸乙酯部位活性最佳,其活性机制为小黑药亲电成分通过激活Nrf2-Keap1信号通路上调下游抗氧化、脂质氧化分解基因的表达和下调脂合成基因的表达,小黑药中亲电化合物可以改善脂肪酸诱导的脂肪变性,其机制与抗氧化和脂代谢相关基因的调节有关。此外,通过LC-MS表征初步从乙酸乙酯部位中发现7个明显变化的质谱峰,这些质谱峰对应化合物的确切结构尚未完全揭示,需要通过核磁共振等手段进一步确定。
