单糖对莲子淀粉回生特性的影响
2020-05-14陈悦宇欧雨嘉曾红亮郑宝东
陈悦宇 - 欧雨嘉 - 曾红亮 - 张 怡 郑宝东 -
(1.福建农林大学食品科学学院,福建 福州 350002;2.福建省特种淀粉品质科学与加工技术重点实验室,福建 福州 350002)
莲子是中国的特产经济作物,淀粉含量高达50%(干基),尤其直链淀粉含量高,易于老化回生,严重影响莲子产品的持水性、质构等品质特性[4-5]。林鸳缘[6]研究葡萄糖和果糖等对莲子淀粉糊化特性的影响,结果表明,与果糖相比,葡萄糖—淀粉体系的回生值更低,冷稳定性更好。然而,目前葡萄糖和果糖对莲子淀粉回生特性影响的研究鲜见报道。另外,淀粉回生的研究方法包括流变法、热分析法、X射线以及光谱分析(如红外光谱、核磁共振)等[7]29。其中,X射线、红外光谱以及核磁共振技术能够从结构特性方面表征淀粉的回生程度,但是,这类技术很少应用于糖类对淀粉回生影响的研究中。
试验拟以莲子淀粉为研究对象,采用X-射线衍射、核磁共振以及傅里叶红外光谱研究单糖(葡萄糖和果糖)对莲子淀粉晶体结构、双螺旋结构以及短程有序结构等结构特性的影响,以探讨葡萄糖和果糖对莲子淀粉回生特性的影响,进一步通过凝胶渗透色谱分析不同复合体系分子量的差异性,以期为糖类影响淀粉回生及其作用机理的研究提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜冻莲:绿田(福建)食品有限公司,用于提取莲子淀粉(参照Zhang等[8]的方法);
葡萄糖、果糖:国药集团化学试剂有限公司。
1.2 试验仪器
高压灭菌器:SYQ-DSX-280B型,上海申安医疗机械厂;
数显电热鼓风干燥箱:101-0ES型,济南金光仪器设备制造有限公司;
单室真空包装机:DZQ400/2D型,温州市新达包装机械有限公司;
摇摆式粉碎机:BZFS-04C型,西安宝正实业公司;
X-射线衍射仪:X’ Pert Pro MPD X型,荷兰 Philips 仪器有限公司;
核磁共振光谱仪:AVIII 400 MHz WB型,德国Bruker公司;
傅里叶红外光谱仪:Nicolet 360型,美国Thermo Nicolet公司。
1.3 试验方法
1.3.1 样品制备 以蒸馏水为溶剂,分别配制5 g/100 mL葡萄糖和果糖水溶液,随后添加10 g/100 mL 莲子淀粉,并在室温下混合搅拌30 min。以不添加单糖的莲子淀粉为对照,搅拌均匀后装于真空袋中,进一步将莲子淀粉及其单糖混合溶液置于沸水浴加热预糊化处理2 min,随即采用121 ℃压热处理溶液15 min,冷却至室温后,分别在4 ℃下贮藏0,1,7 d,所制备的回生样品经冷冻干燥、粉碎、过100目筛后,置于干燥器皿中待用。
样品编号:RLS、RLS1、RLS7分别表示压热处理后未回生、回生1 d和7 d的莲子淀粉;RLS+Glu0、RLS+Glu1、RLS+Glu7分别表示葡萄糖存在下压热处理后未回生、回生1 d和7 d的莲子淀粉;RLS+Fru0、RLS+Fru0、RLS+Fru0分别表示果糖存在下压热处理后未回生、回生1 d和7 d的莲子淀粉。
1.3.2 X射线衍射图谱测定 所制备的莲子淀粉回生样品采用X-射线衍射仪进行测定,参照Zeng等[9]的方法。测定条件:X-射线发生器管压40 kV,电流30 mA,发射狭缝0.25 nm,铜Kα射线,扫描角度2θ5°~45°,扫描速度0.02°/min,扫描方式为连续扫描。数据采用Jade 5.0进行处理,参照赵本山等[10]的研究方法分析结晶区、亚结晶区和结晶度,计算公式:
(1)
(2)
(3)
式中:
Ps1——结晶区,%;
PS2——亚结晶区,%;
C——结晶度,%;
S1——结晶区面积;
S2——亚结晶区面积;
Sa——无定形区面积。
1.3.313C CP/MAS固体核磁波谱测定 取200~300 mg淀粉样品采用13C CP/MAS固体核磁共振技术扫描,参照陈钏杰[11]的方法略作修改,试验条件:13C共振频率100.63 MHz,采集时间0.025 s,接触时间1.8 ms,魔角旋转转速6 kHz。数据采用MestReNova软件进行处理。其中,淀粉无定形区的特征峰C4峰相对占比的计算公式:
(4)
式中:
PC4——C4峰相对占比,%;
SCi——Ci峰拟合的相对面积。
1.3.4 红外光谱测定 采用傅立叶红外光谱仪对所制备的莲子淀粉回生样品进行扫描测定。将淀粉样品和溴化钾于105 ℃烘箱中干燥至衡重后,称取20 mg淀粉样品和1 000 mg 溴化钾置于玛瑙研钵中,在红外灯下研磨均匀,压片后红外光谱扫描。测定条件:扫描波长400~4 000 cm-1、扫描次数32、分辨率4 cm-1[12]。
1.3.5 凝胶渗透色谱分析 采用凝胶渗透色谱分析样品的分子量。精确称取0.05 g样品于50 mmol/L DMSO(LiBr)溶液中,定容至25 mL;将溶液90 ℃加热并磁力搅拌2 h,随后25 ℃搅拌24 h至样品完全溶解,12 000×g离心20 min后取上清液过0.45 μm微孔滤膜即得进样样品。测定条件:Shodex P851-806色谱柱,柱温50 ℃;Water WISH-01进样器,进样量1 mL;Shodex RI-101示差检测器,温度38 ℃,波长664.1 nm;流动相含有50 mmol/L DMSO(LiBr)溶液,流速0.35 mL/min;折光指数增量dn/dc=0.066[13]。数据分析采用ASTRA 6.1软件。
1.4 数据处理
试验结果以平均值±标准差表示,采用 DPS 9.50数据分析软件单因素方差分析LSD法分析数据差异,显著性水平P<0.05。
2 结果与分析
2.1 单糖对莲子淀粉X射线衍射图谱的影响
无序的淀粉分子重结晶形成有序态结构的现象称为淀粉回生,其重结晶过程可以通过X射线衍射进行表征[14-15]。单糖(葡萄糖和果糖)对莲子淀粉X射线衍射图谱的影响如图1所示。结果表明,未回生的莲子淀粉在2θ为15.01°,17.04°,22.76°时出现强衍射峰,回生1 d和7 d时,莲子淀粉在2θ为15.01°处的衍射峰迁移至14.71°,并且在2θ为19.68°,23.82°处均出现新增的弱衍射峰,表明回生的莲子淀粉为B型晶体结构[8]。添加葡萄糖和果糖后,未回生的莲子淀粉主要衍射峰为2θ16.82°和19.52°;回生1 d和7 d时,复合物的衍射图谱与单一的莲子淀粉相似,其中葡萄糖与淀粉复合体系的衍射峰2θ23.86°在回生7 d时才出现,可能是因葡萄糖能够抑制莲子淀粉B-型晶体结构的形成导致的。
单糖对莲子淀粉结晶度的影响,如表1所示。结果表明,莲子淀粉的结晶度随着回生时间的增加而增加(P<0.05),回生0~1 d莲子的淀粉结晶度增加幅度远大于回生1~7 d莲子的。这可能是由淀粉短期回生和长期回生的速率的快慢引起的,其短期回生主要由直链淀粉的快速重结晶引起的,回生速率较快,通常十几小时内即可完成;而淀粉长期回生则是由支链淀粉的长期重结晶所致,回生速率较慢,回生时间以天计,甚至长达几周以上[16]。
添加葡萄糖后,莲子淀粉的结晶度显著低于单一的莲子淀粉,回生1 d后莲子淀粉的重结晶速度便显著降低,回生1 d和7 d样品间结晶度的差异不显著(P>0.05)。
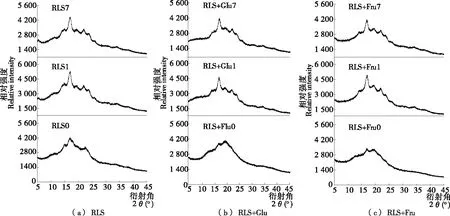
图1 单糖对莲子淀粉X射线衍射图谱的影响
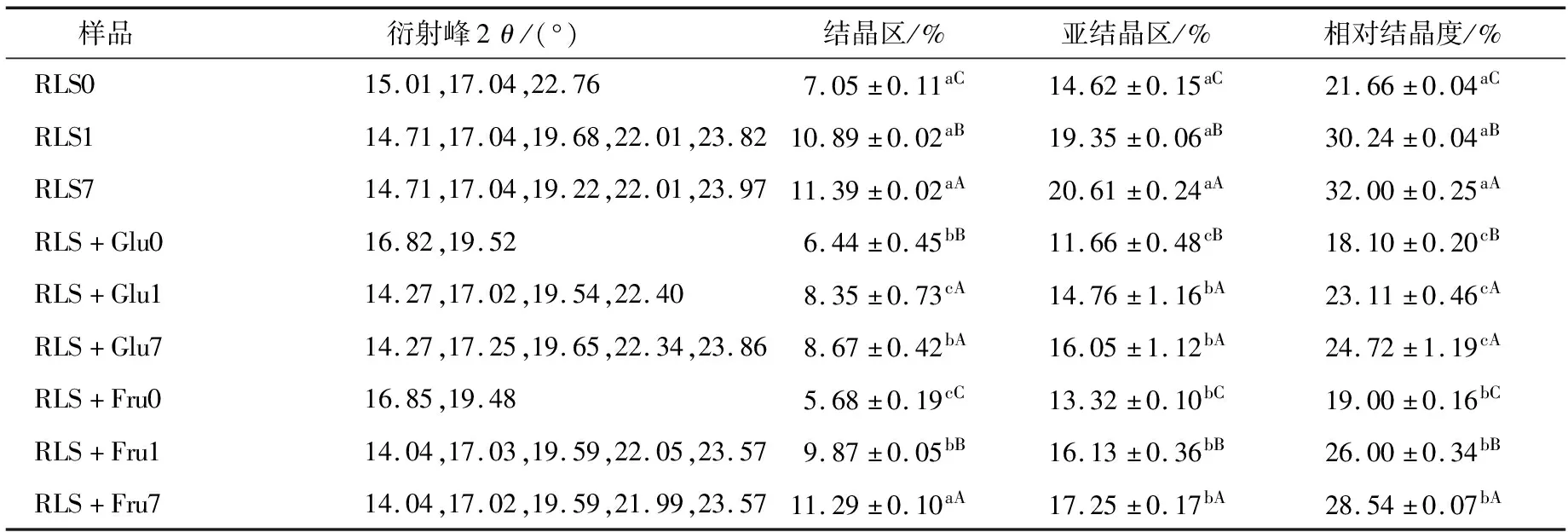
表1 单糖对莲子淀粉结晶度的影响†
† 小写字母不同代表不同样品同一贮藏时间的相关指标数据差异显著,P<0.05;大写字母不同代表同一样品不同贮藏时间的相关指标数据差异显著,P<0.05。
同样,添加果糖后,莲子淀粉的结晶度显著低于单一的莲子淀粉,但其作用效果弱于葡萄糖,回生1 d和7 d样品间结晶度的差异显著(P<0.05)。由此说明,葡萄糖和果糖均能抑制莲子淀粉重结晶从而延缓淀粉回生,葡萄糖抑制淀粉回生作用的效果高于果糖。该结果与马红静[17]的研究报道相似,从糊化和质构特性分析,小分子糖对糯米淀粉凝胶老化的抑制效果为海藻糖>蔗糖>葡萄糖>果糖。目前普遍认为,糖类对淀粉回生的抑制作用可能在于:① 糖分子与淀粉分子链的相互作用能够稳定淀粉基质,延缓淀粉重结晶;② 糖分子与水分子之间的相互作用,影响淀粉重结晶所需的水分子,从而抑制淀粉回生[1,18]。葡萄糖对莲子淀粉结晶区(由结晶线度较大的高级微晶构成)和亚结晶区(结晶线度较小的初级微晶)均有显著的抑制效果(P<0.05),而果糖对莲子淀粉结晶区形成的抑制作用较弱,甚至对长期回生莲子淀粉的结晶区形成影响不显著(P>0.05),可能是葡萄糖和果糖影响莲子淀粉回生差异的原因之一。另外,葡萄糖和果糖影响莲子淀粉回生差异也可能是由不同类型糖分子与水分子间相互作用引起的。葡萄糖和果糖分子上平伏羟基可以与相邻的水分子形成氢键作用,其平伏羟基数目分别为4.56和2.62[19-20]。这使得葡萄糖与水分子间相互作用高于果糖与水分子间的,阻碍水分子的运动,可能导致葡萄糖—淀粉体系中重结晶所需的水分减少,引起体系中淀粉回生程度较低。此外,研究[6]表明,葡萄糖和果糖引起莲子淀粉体系黏度增加,葡萄糖的增黏作用较小,显示了更好的稳定性。由此可见,体系黏度的变化也可能是影响淀粉回生的关键因素。
2.2 单糖对莲子淀粉固体核磁共振波谱的影响
采用13C CP/MAS固体核磁共振波谱分析单糖对莲子淀粉分子结构的影响,结果如图2所示。从图2可以看出,莲子淀粉及其单糖复合物的核磁共振波谱相似,回生时间对莲子淀粉核磁共振波谱的影响主要在于C1区106~96的化学位移(详见表2)。淀粉核磁共振波谱C1区可以反映其晶体类型,A-型晶体在102,101,100 处出现3个峰;B-型晶体在101,100处出现2个峰;C-型晶体结构由A-型和B-型晶体构成,可表现为双峰或者三峰,取决于不同类型晶体含量的高低[21-22]。对于C型晶体结构的莲子原淀粉而言,其C1振动区在101.60,100.35,99.60处出现3个峰[23]。压热法处理后未回生的莲子淀粉在C1区3重结晶峰结构消失,在103.09出现振动峰,而104~102出现C1的多样性峰可能与晶体区的单螺旋结构或无定型区的分布有关[24-25]。说明压热处理严重破坏了莲子淀粉的晶体结构,具有单螺旋结构的直链淀粉分子浸出,淀粉分子处于无序态。回生时间的增加至1 d,莲子淀粉在C1区的振动峰103.09偏移至102.95处,在101.22,100.02处出现新增的B-型晶体的特征振动峰,说明在冷藏过程中莲子淀粉分子重结晶(回生)形成B-型晶体结构。回生7 d时,C1区峰位发生一定的偏移但无新增振动峰,分别为102.78,101.11,100.05,说明回生时间并未影响莲子淀粉的晶体结构类型。
与单一的莲子淀粉相比,添加葡萄糖和果糖时未回生的莲子淀粉在C1区除了新增103.10附近振动峰,还分别保留了B型晶体结构在100.33和99.69处的振动峰。说明葡萄糖和果糖可在一定程度上保护莲子淀粉晶体结构不被高温破坏。张珊等[2]在小分子糖对木薯淀粉晶体结构和糊化特性影响的研究中也发现,葡萄糖和果糖能够稳定淀粉的结晶区,引起淀粉糊化温度和糊化焓提高。淀粉的C4区可以反映其无定形区含量的高低,对比不同单糖对莲子淀粉C4峰相对占比PC4的影响,如表2所示,随着回生时间的增加,莲子淀粉的PC4增加显著降低(P<0.05),表明随着淀粉回生其结晶度增加,无定形区占比减少。与单一的莲子淀粉相比,葡萄糖和果糖导致莲子淀粉的PC4增加(P<0.05),且葡萄糖的作用效果高于果糖;说明葡萄糖和果糖添加尤其是葡萄糖能够使得莲子淀粉无定形区含量增加,与其结晶区和亚结晶区占比减少有关,与X射线衍射测定的结果相一致。
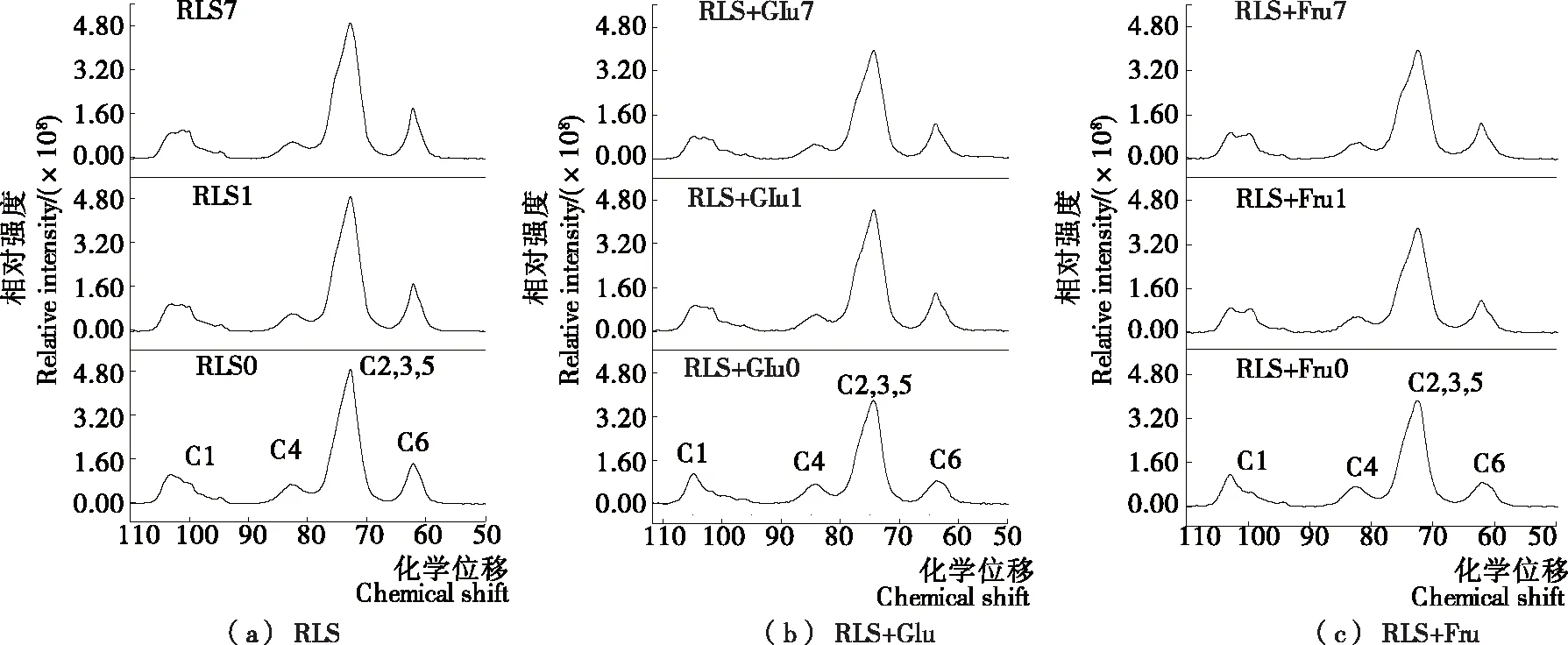
图2 单糖对莲子淀粉13C CP/MAS固体核磁波谱的影响
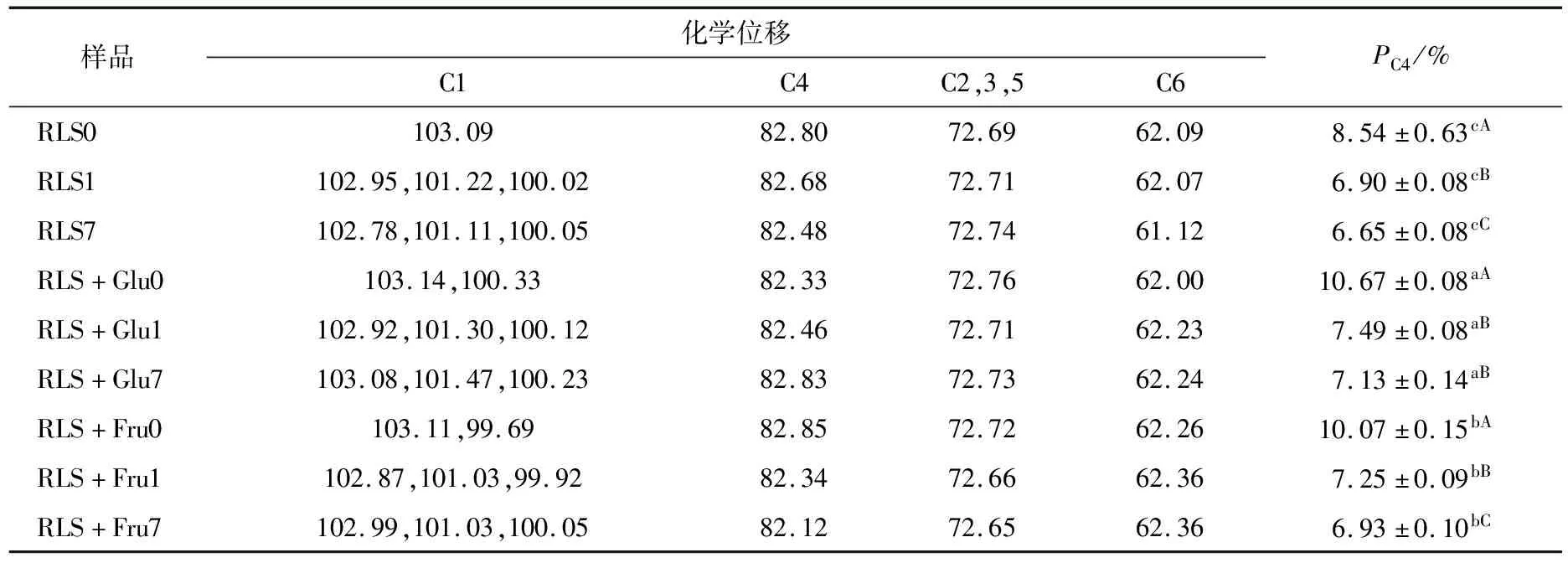
表2 单糖对莲子淀粉化学位移与C4峰相对占比的影响†
† 小写字母不同代表不同样品同一贮藏时间的数据差异显著,P<0.05;大写字母不同代表同一样品不同贮藏时间的数据差异显著,P<0.05。
2.3 单糖对莲子淀粉红外光谱的影响
采用傅里叶红外光谱研究单糖对莲子淀粉分子结构的影响,结果如图3所示。结果表明,葡萄糖和果糖添加后莲子淀粉红外光谱与单一莲子淀粉的相似,没有发现差异性特征峰,说明葡萄糖和果糖对莲子淀粉的改性属于物理改变。
对于淀粉的红外光谱,波谱带1 047 cm-1吸收峰对淀粉的晶体结构十分敏感,1 022 cm-1吸收峰与淀粉的无定形结构密切相关,1 047,1 022 cm-1吸收峰强度的比值R1 047/1 022能够反映淀粉的晶体结构(短程有序结构),被认为与淀粉老化程度密切相关[26-27]。单糖对莲子淀粉R1 047/1 022值影响的结果如表3所示,结果显示:随着回生时间的增加,莲子淀粉及其单糖复合物的R1 047/1 022值显著提高(P<0.05),是由于淀粉回生引起体系短程有序结构的增加。添加葡萄糖和果糖后,莲子淀粉复合体系的R1 047/1 022值显著降低(P<0.05),葡萄糖—莲子淀粉体系的R1 047/1 022值相较于果糖—莲子淀粉体系更低。该结果与X射线衍射测定的结晶度和核磁共振测定的PC4结果相一致,表明葡萄糖和果糖能够抑制莲子淀粉短程有序结构的形成,延缓淀粉老化程度,相比之下葡萄糖的抑制作用更佳。正如2.1中所论述的,葡萄糖和果糖对淀粉回生抑制作用的强弱的原因与其和水分子间相互作用的差异有关。张晓宇[7]35对于小分子糖(海藻糖、蔗糖和葡萄糖)影响木薯淀粉红外光谱的研究结果显示,同样冷藏条件下的R1 047/1 022值大小顺序如下:不含糖淀粉胶>含葡萄糖淀粉胶>含蔗糖淀粉胶>含海藻糖淀粉胶,表明海藻糖、蔗糖和葡萄糖均能抑制木薯淀粉的老化,且抑制能力依次减小,与三者所带的平伏羟基数目不同(海藻糖8.00个,蔗糖6.30个,葡萄糖 4.56个)有关。
图3 单糖对莲子淀粉红外光谱的影响
表3 单糖对莲子淀粉分子有序结构R1 047/1 022与R995/1 022值的影响†
Table 3 Effects monosaccharide on the ordered structure ofR1 047/1 022andR995/1 022values of lotus seed starch
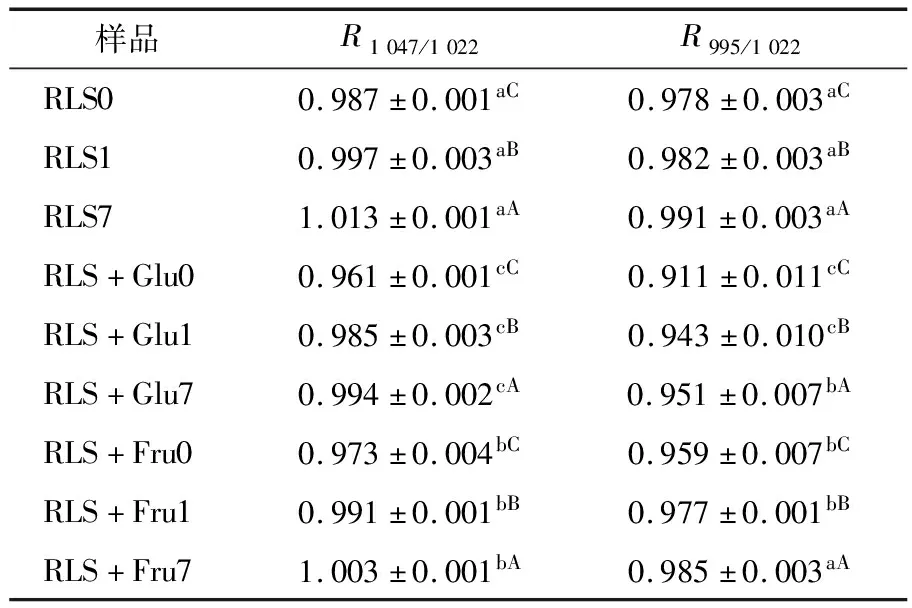
样品R1047/1022R995/1022RLS00.987±0.001aC0.978±0.003aCRLS10.997±0.003aB0.982±0.003aBRLS71.013±0.001aA0.991±0.003aARLS+Glu00.961±0.001cC0.911±0.011cCRLS+Glu10.985±0.003cB0.943±0.010cBRLS+Glu70.994±0.002cA0.951±0.007bARLS+Fru00.973±0.004bC0.959±0.007bCRLS+Fru10.991±0.001bB0.977±0.001bBRLS+Fru71.003±0.001bA0.985±0.003aA
† 小写字母不同代表不同样品同一贮藏时间的相关指标数据差异显著,P<0.05;大写字母不同代表同一样品不同贮藏时间的相关指标数据差异显著,P<0.05。
波谱带995 cm-1则与 C-6处羟基的分子内氢键有关,能够反映水合晶体的吸收振动[26]。相较于R1 047/1 022,995,1 022 cm-1吸收峰强度的比值R995/1 022值更能够反映淀粉的螺旋结构[8,28]。单糖对莲子淀粉R995/1 022值影响的结果与R1 047/1 022值相似(详见表3),莲子淀粉R995/1 022值随着回生时间的增加而增加(P<0.05),表明体系中淀粉分子链回生过程中重组形成双螺旋结构。除了回生7 d的莲子淀粉与果糖复合体系,莲子淀粉与葡萄糖、果糖复合体系的R995/1 022值均低于单一的莲子淀粉(P<0.05)。说明葡萄糖和果糖能够抑制莲子淀粉双螺旋结构的形成,果糖对长期回生过程中莲子淀粉双螺旋结构的形成无明显的抑制作用,与其对淀粉回生程度的影响高度一致。
2.4 单糖对莲子淀粉分子量的影响
采用凝胶渗透色谱分析单糖对莲子淀粉分子量的影响,结果如表4所示。添加葡萄糖后,莲子淀粉复合物的分子量Mw、Mn以及分散系数Mw/Mn均高于单一的莲子淀粉。一般地,高分子量淀粉链在空间上重聚合成双螺旋状结构的难度高于低分子量淀粉链,使得低分子量淀粉链比高分子量淀粉链更易于回生[29]。基于此,推测葡萄糖与水分子的相互作用,葡萄糖添加引起莲子淀粉分子量的增大也是其抑制回生的关键因素。添加果糖后,莲子淀粉复合物的分子量Mw、Mn以及分散系数Mw/Mn均低于单一的莲子淀粉,可能是上述红外R995/1 022值结果中果糖对长期回生过程中莲子淀粉双螺旋结构的形成无明显的抑制作用的因素之一。理论上,莲子淀粉—果糖复合体系中低分子链淀粉链相比于单一的莲子淀粉更易于回生。然而,试验结果显示,这种低分子量特性对于该体系淀粉回生的影响并不占主导作用,具体的原因有待进一步研究。
表4 单糖对莲子淀粉分子量的影响†
Table 4 Effects monosaccharide on the molecular weight of lotus seed starch
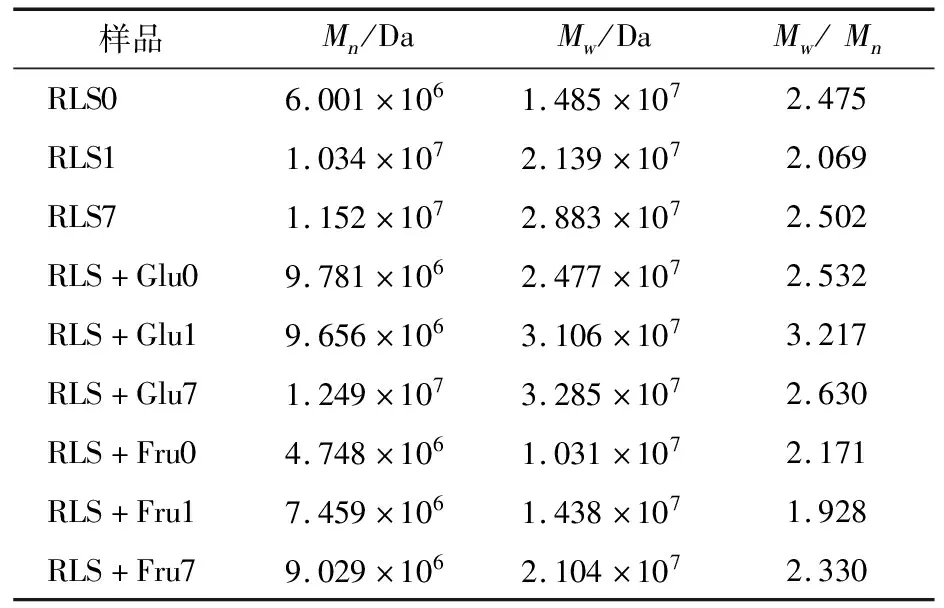
样品Mn/DaMw/DaMw/MnRLS06.001×1061.485×1072.475RLS11.034×1072.139×1072.069RLS71.152×1072.883×1072.502RLS+Glu09.781×1062.477×1072.532RLS+Glu19.656×1063.106×1073.217RLS+Glu71.249×1073.285×1072.630RLS+Fru04.748×1061.031×1072.171RLS+Fru17.459×1061.438×1071.928RLS+Fru79.029×1062.104×1072.330
†Mn数均分子量,Mw重均分子量,Mw/Mn分子的多分散指数。
3 结论
基于结构特性的分析结果表明葡萄糖和果糖对压热处理下莲子淀粉的晶体结构具有保护作用,同时能够抑制回生过程中莲子淀粉重结晶、分子双螺旋结构和短程有序结构的形成,表现出良好的抗老化能力。葡萄糖和果糖抑制淀粉回生的效果为葡萄糖>果糖,可能不同类型糖分子与水分子间相互作用的差异以及葡萄糖促进淀粉分子量增加等因素有关。在老化过程中单糖与莲子淀粉相互作用的机制尚未明确,未来可以通过分子模拟技术开展相关的研究。
