细菌脂多糖通过MAPK/ERK1/2信号通路影响成骨细胞活性和凋亡
2020-05-13刘士波薛鑫鑫高云峰付世杰
孙 勃 刘士波 王 培 薛鑫鑫 高云峰 付世杰
(承德医学院附属医院手足外科,承德 067000)
近年来,骨质疏松和骨折患者的发病率不断升高,骨愈合需要比较长的周期,因此促进骨愈合对于骨质疏松和骨折患者的治疗具有重要意义。由感染所致的内毒素血症以及创伤引起的骨感染均可造成骨坏死,感染性骨坏死是骨科领域研究的难点和热点问题。但感染性骨坏死的机制尚不十分清楚,因此探讨骨坏死的机制对早期预防和治疗骨坏死具有重要意义。细菌脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌主要的致病成分,可引起组织细胞的功能紊乱,研究发现LPS可影响成骨细胞的增殖、分化和凋亡,延迟骨愈合[1,2]。MAPK/ERK1/2信号通路在成骨细胞的增殖、分化和凋亡中发挥重要作用,通过调控MAPK/ERK1/2信号通路可促进成骨细胞增殖和分化,抑制成骨细胞凋亡[3-5]。本文通过研究LPS对成骨细胞活性和凋亡以及MAPK/ERK1/2信号通路的影响,探讨LPS是否通过MAPK/ERK1/2信号通路影响成骨细胞活性和凋亡。
1 材料与方法
1.1材料 小鼠前体成骨细胞株MC3T3-E1(美国ATCC公司),LPS、Hochest 33258(美国Sigma公司),DEME/F12培养基、胎牛血清(美国Hyclone公司),ERK1/2激酶抑制剂U0126(德国Merck公司),噻唑蓝(MTT)、Annexin V-FITC细胞凋亡检测试剂盒、碱性磷酸酶(ALP)和骨钙素(BGP)活性测定试剂盒(美国invitrogen公司),兔抗鼠C-Caspase 3单克隆抗体、兔抗鼠Bcl-2单克隆抗体、兔抗鼠Bax单克隆抗体、兔抗鼠ERK1/2单克隆抗体、兔抗鼠p-ERK1/2单克隆抗体、辣根过氧化物酶标记的羊抗兔二抗等(美国Gibco公司)等。
1.2方法
1.2.1细胞培养 将MC3T3-E1细胞接种到DEME/F12培养基(含10%胎牛血清、1%青霉素-链霉素)的96孔板中培养,3 d进行1次换液,细胞生长至80%以上融合时进行传代培养(传代比例1∶2)。
1.2.2细胞分组和处理 将第3代生长良好的MC3T3-E1细胞随机分为对照组、LPS组、LPS+U0126组,对照组不给予LPS处理,LPS组待细胞达65%贴壁生长时添加10 mmol/L LPS(研究证实LPS对成骨细胞的影响呈剂量和时间依赖性,本文参考相关文献[6,7]选择LPS剂量为10 mmol/L、作用24 h进行研究),LPS+U0126组待细胞达65%贴壁生长时添加10 mmol/L LPS和25 μmol/L ERK1/2激酶抑制剂U0126,继续培养24 h。
1.2.3采用MTT比色法测定细胞活性 将3组处理后的MC3T3-E1细胞置于DEME/F12培养基中培养,每组设7个复孔,培养24 h,加入5 mg/ml的MTT 20 μl培养4 h,移去上清液,加入二甲基亚砜100 μl振荡10 min溶解结晶,继续培养至气泡溶解,采用酶标仪测定每孔570 nm波长处吸光度值,以吸光度值表示MC3T3-E1细胞活性。
1.2.4流式细胞术测定细胞凋亡 将3组处理后的MC3T3-E1细胞经离心、收集、漂洗,加入Binding Buffer 100 μl制成细胞悬液,加入Annexin V-FITC 5 μl 混匀,再加入PI染色液10 μl孵育15 min,加入Binding Buffer定容到500 μl,上机,每份收集10 000个MC3T3-E1细胞计算凋亡细胞所占比例。实验重复7次。
1.2.5成骨活性指标ALP和BGP活性测定 取3组处理过的MC3T3-E1细胞,采用硝基苯磷酸二钠基质动力学法测定ALP活性;采用放射免疫法测定BGP活性。
1.2.6采用Hochest 33258染色观察细胞核形态 将3组MC3T3-E1细胞爬片放置到6孔板中,每孔2×105个细胞,培养至细胞达70%融合后,对照组不加入LPS处理,LPS组加入10 mmol/L LPS,LPS+U0126组加入10 mmol/L LPS和25 μmol/L ERK1/2激酶抑制剂U0126,培养12 h,弃去培养基,PBS冲洗,加入多聚甲醛固定30 min,PBS冲洗,用Hochest 33258染液5 μg/ml覆盖细胞爬片染色10 min,PBS漂洗,取出细胞爬片,在荧光显微镜下拍照观察细胞核形态。
1.2.7采用Western blot测定细胞C-Caspase 3、Bax、Bcl-2、ERK1/2、p-ERK1/2蛋白水平 将3组MC3T3-E1细胞接种到培养皿中,待细胞生长至90%融合时,对照组不加入LPS处理,LPS组加入10 mmol/L LPS,LPS+U0126组加入10 mmol/L LPS和25 μmol/L ERK1/2激酶抑制剂U0126,培养24 h,将处理后细胞收集到EP管中,3 500 r/min离心5 min,共3次,弃去上清液,加入细胞裂解液裂解30 min,BCA法测定MC3T3-E1细胞蛋白浓度,经电泳、转膜、封闭后,加入一抗(兔抗鼠C-Caspase 3单克隆抗体、兔抗鼠Bax单克隆抗体、兔抗鼠Bcl-2单克隆抗体、兔抗鼠ERK1/2单克隆抗体、兔抗鼠p-ERK1/2单克隆抗体)(1∶1 000)过夜孵育,以β-actin为内参照,加入辣根过氧化物酶标记的羊抗兔二抗(1∶5 000)孵育2 h,加入ECL显影,用凝胶成像系统拍照,采用Image Lab软件分析蛋白条带。目标蛋白水平以目标蛋白条带灰度值/β-actin条带灰度值表示。

2 结果
2.13组MC3T3-E1细胞活性比较 与对照组比较,LPS组和LPS+U0126组MC3T3-E1细胞活性降低(P<0.05);与LPS组比较,LPS+U0126组MC3T3-E1细胞活性升高(P<0.05)。见表1。
2.23组MC3T3-E1细胞凋亡比较 与对照组比较,LPS组和LPS+U0126组MC3T3-E1细胞凋亡率升高(P<0.05);与LPS组比较,LPS+U0126组MC3T3-E1细胞凋亡率降低(P<0.05)。见表2和图1。
2.33组MC3T3-E1细胞成骨活性指标ALP和BGP活性比较 与对照组比较,LPS组和LPS+U0126组MC3T3-E1细胞ALP和BGP活性降低(P<0.05);与LPS组比较,LPS+U0126组MC3T3-E1细胞ALP和BGP活性升高(P<0.05)。见表3。
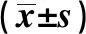


GroupsnCell viabilityControl group7115.35±11.24LPS group761.24±9.031)LPS+U0126 group7 78.57±10.421)2)F50.666P0.000
Note:Compared with the control group,1)P<0.05;compared with the LPS group,2)P<0.05.
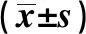


GroupsnApoptosis ratesControl group76.24±1.47LPS group727.13±1.621)LPS+U0126 group713.16±1.511)2)F336.575P0.000
Note:Compared with the Control group,1)P<0.05;compared with the LPS group,2)P<0.05.

图1 3组MC3T3-E1细胞凋亡流式细胞图Fig.1 Apoptotic flow cytometry of three groups of MC3T3-E1 cells
2.43组MC3T3-E1细胞核形态比较 对照组细胞核完整,染色均匀,呈卵圆形或圆形;LPS组细胞核缩小,呈碎块状致密浓染的固缩状,染色质凝聚,呈明显的细胞凋亡形态;LPS+U0126组凋亡形态细胞数量明显减少。见图2。
2.53组MC3T3-E1细胞C-Caspase 3、Bax、Bcl-2蛋白水平比较 与对照组比较,LPS组和LPS+U0126组MC3T3-E1细胞C-Caspase 3、Bax蛋白水平升高(P<0.05),Bcl-2蛋白水平降低(P<0.05);与LPS组比较,LPS+U0126组MC3T3-E1细胞C-Caspase 3、Bax蛋白水平降低(P<0.05),Bcl-2蛋白水平升高(P<0.05)。见表4和图3。
2.63组MC3T3-E1细胞ERK1/2、p-ERK1/2蛋白水平比较 3组MC3T3-E1细胞ERK1/2比较差异无统计学意义(P>0.05),p-ERK1/2蛋白水平比较差异有统计学意义(P<0.05),其中与对照组比较,LPS组和LPS+U0126组MC3T3-E1细胞p-ERK1/2蛋白水平升高(P<0.05);与LPS组比较,LPS+U0126组MC3T3-E1细胞p-ERK1/2蛋白水平降低。见表5和图4。
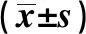


GroupsnALP(U/g)BGP(ng/ml)Control group76.84±1.250.53±0.06LPS group72.47±0.961)0.28±0.051)LPS+U0126 group74.21±1.131)2)0.39±0.071)2)F27.02629.973P0.0000.000
Note:Compared with the control group,1)P<0.05;compared with the LPS group,2)P<0.05.

图2 3组MC3T3-E1细胞核形态的Hochest 33258染色(×400)Fig.2 Hochest 33258 staining of nuclear of three groups of MC3T3-E1 cells (×400)
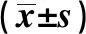


GroupsnC-Caspase 3 proteinBax proteinBcl-2 proteinControl group70.24±0.090.18±0.070.85±0.16LPS group70.47±0.121)0.49±0.141)0.19±0.131)LPS+U0126 group70.35±0.111)2)0.32±0.131)2)0.37±0.141)2)F8.03212.22539.362P0.0000.0000.000
Note:Compared with the control group,1)P<0.05;compared with the LPS group,2)P<0.05.

图3 3组MC3T3-E1细胞C-Caspase 3、Bax、Bcl-2蛋白Western blot电泳图Fig.3 Western blot analysis of C-Caspase 3,Bax,Bcl-2 proteins in three groups of MC3T3-E1 cellsNote: 1.Control group;2.LPS group;3.LPS+U0126 group.
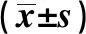


GroupsnERK1/2p-ERK1/2Control group70.42±0.150.13±0.06LPS group70.46±0.170.78±0.211)LPS+U0126 group70.52±0.190.31±0.141)2)F0.60835.146P0.5550.000
Note:Compared with the control group,1)P<0.05;compared with the LPS group,2)P<0.05.

图4 三组MC3T3-E1细胞ERK1/2、p-ERK1/2蛋白Western blot电泳图Fig.4 Western blot analysis of ERK1/2 and p-ERK1/2 proteins in three groups of MC3T3-E1 cellsNote: 1.Control group;2.LPS group;3.LPS+U0126 group.
3 讨论
开放性骨折患者常伴随有细菌感染,细菌感染是引起骨折不愈合或延迟愈合的重要原因。骨折愈合过程是成骨细胞形成骨质,并且发生钙化的过程,细菌感染可引起骨折局部炎症细胞因子的释放,从而引起免疫功能紊乱,导致成骨细胞凋亡,使骨折愈合困难。LPS包含特异性多糖、非特异性多糖和类脂A,是细菌内毒素的关键成分,其中类脂A是关键毒性成分,可造成多种器官损伤、衰竭。LPS作为细菌的主要致热源,可使成骨细胞活性降低。炎症反应是机体防御外界损伤的主要机制,骨折后大量炎症因子的释放可造成破骨细胞活化、成骨细胞无法成骨,从而抑制骨折愈合[8]。LPA引起骨折不愈合主要为LPS引起的活化因子配基水平升高,使成骨细胞分泌破骨细胞激活因子,降低成骨细胞活性,并促进成骨细胞凋亡[9]。细胞实验研究发现:体外给予一定浓度的LPS可降低成骨细胞的增殖和分化能力,诱导成骨细胞凋亡[10]。
细胞凋亡的信号通路包括死亡受体通路、内质网通路、线粒体通路等,最为经典的通路为线粒体通路。线粒体凋亡途径主要通过Caspase、Bcl-2凋亡家族成员发挥作用,Caspase为细胞凋亡过程中发挥关键作用的半胱氨酸蛋白酶,Caspase-3在凋亡级联反应中发挥最关键作用,活化的Caspase-3促进凋亡的发生[11];Bcl-2家族包括促凋亡蛋白和抗凋亡蛋白,可促进或防止凋亡因子从线粒体释放,破坏或保护线粒体完整性[12];Bcl-2通过维持线粒体膜的完整性抑制细胞凋亡;Bax可破坏线粒体膜,形成通透性孔道,促进细胞凋亡[13]。ALP由成骨细胞分泌,是成骨细胞分化的标志,可反映成骨细胞功能和成骨细胞分化成熟程度;BGP由成牙骨质细胞和成骨细胞合成和分泌,是构成骨基质的成分之一,可反映成骨细胞分化成熟情况及成骨细胞的成骨功能;因此ALP和BGP活性可反映成骨细胞的成骨活性。本研究体外对小鼠前体成骨细胞株MC3T3-E1细胞给予LPS处理,发现LPS处理后MC3T3-E1细胞活性及ALP和BGP活性降低,凋亡率增加,细胞中C-Caspase 3、Bax蛋白水平升高、Bcl-2蛋白水平降低。表明LPS可抑制成骨细胞活性及成骨活性,诱导成骨细胞凋亡,分析LPS通过降低Bax蛋白水平,使细胞色素C进入细胞质,与凋亡相关因子-1等组成凋亡体,凋亡体激活下游Caspase 3,活化的Caspase 3(C-Caspase 3)水解底物,诱导成骨细胞凋亡。
多种信号通路参与成骨细胞增殖、分化和凋亡,MAPK为信号转导过程中的主要信号分子,在多种细胞生理病理过程中发挥重要作用[14,15],ERK为MAPK信号通路之一,在细胞增殖、分化和凋亡中发挥重要作用[16]。在成骨细胞中,ERK参与成骨细胞的分化、存活和增殖,抑制ERK1/2信号通路的激活可抑制Bax表达升高和Bcl-2下调,从而抑制线粒体释放细胞色素C,抑制Caspase-3激活,从而抑制细胞凋亡[17,18]。LPS可通过多种信号通路影响成骨细胞增殖、分化和凋亡[19],如LPS通过Notch信号通路诱导成骨细胞增殖[20];LPS通过JNK信号通路抑制成骨细胞分化和诱导成骨细胞凋亡[21]。本研究发现LPS可降低成骨细胞中p-ERK1/2水平,表明LPS可激活成骨细胞ERK1/2信号通路;细胞中同时加入ERK1/2信号通路抑制剂处理后,成骨细胞活性及ALP和BGP活性升高,凋亡率下降,C-Caspase 3、Bax、p-ERK1/2蛋白水平下降,Bcl-2蛋白水平升高。表明LPS可能通过促进ERK1/2信号通路的激活使Bax表达升高和Bcl-2下调,导致线粒体释放细胞色素C,激活Caspase-3,从而诱导成骨细胞凋亡。
综上所述,LPS可通过激活MAPK/ERK1/2信号通路介导线粒体通路抑制成骨细胞活性、诱导成骨细胞凋亡。
