早期帕金森病伴认知功能障碍患者视网膜的形态及临床意义
2020-05-13杨紫姣张金茹毛成洁季晓燕刘春风
杨紫姣,张金茹,毛成洁,魏 静,季晓燕,刘春风
(1.同济大学附属杨浦医院老年科,上海 200090;2.苏州大学附属第二医院神经内科,江苏 苏州 215004;3.苏州大学附属第二医院眼科,江苏苏州 215004)
帕金森病(Parkinson's disease,PD) 是仅次于阿尔兹海默病(Alzheimer's disease,AD),第二大常见的老年神经退行性疾病,除典型运动症状外,认知功能减退、视幻觉、睡眠障碍等非运动症状也越来越受到关注。光学相干断层扫描(optical coherence tomography,OCT)可以对眼组织进行非接触式、非侵入性的断层成像,能够观察到视网膜、视神经细微的形态结构改变,其在视网膜神经纤维层检测中的应用有助于对青光眼、糖尿病视网膜病变等疾病的诊治[1]。最近10年,国外很多研究,将OCT 检测方法用于观察神经退行性疾病如AD、PD、路易体痴呆、精神分裂症的早期临床生物指标的监测及随访[2]。其中,已有研究证实AD、PD 可能存在视网膜神经纤维层厚度变薄,这种神经纤维层厚度的改变与神经节轴突的丢失相关,可能早于或者与神经元胞体的丢失同步,反映了神经退行性的改变[3⁃6]。认知障碍是 PD 严重的非运动症状之一,可影响患者的生活质量,即使是在PD 早期也能发现到轻微的认知损害,并且发病率较高。然而,PD 认知功能障碍与视网膜结构损害之间关系的研究较少。本研究对PD 患者同时进行了认知量表等临床特征评价和OCT,以期发现PD 认知功能下降的影响因素,分析视网膜形态学是否发生改变,以及这种变化与认知有关的临床特征有无相关性。
1 资料与方法
1.1 研究对象
收集2014年3月—2015年3月苏州大学附属第二医院收治的 Hoehn&Yahr(H⁃Y)分期位于1~2.5 期的早期PD 患者53 例(106 只眼)以及同期健康体检的正常人20 名(40 只眼),所有患者均符合英国PD脑库制定的诊断标准[7]。排除标准:(1) 脑血管、脑炎、外伤、药物等所致的帕金森综合征及帕金森叠加综合征;(2) 患青光眼、白内障、高度近视、外伤引起的眼部疾病,糖尿病、高血压病等全身系统性疾病;(3) 有失语、谵妄、意识障碍等影响认知评估的疾病;(4) 有严重焦虑、抑郁、精神分裂等心理疾病。
所有受试对象均行视力、眼压、裂隙灯显微镜及眼底检查,矫正视力≥0.6,屈光度数-3.0D~+3.0D,眼压均≤21 mmHg(1 mmHg=0.133 kPa)。裂隙灯显微镜下检查屈光间质透明,正常视乳头形态;眼底检查无视盘、视网膜血管及黄斑病变等。本研究经苏州大学附属第二医院伦理委员会批准,所有受试对象均签署知情同意书。
1.2 研究方法
收集苏州大学附属第二医院神经内科53 例PD患者的一般情况,包括性别、年龄、起病侧、发病类型、病程、文化程度等一般资料。对全部患者均采用PD 统一评分量表(UPDRS) 运动部分的得分(UPDRS⁃Ⅲ)和代表 PD 病情严重程度的 Hoehn⁃Yahr 分级评定。采用简易精神状态量表(MMSE)、蒙特利尔认知量表(MOCA)、汉密尔顿焦虑量表(HAMA)、汉密尔顿抑郁量表(HAMD)、匹兹堡睡眠指数量表(PSQI)、Epworth 嗜睡量表(ESS)分别在“开期”对患者的认知功能、焦虑抑郁情绪、睡眠障碍进行评估。MoCA 总分为30 分,如果受试者受教育年限<12年,则在测试结果上加1 分,以校正文化程度的偏倚,≥26 分为正常,<26 分为认知障碍。
由同1 名眼科技师采用德国Zeiss 公司生产的Cirrus HD⁃OCT 200×200 的视盘扫描模式和 512×128 黄斑扫描模式对所有研究对象在“开期”进行视网膜神经纤维层的扫描,操作前使用托吡卡胺充分散瞳,根据受检者的屈光状态进行矫正以获得最清晰的图像。检查时受检者取坐位,下颌置于颌架,调整眼部位置,采用以视乳头为中心的内注视法,即被检查眼注视镜头内的注视点。通过Cirrus HD-OCT的扫描程序自动识别视盘中心,采用以视盘为圆心直径3.46 mm 的环形扫描。检查者通过监视屏监视被检眼的注视及扫描情况,调整焦点,进行图像优化,选取OCT 图像信号强度>6 的图像储存于计算机内。利用计算机图像分析系统进行视网膜切面上方、下方、鼻侧、颞侧4 个象限及相对应的12 钟点神经纤维层厚度进行测量;选择512×128 黄斑扫描模式对受试者双眼黄斑容积、黄斑平均厚度、黄斑中心凹厚度及黄斑内环和外环区的厚度进行检测。
1.3 统计学处理
采用SPSS 17.0 统计学软件进行分析。计量资料采用独立t检验,分类资料采用χ2检验。利用非条件 logistic 回归方法研究教育年限、H⁃Y 分期、ESS、PSQI 得分对认知障碍的影响;采用单因素方差分析比较健康对照组、PD 认知正常组、认知障碍组视觉参数,进一步组间比较采用t检验;采用Pearson 相关分析探讨MOCA 评分与视觉参数的相关性。P<0.05 为差异有统计学意义。
2 结 果
2.1 一般资料
收集健康对照组20 例,平均年龄为(59.05±5.54)岁,其中男性 9 例,女性 11 例,与 PD 患者平均年龄、性别构成均无差异性。根据认知功能评估结果将53 例患者分成PD 认知障碍组32 例(64 只眼)和PD 认知正常组21 例(42 只眼),其一般临床资料见表1。两组间性别、年龄构成均无差异。不同起病形式,包括起病侧(左侧/右侧/中轴)和发病类型(震颤/强直少动/运动迟缓/混合),在PD 认知正常组与认知障碍组之间均无差异。两组患者的病程长短、UPDRSIII 评分上均无差异。认知障碍组的H&Y 分级、ESS 评分均较认知正常组高,此外认知障碍组的教育年限、MMSE、MOCA 得分低于认知正常组,以上差异均有统计学意义(P<0.05),见表1。
2.2 PD患者认知障碍的影响因素
将出现认知障碍(Y=1)的可能有关因素:年龄、PD 病程、起病单侧性、发病类型、H⁃Y 分级、ESS评分、PSQI 评分等作为自变量,进行Logistic 回归分析,选择非条件Logistic 回归分析。结果显示H⁃Y分级、嗜睡情况是PD 患者发生认知障碍的主要影响因素(P<0.05),见表2。
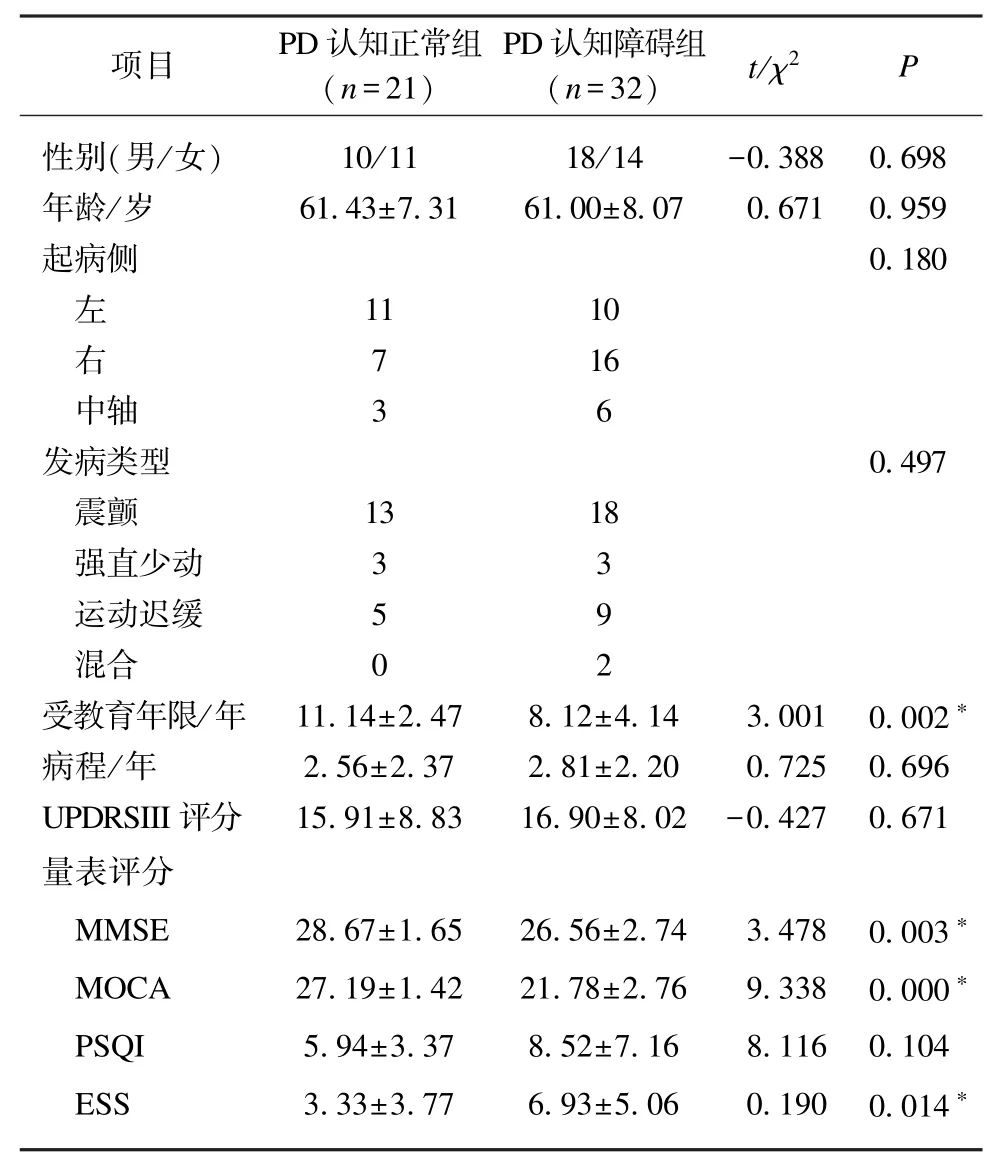
表1 PD 认知障碍和PD 认知正常组一般临床资料比较Tab.1 Comparison of clinical data between PD patients with cognitive impairment and those with normal cognition

表2 PD 患者认知障碍影响因素的Logistic 多因素回归分析Tab.2 Multivariate Logistic regression analysis of cognitive impairment and influencing factors in PD patients
2.3 PD认知障碍组与认知正常组、健康对照组视觉参数的比较
OCT 检测受试对象视盘周围视网膜神经纤维层,结果发现,健康对照组、PD 认知正常组、认知障碍组三组比较,视盘周围颞侧9:00 钟方向RNFL 厚度差异有统计学意义[(53.33±9.82)、(54.58±9.02)、(58.76±10.57) μm,P=0.012];进一步组内比较PD 认知障碍组较认知正常组RNFL 变薄(P=0.006);三组黄斑区容积、黄斑中心凹厚度、平均厚度、外环厚度差异均有统计学意义[(240.50 ±26.67)、(247.68±19.96)、(253.76±25.57) μm,P均<0.05],其中,PD 认知障碍组较 PD 认知正常组中心凹厚度显著变薄(P=0.028),PD 两亚组较健康对照组黄斑区容积均减小(P=0.003),平均厚度(P=0.010)、外环厚度均变薄(P=0.012),见表3。
表3 PD 伴认知障碍组与认知正常组、健康组RNFL 厚度、黄斑区参数的比较Tab.3 Comparison of RNFL thickness and macular parameters ampmg PD patients with cognitive impairment,those with normal cognition,and healthy controls (±s)

表3 PD 伴认知障碍组与认知正常组、健康组RNFL 厚度、黄斑区参数的比较Tab.3 Comparison of RNFL thickness and macular parameters ampmg PD patients with cognitive impairment,those with normal cognition,and healthy controls (±s)
PD 认知障碍组与认知正常组、健康组三组视觉参数比较(单因素方差分析),∗P<0.05;亚组间比较(t 检验):与健康组比较aP<0.05;与认知障碍组比较,bP<0.05
OCT 参数 健康对照组_____________________________(n=20,40 只眼)PD 认知正常组(n=21,42 只眼)_________PD 认知障碍组(n=32,64 只眼)___________________________F P RNFL 厚度/μm平均 97.98±8.86 95.93±11.18 94.69±7.09 4.18 0.191上象限 123.80±20.18 121.81±18.32 119.47±15.81 1.50 0.475 11 ∶00 130.80±32.93 126.50±24.64 125.13±25.83 2.63 0.589 12 ∶00 128.55±30.07 126.54±25.65 123.02±27.68 0.78 0.593 1 ∶00 112.48±23.47 111.71±20.42 110.48±21.98 0.04 0.898鼻侧象限 67.95±11.51 64.43±10.91 65.37±6.47 1.38 0.298 2 ∶00 82.80±19.47 78.21±13.01 81.02±13.39 0.71 0.386 3 ∶00 59.18±13.26 56.50±11.42 54.23±8.89 2.24 0.084 4 ∶00 61.95±10.69 60.69±17.50 60.58±10.84 0.85 0.860下象限 130.95±15.47 124.95±19.51 126.36±14.39 2.83 0.217 5 ∶00 101.70±23.14 95.86±25.56 98.08±19.59 1.74 0.494 6 ∶00 146.13±24.57 139.74±25.80 139.52±23.85 1.33 0.363 7 ∶00 145.03±27.49 139.02±29.01 141.33±23.65 1.05 0.583颞侧象限 69.00±12.07 71.40±11.56 68.64±14.52 0.99 0.543 8 ∶00 72.28±17.02 72.79±15.21 70.55±18.71 0.42 0.782 9 ∶00 54.58±9.02 58.76±10.57 53.33±9.82b 4.55 0.020∗10 ∶00 80.18±15.89 82.60±13.07 79.27±15.43 1.96 0.528黄斑区黄斑容积/mm3 10.25±0.44 9.84±0.71a 9.97±0.46a 7.92 0.003∗平均厚度/μm 283.47±12.52 273.57±19.82a 276.01±13.04a 6.55 0.010∗中心凹厚度/μm 247.68±19.96 253.76±25.57 240.50±26.67b 4.50 0.026∗黄斑内环厚度/μm 320.44±17.50 314.72±24.06 315.95±15.13 2.80 0.342黄斑外环厚度/μm 282.93+12.22 274.37±16.24a 277.13±11.17a 5.04 0.012∗
2.4 视觉参数与MOCA各领域得分的相关性分析
进一步将单因素方差分析得到的有意义的视觉参数与MOCA 总分、视空间、命名、注意、语言、抽象、延迟、定向各领域得分进行相关性分析,结果显示黄斑中心凹RNFL 厚度与MOCA 总分、定向力得分呈正相关(P1=0.021,P2=0.004),见表4。PD患者MOCA 得分越低,定向力越差,黄斑中心凹视网膜神经纤维厚度越薄。
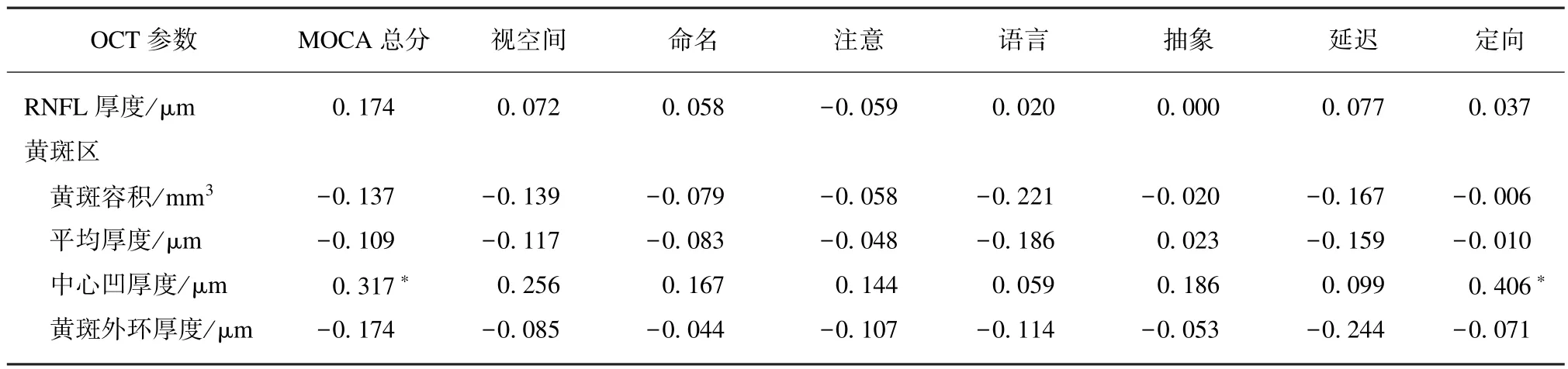
表4 PD 患者MOCA 评分与OCT 视网膜参数的相关系数Tab.4 Correlation coefficient between MOCA score and OCT retinal parameters in PD patients (r)
3 讨 论
相关研究前期通过OCT 技术及视野测定证实早期PD 患者的平均视网膜神经纤维层厚度较健康组变薄,存在客观视觉障碍及视网膜形态结构异常[5]。目前,国内外多项研究发现AD 患者同样出现视网膜神经纤维变薄[6⁃9],而且不同痴呆亚型的患者(AD、帕金森痴呆、路易体痴呆)存在不同程度的视网膜形态结构异常,这种改变可能与认知损害存在相关性[10]。
认知损害是PD 病常见的非运动症状,其严重影响患者的日常生活能力及社会功能;据估计,20%~40%的 PD 患者早期即可能发生认知功能的缺损[11]。皮层下投射系统的病理性蛋白退行性的改变,包括黑质纹状体多巴胺能系统、间皮层的胆碱能系统、边缘皮层系统的α-突触共核蛋白聚集、AD纤维化的β 淀粉样沉积,可能参与了PD 认知障碍的发生[12]。有研究表明 PD 的异常姿势会限制患者的日常能力[13]。本研究发现 PD 患者起病侧、起病方式、教育年限、病程不影响患者的认知改变,但合并认知障碍的PD 患者,疾病更严重,更容易发生嗜睡,这与研究结果一致,同样说明了认知功能损害会对PD 患者的睡眠产生一定的影响[14]。
本研究对早期PD 患者同时行认知功能评估和视觉OCT 的测定,认知量表选用 MMSE 和 MOCA[15]。本研究显示,PD 合并认知障碍患者(MMSE 平均分为26.56±2.74)较认知正常者(MMSE 平均分为28.67±1.65)低,且健康对照组相比,黄斑中心凹厚度明显变薄,差异具有统计学意义,这与 Salobrar⁃Garcia 等[3]对 AD 的 OCT 研究结果相似。OCT 针对黄斑厚度及容积的测定可以反映视网膜神经元的丢失,因为黄斑区域包含视网膜神经元和神经胶质细胞的胞体,神经纤维在黄斑周围散开分布,避免干扰最敏感的视觉区域[16]。本研究发现黄斑中央直径1 mm 区域的中心凹厚度明显变薄,且与定向力得分相关,可能说明PD 伴认知障碍患者较认知正常组视觉系统神经元丢失更明显,可能影响患者的定向力。
Blanks 等[17]研究显示,AD 患者黄斑中心(0 ~0.5 mm 区域)及旁中心凹(0.5 ~1 mm 区域)神经元数量较健康对照组分别减少43%和25%,因为黄斑中心(0 ~2 mm 区域)97%的神经元是神经节细胞,3%的神经元是散在分布的多巴胺能无长突细胞,所以该研究认为AD 患者视网膜中心存在广泛的神经节细胞丢失。研究发现PD 认知障碍组黄斑中心凹厚度明显变薄,这可能说明PD 伴认知障碍患者神经节细胞丢失的更多,另外,Lee 等[18]对 61例PD 患者和30 例健康正常人进行研究,发现PD患者只有旁中央凹周围的内核层较正常对照组薄,视盘周围RNFL、黄斑厚度与正常人无差别。但亚组分析,伴与不伴幻觉的两组帕金森患者的RNFL厚度则不同,具体而言,无痴呆但伴幻觉的患者视盘周围RNFL 最薄,其次是痴呆伴幻觉的PD 患者以及无幻觉的PD 患者,该研究认为PD 患者视盘周围RNFL 厚度的改变与幻觉的发生可能具有相关性,这提示PD 不同亚型之间不仅临床特点具有异质性,其视网膜形态结构也有差异。Sung 等[19]同样发现OCT 相关的视觉参数对早期诊断PD 认知损害有重要意义,且MOCA 得分与PD 患者黄斑神经节内层(mGCIPL)厚度变薄相关,这与本研究结论基本一致,而且本研究还发现黄斑中心凹厚度的改变与认知功能中定向力受损明显相关。但这需要更大样本及病理结果的验证。
有学者认为视盘周围视网膜纤维层厚度的改变是视神经轴突丢失的标志,可能反应中枢神经系统轴突的丢失[20]。其中,上方、下方、鼻侧的神经纤维层主要分布的是M 型神经节细胞,其主要传递无色视觉、外周视野敏感度、动态检测以及对低空间分辨率的对比敏感度。相反,P 型神经节细胞主要分布在黄斑周围神经纤维层,其轴突投射到视盘周围颞侧;其主要在色觉、视敏度、中心视野敏感度以及对高空间分辨率的对比敏感度方面发挥作用。
本研究发现PD 认知障碍组较认知正常组颞侧象限(P 型神经节细胞轴突分布)9:00 钟方向视网膜纤维层明显变薄,可能说明视网膜中发挥色觉、视敏度、高空间分辨率的P 型神经节细胞轴突丢失的更明显。P 型神经节细胞在多系统萎缩患者较少受损,这与多系统萎缩患者视功能损害不常见、较少出现色觉异常相关[21]。视功能损害在 PD 患者中很常见,包括眼干、复视、阅读困难、辨色能力下降、视幻觉等临床表现。PD 合并痴呆的患者较非痴呆患者视功能损害更为常见,尤其是视幻觉的发生率更高。研究发现,80 名非痴呆的PD 患者,经过约4.4年随访,20%的患者进展为帕金森痴呆,其中基线水平时轻度认知障碍(OR=49.7)以及异常的色觉(OR=3.3)都是PD 发展为帕金森痴呆的危险因素之一[22]。本研究发现 PD 伴认知障碍患者视觉系统可能更多的是P 型神经节细胞受损,这可能解释了为什么PD 伴认知障碍患者辨色能力下降、视幻觉发生更为常见。
综上所述,本研究发现伴认知障碍的PD 患者病情更重、更容易合并嗜睡,且OCT 检测存在视网膜纤维层和黄斑区结构的异常,MOCA 得分越低、定向力得分越差,黄斑中心凹厚度越薄。但由于研究入组的均是早期 PD 患者(H&Y 分期 1~2.5 期),其认知受损的程度较轻(MMSE 平均分26.56±2.74),可能随着认知障碍的加重,视盘及黄斑周围的视网膜纤维层厚度改变的象限有所不同。更多中心、更大样本、更长时间的随访或许能从视网膜形态的异常变化来监测PD 进展为帕金森痴呆或帕金森叠加综合征的不同转归,进而为PD 的早期诊断及不同临床亚型提供依据。
