人参蛋白质对乳腺癌MCF-7 细胞的影响
2020-05-12任雨贺田静刘淑莹万茜淋
任雨贺田 静刘淑莹万茜淋
(1.长春中医药大学吉林省人参科学研究院,吉林 长春 130117;2.中国农业科学院特产研究所,吉林长春 130112;3.中国科学院长春应用化学研究所,吉林长春 130022;4.吉林农业大学食药用菌教育部工程研究中心,吉林 长春 130118)
乳腺癌是影响妇女健康的主要恶性肿瘤,发病率位居女性恶性肿瘤之首[1]。近年来随着社会的进步,生活方式和生殖观念的改变以及人群期望寿命延长等诸多因素的影响,我国乳腺癌的发病率呈逐年上升趋势[2]。MCF-7 是世界上研究最多的人乳腺癌细胞系,该细胞系的研究对乳腺癌的研究和患者的预后极具影响意义[3-4]。人参为五加科植物人参的干燥根,作为我国最常用、最珍贵的传统中药材之一,其含有人参皂苷、人参多糖、人参蛋白、挥发油等多种生物活性成分,在抗肿瘤、抗衰老、抗心律失常、提高免疫力等方面均有很好的功效[5-7]。但目前对人参蛋白质的研究多集中在提取和纯化上,对其生物活性的研究较少。
已有研究表明,人参蛋白质具有保护神经细胞、抗肿瘤、抗病毒等作用[8]。本实验以人乳腺癌MCF-7 细胞为研究对象,考察人参总蛋白对MCF-7 细胞增殖、周期及凋亡的影响,以期为进一步研究人参蛋白质抗肿瘤的作用机制提供理论依据。
1 材料
1.1 仪器 倒置荧光显微镜(日本Nikon Ri2 公司);FACSCantoⅡ流式细胞仪(美国BD 公司);酶标仪(德国Tecan公司);MCO-18AC 二氧化碳培养箱(日本松下公司);SWCJ-1C 双人单面超净工作台(苏州安泰空气技术有限公司);ST8R 台式离心机(美国Thermo 公司);真空冷冻干燥机(日本Eyela 公司);SC-242D 四度医用冷藏箱(青岛海尔股份有限公司);GR60DA 自动立式高压灭菌锅(美国Zealway公司);DK-S26 电热恒温水浴锅(上海精宏实验设备有限公司);层析柜(北京亚华顺达科技有限公 司);GZX-9070MBE 电热鼓风干燥箱(上海博讯实业有限公司)。
1.2 试剂和药物 人参(吉林省抚松县3 年生生晒参)经长春中医药大学王淑敏教授鉴定符合药典标准;DMEM 培养基(德国Sigma 公司,批号SLBT5547);Annexin V/FITC细胞凋亡检测试剂盒(江苏凯基生物技术有限公司,批号20171026);DAPI 染色液(上海碧云天生物技术有限公司,批号C1005);细胞周期与细胞凋亡检测试剂盒(上海碧云天生物技术有限公司,批号C1052);超级新生牛血清(NBS,中国四季青生物工程材料有限公司,批号20170824);CCK-8 试剂盒(美国Med chem express 公司,批号06070117)。
1.3 细胞株 人乳腺癌MCF-7 细胞系,购于中国科学院上海细胞生物学研究所,由本实验室传代冻存。
2 方法
2.1 人参蛋白质提取 取3 年生生晒参粗粉15 g,加入Tris-HCl 缓冲液搅拌浸提18 h。离心,取上清液另存。沉淀中继续加入Tris-HCl 缓冲液搅拌浸提18 h。离心,取上清液,与第1 次上清液合并,混匀。加入丙酮,-20 ℃下静止过夜。离心,弃去上清液,下层沉淀挥干丙酮,冻干,即得人参蛋白质干粉,其提取率质量分数为3.29%。
2.2 细胞增殖检测 采用CCK-8 法检测人参蛋白质对MCF-7 细胞增殖的影响[9]。取对数生长期的MCF-7 细胞,调整细胞浓度为6×104/mL,每孔100 μL 接种于96 孔板内,于37 ℃、5% CO2培养箱培养24 h。弃旧培养基,每孔加入100 μL 含药培养基,使药物质量浓度分别为0、0.25、0.50、1.00、2.00、4.00 mg/mL[10-11],每个质量浓度设5 个复孔。继续分别培养24、48、72 h,每孔加入10 μL CCK-8 溶液继续培养2 h,于酶标仪450 nm 波长处测定吸光度,并以下列公式计算人参蛋白质对MCF-7 细胞的抑制率,平行3 次实验。抑制率=[(OD不含药组-OD含药组)/(OD不含药组-OD空白组)]×100%。
2.3 细胞周期检测 取对数生长期的MCF-7 细胞,每孔4×105个细胞接种于6 孔板中,于37 ℃、5% CO2培养箱培养24 h。弃旧培养基,每孔加入2 mL 含药培养基,使药物质量浓度分别为0、2.60 mg/mL,继续培养48 h,收集上清液,胰酶消化,收集细胞,预冷的PBS 洗涤,加入预冷的70%乙醇,4 ℃固定24 h,预冷的PBS 洗涤,加入PI 染色液,混匀,37 ℃避光温浴30 min,采用流式细胞仪检测分析细胞周期。平行3 次实验,计算各周期抑制比率。
2.4 DAPI 染色观察细胞形态 取对数生长期的MCF-7 细胞,每孔4×105个接种于6 孔板中,于37 ℃、5%CO2培养箱培养24 h。弃旧培养基,每孔加入2 mL 含药培养基,使药物质量 浓度分别为 0、0.25、0.50、1.00、2.00、4.00 mg/mL,继续培养48 h,PBS 洗涤,加入甲醇-乙酸(甲醇-乙酸=1∶1)固定液固定15 min,弃固定液,加入含0.5% Triton-100 的PBS 打孔15 min,弃PBS,加入DAPI染色液室温避光染色5 min,PBS 洗涤,于倒置荧光显微镜下观察细胞形态,并拍照。
2.5 细胞凋亡检测 取对数生长期的MCF-7 细胞,每孔4×105个接种于6 孔板中,于37 ℃、5% CO2培养箱培养24 h。弃旧培养基,每孔加入2 mL 含药培养基,使药物浓度分别为0、2.60 mg/mL,继续培养48 h,收集上清液,不含EDTA 的胰酶消化,收集细胞,PBS 洗涤2 次,1×Binding Buffer 重悬细胞,并分别加入5 μL Annexin V-FITC和5 μL PI,室温避光培养15 min,用流式细胞仪检测分析细胞凋亡情况。平行3 次试验,计算细胞凋亡率。
2.6 统计学分析 统计学分析取3 次重复,采用Microsoft Excel 2007 和SPSS 21.0 进行统计分析,数据均以()表示,以P≤0.05 表示差异具有统计学意义。
3 结果
3.1 人参蛋白质对MCF-7 细胞增殖的影响 如图1 所示,人参蛋白质对MCF-7 细胞增殖抑制作用呈时间和浓度依赖性。当使用4 mg/mL 人参蛋白质处理72 h,抑制率为79.77%。人参蛋白质作用MCF-7 细胞24、48、72 h 的IC50值分别为5.21、2.60、1.11 mg/mL。因实验最大质量浓度为4.00 mg/mL,而24 h 的最大抑制率未达到50%,24 h 的IC50值推断 为无效。因 此,选用作 用48 h 的IC50值2.60 mg/mL进行周期及凋亡实验。
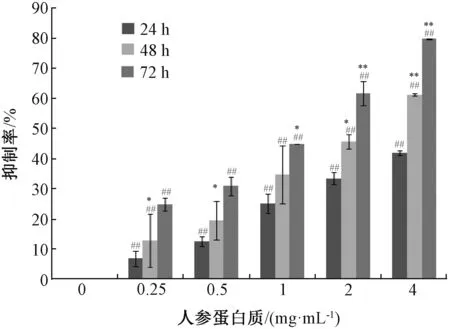
图1 人参蛋白质对MCF-7 细胞增殖的影响(n=3)
3.2 人参蛋白质对MCF-7 细胞周期的影响 如图2 所示,与0 mg/mL 人参蛋白质组相比,2.60 mg/mL 人参蛋白质作用MCF-7 细胞48 h 后,G1 期细胞升高(P<0.05),S 期比例无变化,而G2 期细胞下降(P<0.01)。结果表明,人参蛋白质能够抑制细胞从G1 期向S 及G2 期转变,将细胞周期阻滞在G1 期,从而抑制MCF-7 细胞的增殖。
3.3 人参蛋白质对MCF-7 细胞形态的影响
3.3.1 常光下观察MCF-7 细胞形态 如图3 所示,人参蛋白质处理MCF-7 细胞48 h 后,0 mg/mL 人参蛋白质组的细胞生长状态良好,形态完整,大小均一,连接紧密,且密集成片生长;随着人参蛋白质浓度的增加,细胞数量显著减少,形态发生变异,且悬浮细胞逐渐增多。
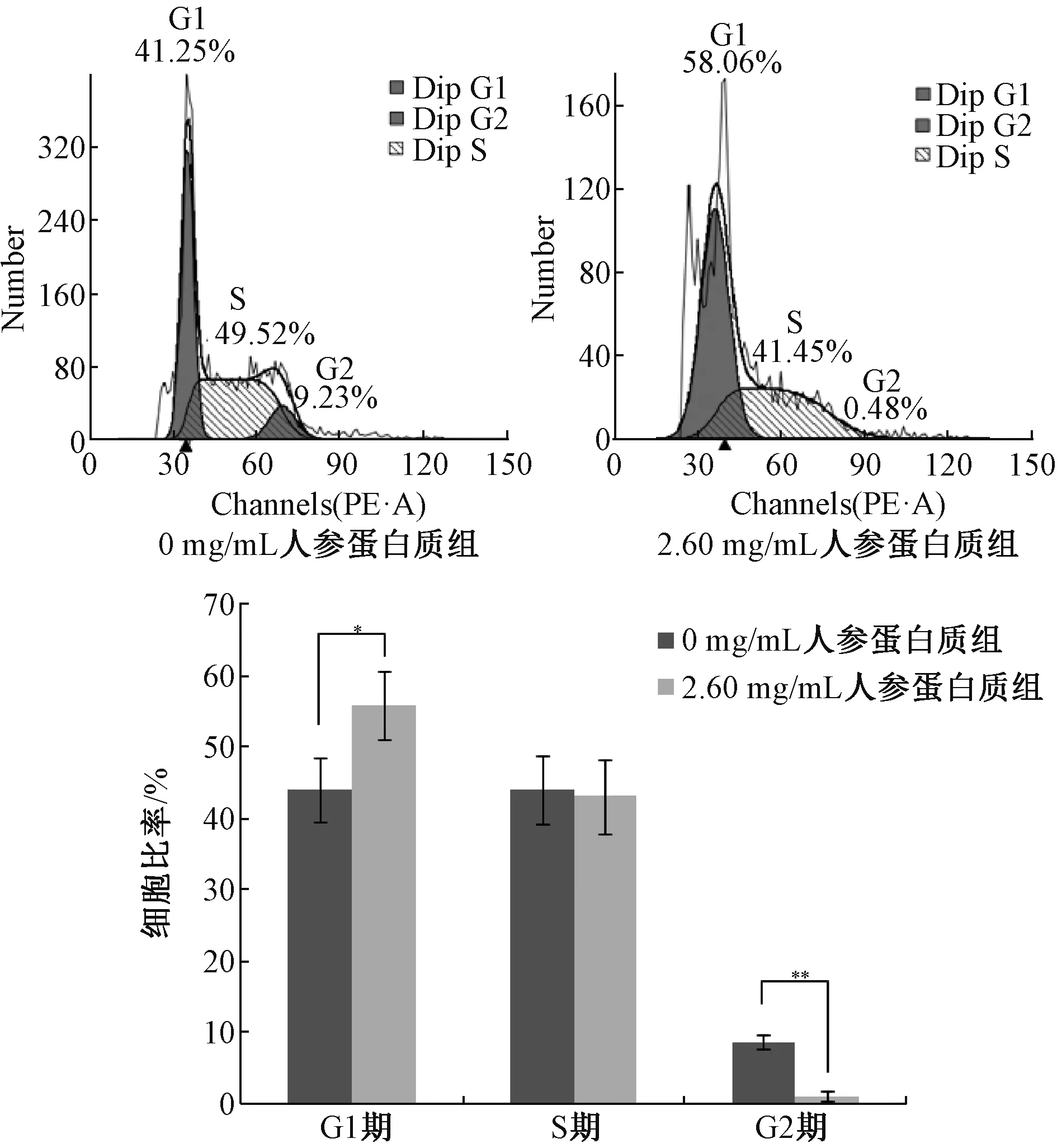
图2 人参蛋白质对MCF-7 细胞周期的影响(n=3)
3.3.2 DAPI 染色法观察MCF-7 细胞凋亡形态 如图4 所示,经不同质量浓度的人参蛋白质溶液处理48 h 后,0 mg/mL人参蛋白质组细胞核比较规则,染色质均匀,边缘清晰,蓝色荧光弱,略见细胞核边缘不规则的凋亡细胞。随着人参蛋白质浓度的增加,细胞核形态发生变化,细胞染色质发生聚集,蓝色荧光增强,细胞核固缩,并出现蓝色荧光的凋亡小体。
3.4 人参蛋白质对MCF-7 细胞凋亡的影响 如图5 所示,流式细胞仪检测的凋亡散点图,Q1、Q2、Q3、Q4 分别代表死细胞、晚期凋亡细胞、活细胞、早期凋亡细胞。与0 mg/mL 人参蛋白质组相比,2.60 mg/mL 人参蛋白质作用MCF-7 细胞48 h 后,细胞的晚期凋亡及总凋亡比例升高(P<0.01)。表明,人参蛋白质能够诱导MCF-7 细胞的凋亡。
4 讨论
随着中药受到越来越多的关注,从中药中寻找抗癌活性成分是近年来研究的热点[12]。中药治疗肿瘤不仅能减轻临床不良反应,还对防治肿瘤复发转移、增效减毒等有很好的效果[13]。中药的抗肿瘤机制有许多方面,如抑制DNA合成、抑制肿瘤血管形成、诱导细胞分化、促进细胞凋亡、调节机体免疫功能、抑制蛋白酪氨酸激酶活性等[14-15]。
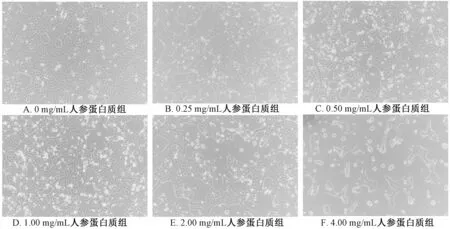
图3 人参蛋白质对MCF-7 细胞形态的影响
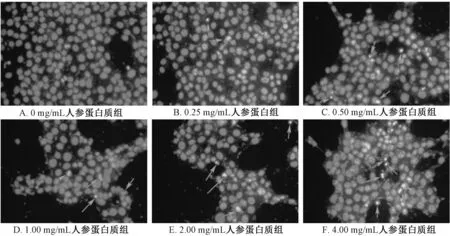
图4 DAPI 染色观察人参蛋白对MCF-7 细胞形态的影响
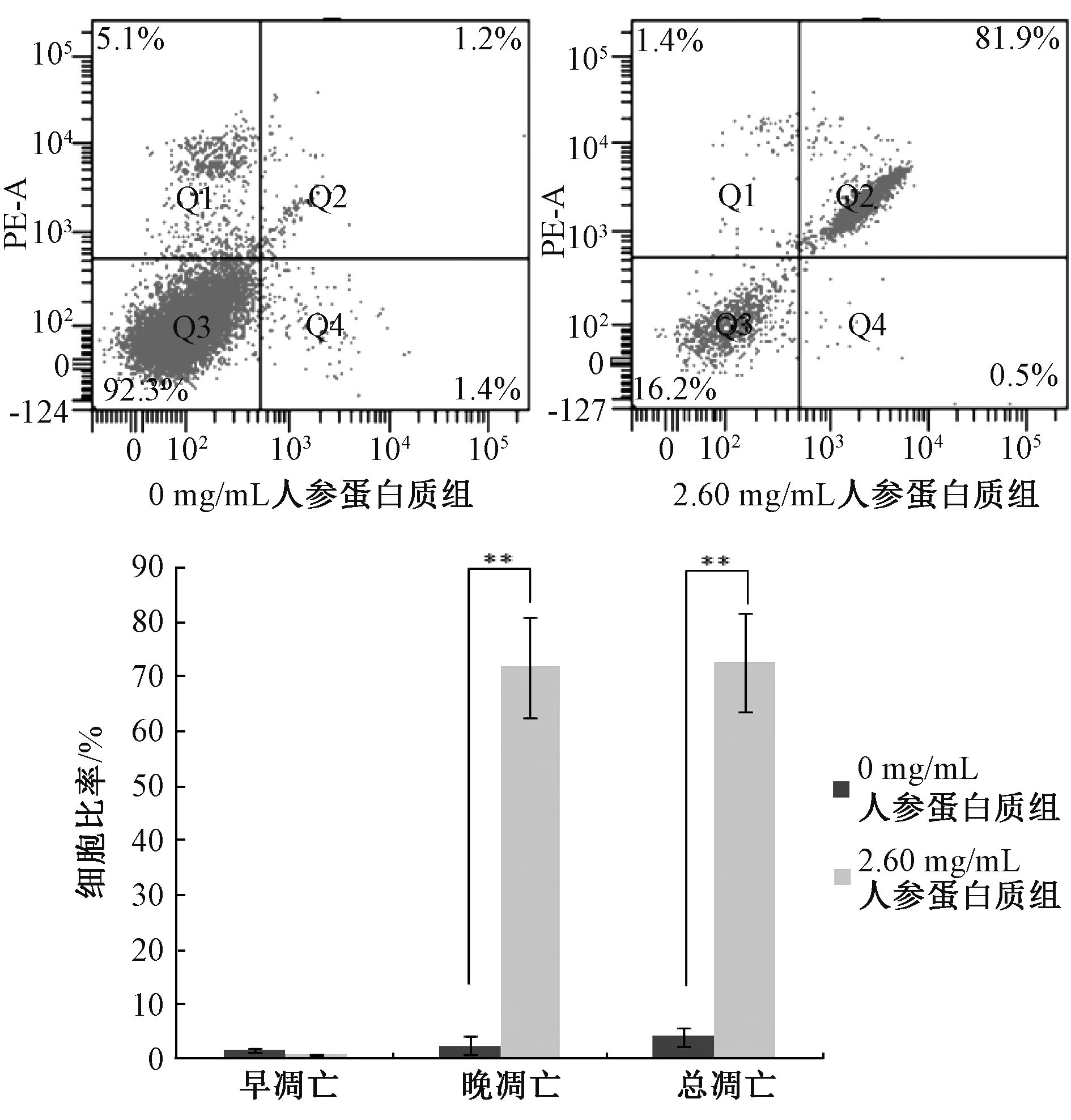
图5 人参蛋白质对MCF-7 细胞凋亡的影响(n=3)
已有研究表明人参蛋白质对人喉癌细胞Hep-2[16]及白血病[17]细胞均具有良好的抑制作用,但其对人乳腺癌MCF-7 细胞的作用尚未见报导。本研究通过CCK-8 实验证明人参蛋白质能明显抑制人乳腺癌MCF-7 细胞的增殖,且呈一定的时间和浓度依赖性。细胞周期指的是从上一次细胞有丝分裂完成至下一次有丝分裂完成的连续的全过程,调控细胞周期可阻止肿瘤细胞的异常增殖,同时保护正常细胞,是肿瘤治疗的新思路[18]。本研究通过PI 染色及流式细胞仪检测,表明人参蛋白质能够抑制细胞从G1 期向S 及G2 期转变,将细胞周期阻滞在G1 期,从而使细胞停止分裂,抑制MCF-7 细胞的增殖。
抑制肿瘤细胞的增殖和诱导肿瘤细胞的凋亡已成为治疗肿瘤的基本思路。细胞凋亡是凋亡调控基因调控细胞主动死亡的过程,具有明显的形态学特征变化[19]。通过DAPI 染色实验可见,与0 mg/mL 人参蛋白质组相比,2.60 mg/mL人参蛋白质组细胞形态发生变化,且染色质发生固缩,并形成凋亡小体,具有典型的凋亡形态学特征,说明人参蛋白质可以促进MCF-7 细胞的凋亡。通过Annexin V-FITC 实验及流式细胞仪检测,人参蛋白质加药组的细胞凋亡率显著高于对照组,进一步证明人参蛋白质能够诱导人乳腺癌MCF-7 细胞的凋亡。
综上所述,本实验表明人参蛋白质能够抑制人乳腺癌MCF-7 细胞的增殖,将其细胞周期阻滞在G1 期,并能诱导其细胞的凋亡。证明人参蛋白质对人乳腺癌MCF-7 细胞具有显著的抗肿瘤作用,以期为人参蛋白质抗肿瘤机制的进一步研究及临床应用提供了可靠的理论依据。
