纳米金-适配体比色传感法检测玉米油中黄曲霉毒素B1
2020-05-11杨妍尹盈爱董益阳
杨妍 尹盈爱 董益阳

摘 要 黄曲霉毒素B1(Aflatoxin B1,AFB1)是真菌或霉菌产生的有毒代谢物,通过污染农作物和食品从而对人体健康造成严重威胁。本研究建立了纳米金(AuNPs)-适配体比色传感法,采用不同序列长度的AFB1适配体检测玉米油中AFB1。通过优化适配体浓度、NaCl浓度和体系反应温度,进一步提高体系检测灵敏度。在最佳条件下,50(B50)和80(A80)个碱基长度的适配体建立的AuNPs-适配体比色传感法的检出限分别为13.55和10.56 ng/mL,线性范围均为20~1000 ng/mL,且选择性良好。基于B50和A80适配体比色传感法检测玉米油中AFB1的加标回收率分别为102.4%~104.9%和98.1%~109.1%。结果表明,基于B50和A80建立的AuNPs比色传感法均可用于玉米油中AFB1特异性鉴定。本研究为现场快速检测和高效筛查食品中AFB1污染提供了技术支持,为开发针对其它靶标的适配体传感检测方法奠定了基础。
关键词 黄曲霉毒素B1;适配体;纳米金-适配体比色传感法;玉米油
1 引 言
黄曲霉毒素B1(Aflatoxin B1,AFB1)是真菌黄曲霉(fungus Aspergillus flavus)和霉菌寄生曲霉(mold Aspergillus parasiticus)产生的次级代谢物[1],多存在于花生、玉米、大米、大豆、小麦等农副产品中[2]。AFB1具有急性和慢性毒性[3],还可导致肝癌,被国际癌症研究机构(IARC)列为I类致癌物[4]。AFB1对农产品的消费安全以及人和动物的健康存在严重威胁,因此许多国家和组织设定了AFB1残留的最高限量标准。我国对小麦、大麦及其制品的AFB1残留量最高限量为5 μg/kg,玉米、玉米面和玉米制品的AFB1残留量最高限量为20 μg/kg[5];欧盟规定所有谷物和谷物制品中的AFB1的最大残留限量为2 μg/kg[6]。目前,检测AFB1方法主要分为3类:第一类是仪器检测法,如高效液相色谱-荧光法[7]、液相色谱-质谱法[8]和气相色谱-质谱法[9]等,仪器法灵敏度高、重现性好,但存在设备昂贵不便携、样品前处理过程繁琐、周期长等问题。第二类是基于免疫分析的快速检测方法,酶联免疫分析法[10]检测快速、回收率高,但酶活性不稳定,易导致检测结果出现假阳性、假阴性问题。胶体金免疫层析技术[11]操作方便、检测时间短、成本低,但检测结果的精确度仍存在一些问题。荧光免疫分析法[12]灵敏度高、可实现多组分样品检测,但反应条件严格,可选择的荧光物质受限,环境中稀土元素易影响反应。第三类方法是基于核酸适配体开发的简单、快速、低成本的AFB1现场检测和快速筛查方法。
核酸适配体是在体外通过指数富集的配体系统进化技术(Systematic evolution of ligands by exponential enrichment,SELEX)筛选得到的单链寡核苷酸(DNA或RNA)[13,14]。适配体能以高亲和力和特异性识别各种靶分子,包括金属离子、药物、有机小化合物、代谢产物、蛋白质甚至细胞等[15~17]。与抗体相比,适配体具有批间差异性小、易合成和修饰、热稳定性高、生产成本较低等优点[18,19]。近年来,适配体与荧光法、电化学、比色法相结合的生物传感方法受到越来越多的关注[20~23],其中,比色法成本低、检测迅速、操作简单,已广泛应用于食品中真菌毒素[24]、四环素类抗生素[25]、磺胺类抗生素[26]等多种靶标的检测。Yang等[24]基于纳米金(AuNPs)聚集变色,开发了比色传感法检测赭曲霉毒素A(OTA);Sun等[27]基于AuNPs类过氧化物酶活性建立了比色传感法,检测玉米中的赤霉烯酮。
在上述报道中,适配体比色传感法均使用一条确定碱基序列长度的适配体检测靶标分子,而碱基序列的组成以及序列长度是影响适配体与靶标的亲和性的重要因素。为了比较不同序列长度适配体在实际检测中的性能,本研究针对AFB1,选择目前文献报道中常用的50(B50)[28]和80(A80)[29]个碱基长度的AFB1适配体,建立了相应的AuNPs-适配体比色传感方法,比较了两种适配体传感器在比色传感中的检测能力和选择性,为食品中AFB1的现场检测和快速篩查奠定了基础。
2 实验部分
2.1 仪器与试剂
JEOL-100CX-II透射电子显微镜(日本日立株式会社);Nanodrop 2000c紫外分光光度计、UV/UF超纯水仪(美国Thermo Scientific公司);pHS-3C pH计(上海雷磁仪器厂); 3K 15台式冷冻离心机(美国Sigma-Aldrich公司);BT25S台式电子天平(赛多利斯科学仪器有限公司);RE52-99旋转蒸发仪(上海亚荣生化仪器厂)。
氯金酸(纯度99%,国药集团化学试剂公司);柠檬酸三钠、NaCl、MgCl2、KCl、CaCl2和HCl均为分析纯(北京化工厂);黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、OTA标准品(青岛普瑞邦公司);四环素(TC)标准品、分析纯三羟甲基甲烷(Tris)(美国Sigma-Aldrich公司)。玉米油购于本地超市。实验用水为超纯水(18.2 MΩ cm)。黄曲霉毒素B1适配体序列由生工生物工程(上海)股份有限公司合成,序列如下: B50 [28]:5'- GTT GGG CAC GTG TTG TCT CTC TGT GTC TCG TGC CCT TCG CTA GGC CCA CA-3';A80[29]:5'- AGC AGC ACA GAG GTC AGA TGG TGC TAT CAT GCG CTC AAT GGG AGA CTT TAG CTG CCC CCA CCT ATG CGT GCT ACC GTG AA-3'。
2.2 AuNPs的制备
采用柠檬酸盐还原法合成AuNPs[25]。100 mL 1% 氯金酸溶液在搅拌下加热至沸腾,然后快速加入3 mL 1%柠檬酸三钠溶液。在剧烈搅拌下,溶液保持加热约12 min,直到溶液颜色变成酒红色。制得的AuNPs溶液于4℃避光保存。
2.3 基于AuNPs-适配体传感法检测AFB1
用结合缓冲液(100 mmol/L NaCl,20 mmol/L Tris-HCl,2 mmol/L MgCl2,5 mmol/L KCl,1 mmol/L CaCl2,pH 7.6)配制0.3 μmol/L AFB1適配体,然后将40 μL 适配体溶液和40 μL AFB1溶液充分混匀,孵育5 min,加入240 μL AuNPs孵育5 min,再加入40 μL 0.3 mol/L NaCl溶液充分混匀,反应5 min,裸眼观察颜色变化,并用UV-Vis分光光度计扫描450~750 nm的光谱,记录520和650 nm处吸收值变化。配制不同浓度的AFB1标准工作溶液(20、50、100、200、400、600、800和1000 ng/mL),用于绘制校准曲线。所有测定均在25℃进行。
2.4 选择性研究
配制800 ng/mL的AFB1、AFB2、OTA和TC溶液,按照AuNPs-适配体传感法检测AFB1的步骤,分别用A80和B50进行适配体特异性评价,并取等体积的缓冲液做阴性对照实验。
2.5 实际样品测定
称取4 g玉米油,加20 mL石油醚,转移至分液漏斗中,再加20 mL提取液(甲醇-水,55∶45,V/V)充分振荡摇匀。静置分层,收集下层的甲醇-水溶液,上层液体再加5 mL提取液再次萃取,合并两次萃取的下层溶液,65℃水浴中蒸干,然后放在冰盒冷却3 min,准确加入1 mL苯-乙腈(98∶2,V/V)混合液,充分溶解蒸干的残留物。将AFB1添加到预处理溶液中,用缓冲液分别稀释成20、50、100、200、300、400、600、800和1000 ng/mL,用于绘制基质匹配的校准曲线,并进行实际样品中AFB1测定[30,31]。
3 结果与讨论
3.1 比色法传感法检测AFB1的原理
本研究基于AuNPs比色法,使用50碱基和80个碱基长度适配体检测AFB1,比较两种适配体的检测能力和选择性,原理如图1所示。采用柠檬酸还原法合成AuNPs,由于AuNPs颗粒表面带负电荷的柠檬酸根离子,AuNPs颗粒间具有静电排斥作用,在NaCl溶液中可以稳定分散,溶液呈酒红色。单链核酸适配体可以暴露碱基而非磷酸骨架,通过分子间范德华力吸附在带负电荷的AuNPs颗粒表面[27],阻碍AuNPs颗粒在NaCl溶液中的聚集,具有保护作用(图1C-Ⅰ)。当体系中存在靶标AFB1分子,AFB1和适配体特异性识别诱导适配体结构从无规卷曲结构变为刚性结构,适配体对AuNPs的保护作用减弱,导致AuNPs在高浓度NaCl作用下发生聚集,溶液的颜色从红色变为蓝色(图1C-Ⅱ),并且溶液颜色变化程度与AFB1的浓度呈比例关系,因此,通过裸眼观察或测定溶液吸收值可对AFB1的浓度进行定性或精密定量检测。
3.2 AuNPs以及传感体系的表征
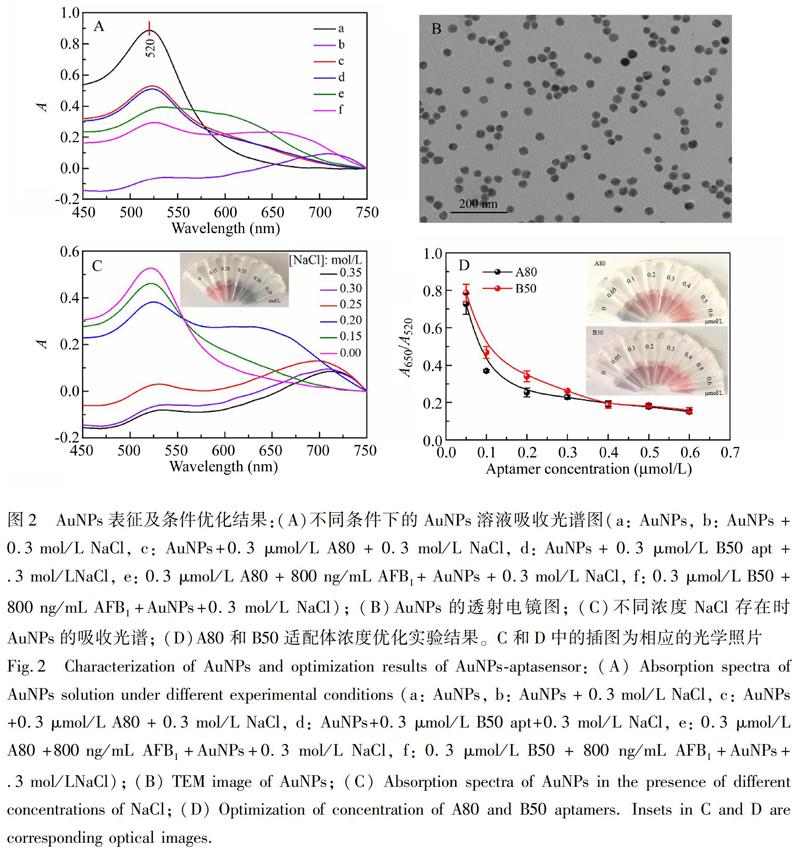
图2A为AuNPs在不同条件下的吸收光谱。采用柠檬酸还原法合成~13 nm AuNPs颗粒(图2B)在520 nm处有最大吸收峰(图2A,曲线a)。当加入0.3 mol/L NaCl时,AuNPs在520 nm处的吸收峰值降低,在710 nm处出现另一个吸收峰(图2A,曲线b),这主要是由于NaCl诱导AuNPs颗粒聚集引起的。在分别添加0.3 μmol/L A80和B50适配体后,仅出现了520 nm的吸收峰,与AuNPs的特征峰相似(图2A,曲线c和d),表明适配体可以保护AuNPs颗粒免受NaCl引起的聚集。在体系中加入800 ng/mL AFB1后,A80和B50体系同时观察到在520和650 nm处的吸收峰(图2A,曲线e和f),这是由于AFB1结合了部分A80和B50,使其失去了保护金纳米粒子的作用。因此,采用A650/A520比值变化进行后续研究。
3.3 反应条件优化
3.3.1 适配体浓度优化 适配体浓度是影响比色传感法检测AFB1灵敏度的关键。AuNPs的分散性受NaCl浓度影响,因此,首先确定NaCl的起始工作浓度。如图2C所示,随着NaCl浓度增加,AuNPs在520 nm处的吸收峰值降低,在650 nm处的吸收峰值增加,当NaCl浓度为0.30和0.35 mol/L时,两者特征吸收峰值相近。因此选择0.3 mol/L为NaCl起始工作浓度。适配体可以保护AuNPs颗粒免于聚集,A80和B50浓度优化结果如图2D所示。在NaCl作用下,低浓度的适配体对AuNPs没有足够的保护作用,导致AuNPs聚集,溶液变蓝。随着适配体浓度增加,适配体对AuNPs的保护作用增强,使AuNPs在NaCl溶液中免于聚集,溶液颜色由蓝变红。当A80和B50浓度为0.3 μmol/L时,A650/A520值接近,由于适配体过量会降低检测灵敏度,因此,选择0.3 μmol/L作为适配体的最佳工作浓度。
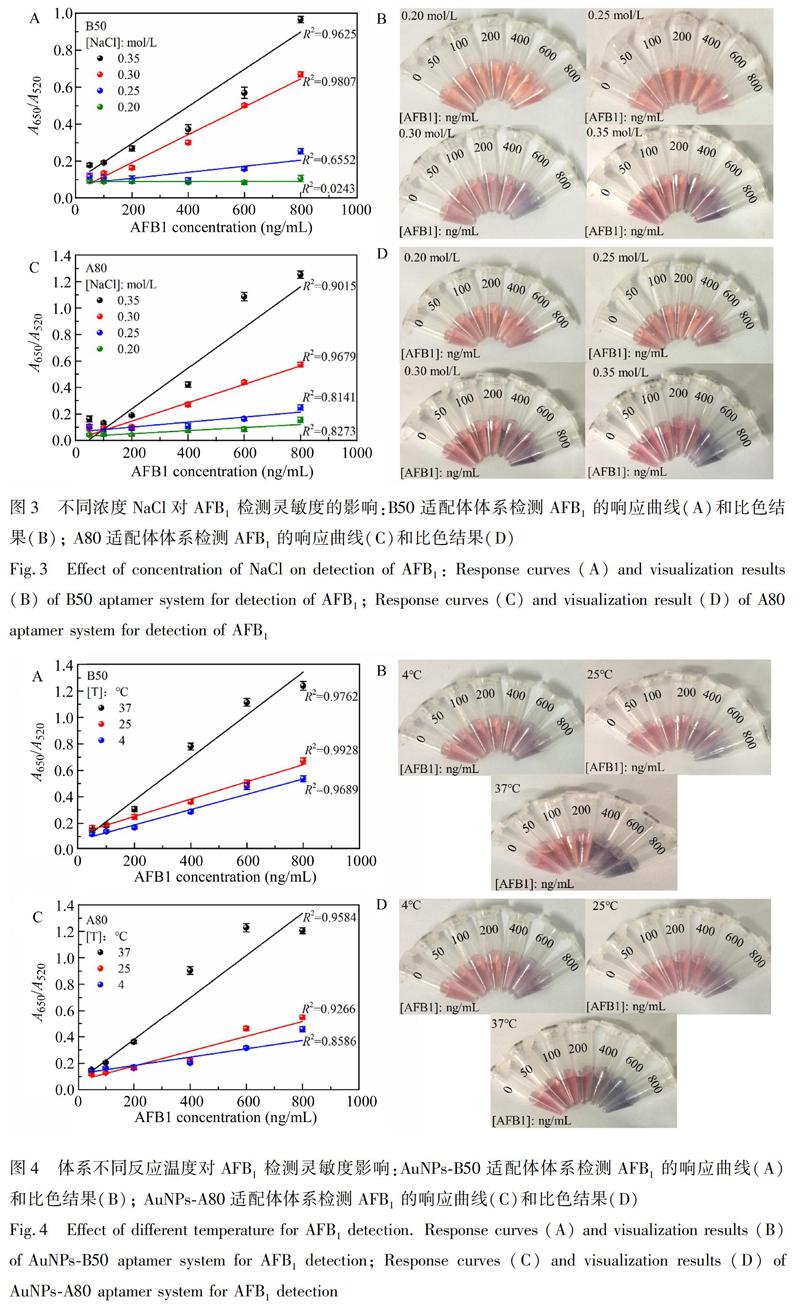
3.3.2 NaCl浓度优化 NaCl浓度影响AuNPs的分散性和适配体检测AFB1的灵敏度。为了进一步提高检测灵敏度,添加不同浓度的NaCl至A80和B50适配体与AFB1识别体系中,结果如图3所示,0.20和0.25 mol/L NaCl不能破坏未结合AFB1的适配体对AuNPs的保护作用,溶液颜色仍为红色。当NaCl浓度为0.30和0.35 mol/L时,AuNPs发生聚集,导致溶液颜色梯度变化(图3B和3D),且AuNPs体系的A650/A520峰吸收比值随NaCl浓度的增加而增大(图3A和3C)。另外,NaCl浓度为0.30 mol/L时,B50和A80在50~800 ng/mL AFB1浓度范围均能获得良好的线性相关系数(R2B50=0.9807,R2A80=09679)。由于过高浓度的NaCl不利于提高检测AFB1的灵敏度,因此,本研究选择NaCl的最佳工作浓度为0.30 mol/L。
3.3.3 反应温度优化 体系的反应温度对适配体和靶标分子识别有较大影响,而反应温度在体系优化过程中易被忽略,故常导致实际检测结果不理想。考察了反应温度对A80和B50适配体识别AFB1能力的影响。如图4所示,随着温度升高,AuNPs-适配体体系的颜色逐渐加深(图4B和4D)。同时,A650/A520值响应幅度增加(图4A和4C),4℃时响应幅度最低,37℃最高,25℃次之,表明温度的升高可能有利于適配体对AFB1的识别和加速AuNPs的聚集。分析A650/A520值与AFB1浓度(50~800 ng/mL)的线性相关系数发现,较高温度时,适配体检测AFB1的线性范围较窄。综合考虑操作简便和现场检测的需求,最终选择25℃作为体系的反应温度。
3.4 AuNPs-适配体比色传感法定量检测AFB1
在最优的实验条件下,建立了AuNPs-B50和AuNPs-A80适配体比色传感法定量检测AFB1的方法。如图5B所示,随着AFB1浓度升高,溶液颜色逐渐由红变蓝,在AFB1浓度范围为20~1000 ng/mL时(图5A,黑线和红线),AuNPs-B50和AuNPs-A80适配体比色传感法检测AFB1的A650/A520比值与AFB1浓度呈线性关系,线性方程分别为y1=6.5864×104C+0.0713 (R21=0.9976)和y2=6.1984 × 104C+ 00741(R22=0.9984)。
对于实际玉米油样品,为了减弱样品基质对AFB1检测的干扰,采用预处理的玉米油样品绘制基质匹配标准曲线,B50和A80适配体体系在玉米油样品基质体系中检测AFB1的峰吸收比值略有降低,但线性相关性良好(图5A,蓝线和绿线),线性范围均为20~1000 ng/mL,线性方程分别为 y3=4.3556×104C + 0.0934(R23=0.9934),y4=4.7343×104C + 0.0889(R24=0.9969),检出限(3σ)分别为13.55和10.56 ng/mL,满足国标对玉米油中AFB1的检测要求[5]。本方法与文献报道方法的分析性能比较见表1。本研究表明,B50和A80适配体建立的AuNPs-适配体比色传感法具有良好的AFB1检测能力,A80检测玉米油基质中AFB1的效果略优于B50,可能与适配体的构型和亲和性(Kd,B50=75 nmol/L,Kd,A80=11.39 nmol/L)有关[28,29]。
3.5 选择性
考察了AuNPs-适配体比色传感法检测AFB1的特异性。在相同的条件下,采用800 ng/mL的AFB2、OTA和TC进行了对比实验。如图5C所示,与AFB1明显增加的峰吸收比值相比,AFB2的峰吸收比值略增,OTA和TC的峰吸收比值无明显增加,且接近阴性对照组。这表明B50和A80适配体在AuNPs比色传感法检测中具有良好的选择性和特异性。
3.6 玉米油实际样品检测
为了验证建立的AuNPs-适配体比色传感法的准确性和可靠性,采用本方法对玉米油样品进行了检测。本地超市购得玉米油样品中未检出AFB1。采用预处理的玉米油样品进行AFB1加标回收实验,加标水平为50、100和300 ng/mL。结果如表2所示,基于B50和A80适配体检测AFB1的加标回收率范围分别为102.4%~104.9%和98.1%~109.1%,相对标准偏差分别为4.1%~9.2%和2.9%~10.0%。上述结果表明,基于B50和A80适配体建立的AuNPs比色传感法的准确度相当,定量检测AFB1的结果准确可靠。本方法可用于玉米油中AFB1的快速筛查和现场检测。
4 结 论
AuNPs比色传感法的关键在于适配体在AuNPs表面的吸附和解吸作用,以及AuNPs-适配体体系在盐溶液中的稳定性。目前,大部分靶标分子常存在不同长度的适配体序列,因此,建立并评价不同长度适配体的AuNPs比色传感分析方法至关重要。本研究基于AuNPs比色传感技术,建立了50和80碱基长度的AFB1适配体定量检测AFB1的方法,评价了两条适配体检测AFB1的能力。通过优化适配体浓度、盐浓度和温度,得到AuNPs-B50和AuNPs-A80适配体比色传感法检测玉米油基质中AFB1的检出限分别为13.55和10.56 ng/mL,线性检测范围均为20~1000 ng/mL,选择性均较高。本研究表明,在相同AFB1浓度范围内,A80适配体检测玉米油中AFB1效果略优于B50适配体,这可能与适配体本身的结构和亲和性有关,需结合其它分子互作技术深入探讨。本检测方法简单快速,裸眼可视,易于进行定性和定量分析,可望发展为现场检测和快速筛选样品中AFB1的高效方法。本研究为建立和对比其它靶标相同而适配体序列长度不同的适配体传感方法提供了参考。
References
1 Barakat G I I,Kamal Y N,Sultan A M. Eur. J. Clin. Microbiol. Infect. Dis.,2019,38(11): 2021-2027
2 Zhao Y,Huang J,Ma L,Wang F. Food Chem.,2017,221: 11-17
3 Xu Y,Gong Y Y,Routledge M N. World Mycotoxin J.,2018,11(3): 411-419
4 Gong Y Y,Watson S,Routledge M N. Food Safety,2016,4(1): 14-27
5 GB/T 2761-2017,Standards for Limits of Mycotoxins in Food. National Standards of the People's Republic of China
食品中真菌毒素限量標准. 中华人民共和国国家标准. GB/T 2761-2017
6 European Commission regulation (EC) No.1881/2006 of 19 December,2006,Setting Maximum Levels for Certain Contaminants in Foods Tuffs. Off. J. Eur. Union. L364/5: 15-17
7 ZHANG Qiong,RAN Cong-Cong,CHEN Dan,LI Jun-Mo,JIANG Ye. Chin. J. Chin. Mater. Med., 2015,40(19): 3780-3785
张 琼,冉丛聪,陈 丹,李珺沬,蒋 晔. 中国中药杂志,2015,40(19): 3780-3785
8 Cunha S C,Sa S V M,Fernandes J O. Food Chem. Toxicol.,2018,114: 260-269
9 Musundire R,Osuga I M,Cheseto X,Irungu J,Torto B. PLoS One,2016,11(1): e0145914
10 Tang Y,Lai W,Zhang J,Tang D. Microchim. Acta,2017,184(7): 2387-2394
11 Yan X,Persaud K C. IEEE Sens. J.,2019,19(2): 404-412
12 Beloglazova N V,Eremin S A. Talanta,2015,142: 170-175
13 Komarova N,Kuznetsov A. Molecules,2019,24(19): 3598
14 Antipova O M,Zavyalova E G,Golovin A V,Pavlova G V,Kopylov A M,Reshetnikov R V. Biochemistry (Moscow),2018,83(10): 1161-1172
15 Zhuo Z,Yu Y,Wang M,Li J,Zhang Z,Liu J,Wu X,Lu A,Zhang G,Zhang B. Int. J. Mol. Sci.,2017,18(10): 2142
16 Bayat P,Nosrati R,Alibolandi M,Rafatpanah H,Abnous K,Khedri M,Ramezani M. Biochimie,2018,154: 132-155
17 Kaur H. Biochim. Biophys. Acta Gen. Subj., 2018,1862(10): 2323-2329
18 Verdian A,Fooladi E,Rouhbakhsh Z. Talanta,2019,202: 123-135
19 Zhang Y,Lai B S,Juhas M. Molecules,2019,24(5): 941
20 Alhamoud Y,Yang D,Kenston S S F,Liu G,Liu L,Zhou H,Ahmed F,Zhao J. Biosens. Bioelectron.,2019,141: 111418
21 Fan L,Zhang C,Yan W,Guo Y,Shuang S,Dong C,Bi Y. Talanta,2019,201: 156-164
22 Hanif A,Farooq R,Rehman M U,Khan R,Majid S,Ganaie M A. Saudi Pharm. J.,2019,27(3): 312-319
23 Poltorak L,Sudhlter E J R,de Puit M. TrAC-Trend. Anal. Chem.,2019,114: 48-55
24 Yang C,Wang Y,Marty J,Yang X. Biosens. Bioelectron.,2011,26(5): 2724-2727
25 Wang S,Gao S,Sun S,Yang Y,Zhang Y,Liu J,Dong Y,Su H,Tan T. RSC Adv.,2016,6(51): 45645-45651
26 Chen A,Jiang X,Zhang W,Chen G,Zhao Y,Tunio T M,Liu J,Lv Z,Li C,Yang S. Biosens. Bioelectron.,2013,42: 419-425
27 Sun S,Zhao R,Feng S,Xie Y. Microchim. Acta,2018,185(12): 535
28 Le L C,Cruz-Aguado J A,Penner G A. US Patent. PCT/CA2010/001292,2012
29 Ma X,Wang W,Chen X,Xia Y,Wu S,Duan N,Wang Z. Eur. Food Res. Technol.,2014,238(6): 919-925
30 GB 5009.22-2016,Determination of B-group and G-group Aflatoxins in Foods. National Standards of the People's Republic of China
食品中黄曲霉毒素B族和G族的测定. 中華人民共和国国家标准. GB 5009.22-2016
31 Shim W B,Kim M J,Mun H,Kim M G. Biosens. Bioelectron.,2014,62: 288-294
32 Seok Y,Byun J Y,Shim W B,Kim M G. Anal. Chim. Acta,2015,886: 182-187
33 Sabet F S,Hosseini M,Khabbaz H,Dadmehr M,Ganjali M R. Food Chem.,2017,220: 527-532
34 Wang C,Sun L,Zhao Q. Chin. Chem. Lett.,2019,30(5): 1017-1020
35 Chen L,Wen F,Li M,Guo X,Li S,Zheng N,Wang J. Food Chem.,2017,215: 377-382
36 Aswani Kumar Y V V,Renuka R M,Achuth J,Mudili V,Poda S. RSC Adv.,2018,8(19): 10465-10473
37 Moscone D,Arduini F,Amine A. In Microbial Toxins. Humana Press,Totowa,NJ,2011,739: 217-235
