c-Jun抑制剂对大鼠心肌纤维化抑制作用
2020-05-11鲍宏刚赵冰徐志勇薛丽
鲍宏刚,赵冰,徐志勇,薛丽
心房颤动(房颤,AF)是临床上最常见的心律失常,随着世界人口老龄化趋势的增加,AF的发病率也有逐年增加的趋势,因此对于AF发病机制的研究一直是医学研究的热点。而心房纤维化是AF时心房重构的重要表现形式,在AF发生和维持中的起到重要作用[1,2]。研究指出AF时血管紧张素Ⅱ(AngⅡ)含量的升高可参与心房纤维化的形成[3,4],AngⅡ可通过与其Ⅰ型受体相结合,激活丝裂原活化蛋白激酶家族(MAPKS)中的c-Jun氨基末端激酶(JNK)通路,诱导产生多种生物细胞学效应如:炎症、凋亡、生长及分化等[5-7],该通路的激活可能参与心房纤维化[8,9]的形成。因此我们推测抑制JNK信号转导通路的激活,可能起到改善心房纤维化的作用。故本研究参考Zhang等[10]方法采用皮下多点注射大剂量盐酸异丙基肾上腺素(ISO)诱导产生大鼠心房纤维化模型,观察JNK信号转导通路抑制剂SP600125对大鼠心房纤维化的影响。
1 资料和方法
1.1 实验动物SPF级雄性Waster大鼠32只,体质量为(180±20)g。购自第四军医大学实验动物中心(动物使用许可证号:2007000524909)。
随机数字表法等分为4组:对照组、二甲基亚砜(DMSO)组、盐酸异丙肾上腺素(ISO)[5mg/(kg·d)]组(模型组)、ISO[5 mg/(kg·d)]+SP600125[10 mg/(kg·d)]组(抑制剂组)。
1.2 方法
1.2.1 动物模型的建立参考Zhang等[10]方法采用皮下多点注射大剂量盐酸异丙基肾上腺素(ISO)诱导产生大鼠心房纤维化模型,模型组和抑制剂组大鼠按5 mg/kg体质量腹部皮下多点注射ISO(购自上海禾丰制药有限公司),抑制剂组参照金鑫等[11]方法于ISO注射前1 h按10 mg/kg体质量给予SP600125溶液(SP600125溶于DMSO液中配成浓度为4 mg/ml的溶液)尾静脉注射(SP600125及DMSO溶液均购自美国sigma公司),1/d,连续7 d。而对照组、DMSO组给予等量生理盐水多点腹部皮下注射,而DMSO组尾静脉注射与抑制剂组等剂量的DMSO,以上各组处理,1/d,连续7 d。各组大鼠于7 d后脱臼处死。
1.2.2 取材及标本处理各组大鼠脱臼处死后立即开胸、取出心脏,沿心脏长轴用眼科剪剪开大鼠心脏,取心房组织置于10%中性甲醛缓冲液中固定24 h后,石蜡包埋,连续切片4张,切片厚度4 μm, 分别用于H-E染色、Masson染色、p-JNK1/2/3、p-c-Jun免疫组化染色。剩余心房组织取出后立即置-80℃冰箱中冷冻保存,用于放免法检测AngⅡ的含量。
1.2.3 AngⅡ含量的测定取出100 mg冻存的心房肌组织,低温研磨并按放射免疫试剂盒(购自北京北方生物技术研究所)说明书要求剂量加入两种酶抑制剂(二巯基丙醇、8-羟基喹啉硫酸盐),而后加入pH值为7.4,浓度0.01 mol/L的磷酸盐缓冲液(PBS)液1 ml,离心机3580 g离心20 min后取上清液0.2 ml送往兰州军区总医院放射免疫科检测AngⅡ浓度(pg/ml)。
1.2.4 大鼠心肌组织病理改变及CVF计算心肌石蜡组织切片HE、Masson染色后,光镜下(×400)观察各组HE染色中心肌组织病理改变及纤维化情况并摄片,Masson染色后每张切片选取4个不重叠无血管视野(×400),采用Image-Pro plus 5.0图像扫描软件进行图像分析,计算心肌胶原容积分数(CVF),并以此作为心肌纤维化程度的量化指标。CVF(%)=胶原面积/全视野面积×100%。
1.2.5 p-JNK1/2/3、p-c-Jun含量的测定采用免疫组化SP法(SP试剂盒购自北京博奥森生物技术有限公司)检测大鼠心肌组织中p-JNK1/2/3、P-c-Jun的含量。具体步骤如下:将心肌组织切片置于68℃烤箱中40 min,脱蜡、脱水;蒸馏水冲洗2 min×3次;高压锅抗原修复;蒸馏水冲洗3 min×3次;3%H2O2去离子水37℃孵育20 min;PBS冲洗3 min×3次;山羊血清工作液封闭,37℃孵育15 min,倾去勿洗;滴加1:100兔抗鼠一抗工作液(分别为p-JNK1/2/3多克隆抗体、p-c-Jun,均购自北京博奥森生物技术有限公司)37℃孵育2 h(并用PBS缓冲液代替一抗作阴性对照);PBS冲洗3 min×3次;滴加生物素标记羊抗兔二抗,37℃孵育15~20 min,PBS冲洗3 min×3;然后滴加辣根过氧化物酶标记的链霉素卵白素工作液,37℃孵育20 min,PBS冲洗3 min×3;室温下DAB(购自北京博奥森生物技术有限公司)显色,镜下控制显色时间;自来水充分冲洗;复染;脱水;透明;中性树脂封片;镜检。每张切片中随机各取4个无血管视野(×400),利用Image-Pro plus 5.0图像扫描软件进行图像分析,测定每个视野下阳性物质的平均光密度值,Mean density =累积光密度值(IOD SUM)/面积(area)。
1.3 统计学方法采用SPSS 13.0软件进行统计学分析,数据均以(±s)表示,组间比较采用单因素方差分析,两两比较采用LSD法,并采用Pearson积差进行相关性分析,检验水平(α)为0.05。
2 结果
2.1 模型建立成功结果适应性喂养2周后,参考Zhang等[10]方法采用皮下多点注射大剂量盐酸异丙基肾上腺素(ISO)诱导产生大鼠心房纤维化模型,模型组大鼠按5 mg/kg体质量腹部皮下多点注射ISO(购自上海禾丰制药有限公司),1/d,连续7 d。而对照组给予等量生理盐水多点腹部皮下注射,1/d,连续7 d。各组大鼠于7 d后脱臼处死,通过HE染色确定心肌纤维化程度并与对照组比较,以确定造模成功。行正式实验前均行预实验,证实造模方法可行后方开始正式试验。
2.2 大鼠心房肌组织中AngⅡ的含量结果显示:对照组[(68.51±10.76)pg/L]、DMSO组[(71.47±11.49)pg/L] 中AngⅡ的含量较低,两者差异无统计学意义(P>0.05)、而干预组[(185.32±54.85)pg/L] 和模型组[(211.25±49.49)pg/L]中AngⅡ的含量较对照组和DMSO组高,差异有统计学意义(P<0.01)。
2.3 各组大鼠心肌组织纤维化程度及CVF
2.3.1 H-E染色光镜下H-E染色正常心肌组织的细胞核被染成蓝色,细胞质、肌纤维、胶原纤维和红细胞均呈红色。图中可见对照组、DMSO组心肌纤维排列规则而清晰;而模型组肌纤维扭曲肿胀、断裂、排列紊乱、细胞外间隙明显增宽,纤维化程度明显;抑制剂组纤维化程度较模型组明显减轻(图1)。

图1 各组大鼠心肌间质纤维化H-E染色结果(HE×400)
2.3.2 Masson染色和CVFMasson染色时细胞质、心肌纤维和红细胞呈红色,细胞核呈现蓝色,心房肌组织间质胶原成分被染成绿色(图2)。Masson染色后每采用Image-Pro plus 5.0图像扫描软件计算CVF。结果示:对照组[(6.842±1.674)%]、DMSO组[(7.108±1.343)%]和抑制剂组[(7.861±1.867)%]中无明显差别(P>0.05),而模型组[(29.485±9.966)%]较对照组、DMSO组、抑制剂组升高且差异有统计学意义(P<0.01)。

图2 各组大鼠心肌间质纤维化Masson染色结果(Masson ×400)
2.4 大鼠心房肌组织中p-JNK1/2/3和p-c-Jun的免疫组化染色及半定量结果如图3、4所示:正常心肌细胞的p-JNK1/2/3和p-c-Jun分布于心肌细胞胞浆中,免疫组化染色阳性呈棕黄色。各组中两者半定量分析结果(表1):对照组[分别为(0.151±0.016);(0.163±0.022)]与DMSO[分别为(0.154±0.021);(0.164±0.024)]组中两者的含量差异无统计学意义(P>0.05);模型组[分别为(0.202±0.025);(0.254±0.044)]较空白对照组与DMSO组均增加,差异有统计学意义(P<0.01);抑制剂组[分别为(0.160±0.025);(0.168±0.024)]中两者的含量与空白对照组和DMSO组比较差异无统计学意义(P>0.05),而与模型组、QUE组相比含量减少,差异有统计学意义(P<0.01)。
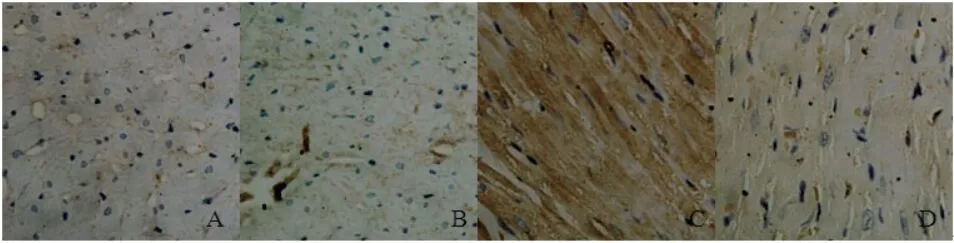
图3 各组大鼠心肌组织中p-JNK1/2/3免疫组化染色结果(免疫组化×400)
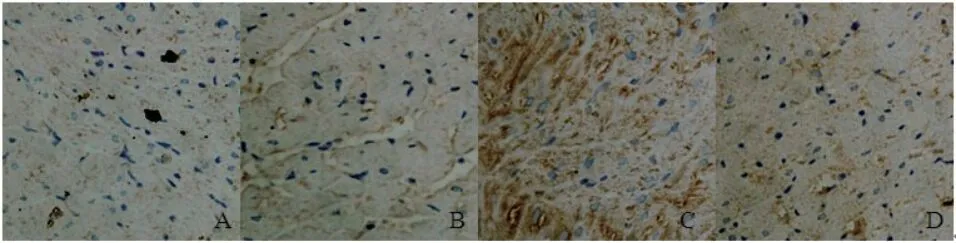
图4 各组大鼠心肌组织中p-c-Jun免疫组化染色结果(免疫组化 ×400)
表1 各组心房肌组织中p-JNK1/2/3、 p-c-Jun及CVF检测结果(±s)
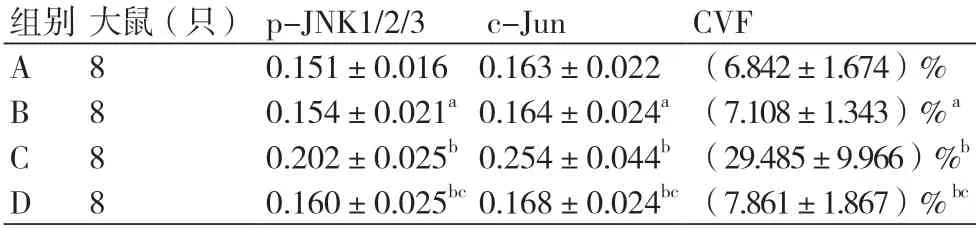
表1 各组心房肌组织中p-JNK1/2/3、 p-c-Jun及CVF检测结果(±s)
注:A、B、C、D分别代表空白对照组、DMSO组、模型组、抑制剂组。p-JNK1/2/3=磷酸化c-Jun氨基末端激酶1/2/3; p-c-Jun =磷酸化c-Jun蛋白;CVF=胶原容积分数。与A组比较,aP>0.05;与B组相比较,bP<0.01;与C组相比较,cP<0.05
组别 大鼠(只) p-JNK1/2/3 c-Jun CVF A 8 0.151±0.016 0.163±0.022 (6.842±1.674)%B 8 0.154±0.021a 0.164±0.024a (7.108±1.343)% a C 8 0.202±0.025b 0.254±0.044b (29.485±9.966)%b D 8 0.160±0.025bc 0.168±0.024bc (7.861±1.867)% bc
2.5 相关性分析采用Pearson积差相关性分析,p-JNK1/2/3和p-c-Jun的含量与心房纤维化程度呈正相关关系(r=0.881,P<0.01;r=0.862,P<0.01)。
3 讨论
AF是临床上最常见的心律失常,具有很高的致残率和致死率,其发病机制的研究一直是医学研究的热点,AF的发生与维持主要与心房的结构重构与电重构有着密切的关系,而心房纤维化是心房结构重构的重要表现形式,因此抑制心房纤维化对于AF的预防和治疗具有重要意义。研究[3,4]表明肾素-血管紧张素系统(RAS)中的主要效应分子--AngⅡ可参与心房纤维化的形成,进一步研究也[5-7]证实AngⅡ导致心肌纤维化的形成主要与激活JNK信号通路有关,而JNK通路作为真核生物中已明确的四条MAPK信号转导通路(细胞外信号调节激酶1/2通路、JNK通路、P38通路、细胞外信号调节激酶5通路)中重要的的通路之一[12],可参与诱导产生多种生物细胞学效应如:炎症、凋亡、生长及分化等。另有研究指出AF时伴有JNK信号通路的激活,并且该通路参与了AF时心房纤维化的形成[8,9]。既往研究中可以看出AngⅡ可通过激活JNK信号通路,导致心房纤维化,鲍宏刚等[13]研究已表明谷氨酰胺可通过抑制JNK信号通路改善大鼠心房纤维化,但JNK信号通路的直接抑制剂SP600125是否可通过抑制JNK信号通路的激活而起到改善AngⅡ诱导的心房纤维化尚未见相关报道,这将为临床上AF的预防或治疗提供新的思路。由于该实验样本量偏小,检验指标采用的为半定量分析方法,可能数据有一定偏差,但实验结果表明,差异显著。
本实验中大鼠大剂量皮下注射ISO 7 d后发现,模型组心肌组织中AngⅡ含量与对照组和DMSO组相比均增高,p-JNK1/2/3及p-c-Jun的表达增加,并且在模型组出现了明显的心房纤维化。表明注射ISO后,心肌组织中AngⅡ的含量升高并激活了JNK信号通路,使通路中关键蛋白p-JNK1/2/3及p-c-Jun的表达增加,促使大鼠心房肌纤维化的形成。同时说明了溶剂DMSO对JNK信号通路及大鼠心房纤维化无明显影响。
而抑制剂组给予JNK通路抑制SP600125尾静脉注射后心肌组织中p-JNK1/2/3及p-c-Jun的表达较模型组减少,心肌纤维化程度明显减轻。表明SP600125可通过抑制JNK信号通路,有效减轻AngⅡ诱发的大鼠心肌纤维化。
综上所述, 大剂量皮下注射ISO后可激活RAS系统,使心房肌组织中AngⅡ含量升高,后者可通过激活JNK信号转导通路诱发大鼠心房纤维化,而JNK通路抑制SP600125可通过抑制JNK通路的激活起到改善ISO所致大鼠心房纤维化的作用,具有潜在的临床应用价值。但由于该实验样本量偏小,检验指标采用的为半定量分析方法,可能数据有一定偏差。
