紧密连接蛋白2缺失对小鼠胆汁及胆固醇结石形成的影响分析
2020-05-09陈跃冯亚东赵向阳
陈跃,冯亚东,赵向阳
(1.南京市溧水区人民医院/东南大学附属中大医院溧水分院 消化科,江苏 南京 211200;2.东南大学附属中大医院 消化科,江苏 南京 210009)
肝胆系统的重要功能之一是胆汁的形成与分泌,该系统的功能失调可导致多种胆囊和胆道疾病,例如胆汁组成成分的不平衡会导致胆结石的形成,胆汁分泌过程的受阻会出现胆汁瘀滞[1-2]。胆汁的主要成分包括胆固醇、磷脂、胆汁酸等,其中水、离子或非离子溶质成分通过跨细胞与细胞旁途径的运动主要受渗透压驱动,上皮细胞间通过紧密连接的形式形成细胞旁屏障,紧密连接蛋白(claudin,简称Cldn)是细胞-细胞黏附分子在紧密交界处形成的细胞旁屏障,其中Cldn2在肝细胞与胆管细胞中高度表达[3]。有研究显示在Cldn2基因敲除的小鼠中细胞旁通透性和阳离子选择性缺陷可损害肾脏近端小管对Na+、Cl-和水的重吸收,显示出Cldn2在细胞旁屏障的形成及调节生物功能等方面具有重要作用[4-5]。本实验旨在探究小鼠Cldn2基因敲除后对胆汁流动及胆固醇结石形成的影响。
1 资料和方法
1.1 实验动物
自上海南方模式生物科技股份有限公司购买Cldn2-/-基因敲除小鼠(Cldn2-/-组)与Cldn2+/+野生型小鼠(Cldn2+/+组) (每组20只),周龄8~12周,给予致石饮食,致石饲料成分包括83.5%全价饲料、1.0%胆固醇、15.0%脂肪、0.5%胆酸,饲养时间为4周;小鼠禁食4 h但自由饮水后进行相关的实验研究。本研究所有操作和相关内容均经动物伦理委员会知情同意。
1.2 胆汁流速及成分检测
小鼠麻醉后固定于保温板上,并恒温于37.0 ℃。结扎胆囊管后,使用30号针头插入胆总管内,采集胆汁1 h确定流速及胆汁成分。胆汁的生化分析中首先收集肝脏和胆囊胆汁样本,通过便携式离子计(Horiba,Kyoto)测量钠离子和钾离子含量,除此以外检测的成分还包括总胆固醇、磷脂、非酯化脂肪酸、总胆汁酸和总胆红素水平。
1.3 跨上皮水渗透检测
将封闭的肝内胆管单位(IBDU)在室温下置于HEPES的缓冲液(120 mmol/L NaCl,渗透压300 mOsm)中预孵育15 min,然后置于低渗HEPES缓冲液(35 mmol/L NaCl,渗透压100 mOsm)或高渗HEPES缓冲液中(120 mmol/L NaCl,渗透压500 mOsm),通过测量管腔面积的变化间接反映封闭IBDU中水的进出,通过对小鼠胆管单元描述的方法由Image-J软件进行分析。按照同样的方法预孵育具有胆小管样结构的肝细胞,15 min后将肝细胞置于高渗HEPES缓冲液(120 mmol/L NaCl,渗透压500 mOsm)中评估小管腔内的水运动。
1.4 胆管电生理分析
按照既往文献报道的方式测量胆总管的电生理学参数[6]。简而言之,仔细分离胆总管后,将近端胆管套扎固定于双腔灌注导管中,导管远端置于涂有Sylgard的移液管中,通过移液管向胆囊腔内施加500 nA的电流,通过电极测量跨上皮电压,进一步分析跨膜电压和离子通透性。
1.5 统计学分析
采用SPSS 19.0软件进行数据的统计与分析,计量资料采用(±s),组间比较采用t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 Cldn2基因敲除后降低胆汁流速,提高胆汁脂质浓缩比
通过采集的胆囊胆汁宏观比较显示Cldn2-/-组与Cldn2+/+组相比胆汁的颜色更深更加浓缩(见图1),但两组小鼠的胆囊容量比较无统计学差异[(22.3±4.1)μLvs(23.5±2.2)μL,P=11.8];Cldn2+/+组的胆汁流速为(58.0±4.4)μL/(min·kg),约为Cldn2-/-组(29.0±3.3)μL/(min·kg)的2倍。肝脏内胆汁与胆囊胆汁组间比较基本一致,420 nm处的吸光度(对应于黄色)Cldn2-/-组显著高于Cldn2+/+组,组间差异具有统计学意义(P<0.05)。两组胆汁成分比较分析见表1,结果显示Cldn2-/-组胆汁中总胆固醇、磷脂、非酯化脂肪酸总胆汁酸及总胆红素均显著高于Cldn2+/+组(P<0.01)。这些结果表明Cldn2基因敲除降低胆汁流速、提高胆汁脂质浓缩比。

图1 Cldn2+/+组与Cldn2-/-组胆囊及肝内胆汁宏观比较
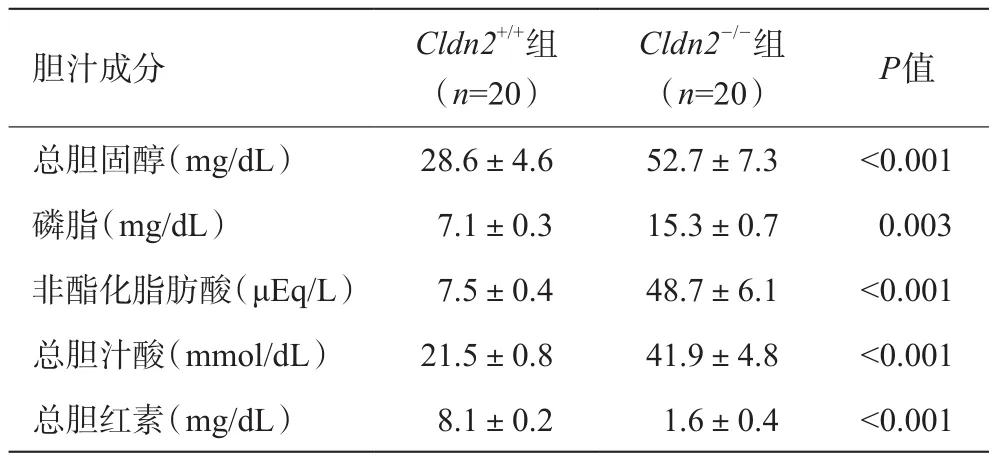
表1 Cldn2+/+组与Cldn2-/-组肝内胆汁成分分析
2.2 Cldn2基因敲除会降低肝内胆管单位(IBDU)的跨膜渗透压
将Cldn2+/+组的IBDU置于低渗缓冲液中,腔内空间立即增加且持续至90 s;相反,当IBDU置于高渗缓冲液中时,Cldn2+/+组腔内空间立即降低并且持续收缩至90 s。与Cldn2+/+组比,90 s时Cldn2-/-组具有与其相同的变化趋势,但变化幅度显著低于Cldn2+/+组,低渗时[(1.20±0.02)%vs(1.34±0.02)%,P=0.035],高渗时[(0.67±0.01)%vs(0.82±0.01)%,P=0.025]。见图2
2.3 Cldn2基因敲除降低跨上皮电传导
对胆汁及血清内的离子浓度分析见表2,结果显示:血清、肝内胆汁以及胆囊胆汁中,Cldn2-/-组胆汁中Na+低于Cldn2+/+组,K+浓度稍微高于Cldn2+/+组,跨上皮电传导显示Cldn2-/-组的胆管传导速度显著降低,分别为(7.9±0.5)ms/cm2、 (18.6±1.2)ms/cm2,提示胆管内离子的渗透降低。

图2 Cldn2-/-组与Cldn2+/+组低渗与高渗条件下跨膜渗透压比较
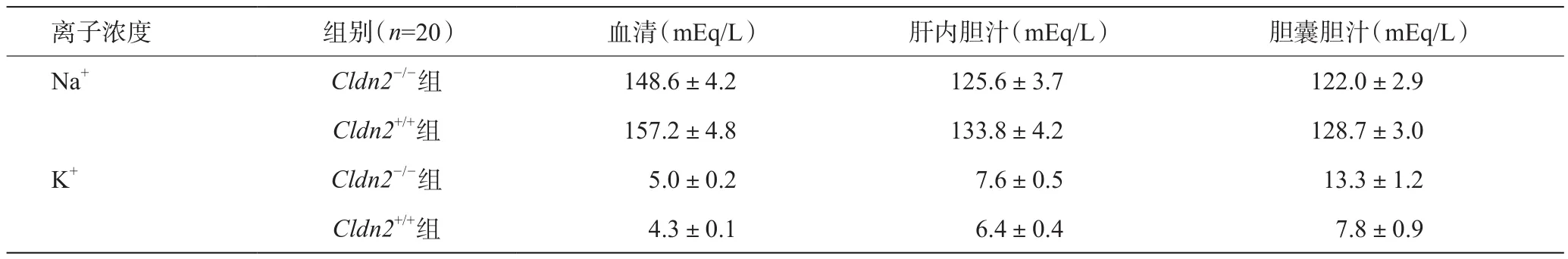
表2 Cldn2+/+组与Cldn2-/-组胆汁及血清内的离子浓度比较
2.4 Cldn2基因敲除增强胆固醇结石形成倾向
经过为期4周的致石饮食处理,所有Cldn2-/-组均宏观可见胆固醇结石形成,胆固醇结石形成比例100%,而Cldn2+/+组中仅1例见结石形成;8周后观察Cldn2+/+组中接近一半小鼠(7例/46.7%)有结石形成。显微镜下观察,Cldn2-/-组胆汁中微小结晶数显著增加(P<0.001)。

表3 Cldn2+/+组与Cldn2-/-组胆固醇结石形成风险比较
3 讨论
本研究的结果显示,肝胆管细胞中Cldn2基因的异常缺乏可影响细胞旁渗透途径,调控胆汁的成分和分泌量,增加胆结石形成的易感性。通常情况下胆汁酸自肝细胞分泌至胆小管内,并且在经过胆管和胆囊的过程中被修饰而形成最终的胆汁[7-9]。从血流中摄取或肝细胞产生的胆汁酸与其他有机阴离子通过肝细胞顶端的细胞膜转运至小管腔内,这些溶质集中在小管腔内并形成渗透压,诱导水分子跨上皮转运至胆小管中形成胆汁流。胆管细胞分泌HCO3-、Cl-并且重新收胆汁酸、谷氨酸、葡萄糖和其他分子,胆汁在流经肝内胆管期间通过调节分泌和重吸收对水分含量进行控制。而本研究发现Cldn2基因的表达缺失会导致胆汁流经肝内胆管时Na+、K+浓度降低,跨膜渗透压减少,水分子的跨上皮转运过程受到抑制。
目前研究认为胆固醇结石的发病受多种因素影响的,包括遗传和环境因素,但水分的降低和胆固醇浓度过饱和是胆固醇结晶核化的关键因素。通常情况下水分子的跨上皮运输存在两种途径[10-12],即通过转运蛋白的跨细胞途径及通过细胞之间紧密连接的细胞旁途径。研究发现:肝胆系统中水分子的跨细胞途径是通过水通道蛋白(AQP)完成的,啮齿动物肝细胞主要表达AQP0、AQP8及AQP9,AQP8,位于细胞内囊泡和小管质膜,参与小管水分泌;AQP9则主要位于基底外侧质膜,这种分布特点有利于水分自跨细胞途径输送至小管腔内[13-15]。胆管细胞表达AQP1及AQP4,AQP1缺失可降低胆管细胞中水分子的渗透性,但是对胆汁的流动性几乎没有影响。在本研究中我们发现Cldn2-/-组虽然也会表现出胆汁流动,但流速仅为Cldn2+/+组的一半,提示Cldn2基因并不直接影响水通道蛋白的表达和功能从减少胆汁酸的形成。由于胆汁酸和有机阴离子是胆汁流动的主要驱动力[16-19],Cldn2基因正是通过影响胆汁酸中的离子浓度,进而改变胆汁酸形成过程中的跨膜渗透压,间接影响水分子的细胞旁转运过程,最终表现为Cldn2-/-小鼠胆汁流动受阻,胆固醇结石的形成。
Cldn2是第一个也是研究最多的紧密连接蛋白,通过形成阳离子选择通道,增加细胞旁阳离子渗透[20]。肾脏中Cldn2缺失导致小鼠近端小管的阳离子选择性丧失,并且细胞旁抗性增加和阳离子选择性障碍导致NaCl的严重缺失。这在本研究中也得到了相应的证实,Cldn2-/-小鼠胆汁中脂质和胆汁酸浓度更高,而Na+稍微低于Cldn2+/+小鼠,导致Cldn2-/-小鼠中跨上皮电传导速度显著降低,提示Cldn2基因敲除后可能通过降低阳离子的渗透性导致胆汁的流动减弱。
当前的结果提供了一种新的胆汁酸微循环模型,Cldn2的不均匀分布有利于肝脏内的血液与胆管之间物质的交换和运输:由于Cldn2在周围区域中表达量较高,因此水分子进入胆小管主要发生于该区域;基底外侧质膜的周围区域中AQP9的高表达亦有利于水分子的跨膜转运。加之胆小管是一个盲端结构,局部高效率的水分子转运使得更多的水分集中在胆小管起始处,促进了胆汁的平滑流动。
综合本研究初步结果,我们认为:胆汁的成分和分泌量在一定程度上受Cldn2缺失引起的细胞旁分泌方式的水渗透途径的调节,这为预防胆结石疾病提供了新的靶点。