高强度聚焦超声联合全氟戊烷液滴在乳腺癌治疗增效中的实验研究
2020-05-09余倩高乙惠许萍萍姚一静王芮陈旖旎姜立新
余倩,高乙惠,许萍萍,姚一静,王芮,陈旖旎,姜立新
高强度聚焦超声联合全氟戊烷液滴在乳腺癌治疗增效中的实验研究
余倩,高乙惠,许萍萍,姚一静,王芮,陈旖旎,姜立新
(上海交通大学附属第六人民医院,上海 200030)
探讨高强度聚焦超声(High-Intensity Focused Ultrasound, HIFU)联合全氟戊烷液滴(Perfluoropentane droplets, PFP),对小鼠乳腺癌4T1细胞治疗的增效作用。制备PFP,检测其平均粒径及形态结构。试验设立三组:HIFU假照组,单纯HIFU治疗组,HIFU联合PFP治疗组。流式细胞仪检测HIFU分组治疗乳腺癌细胞后细胞存活率及死亡率;体内动物试验分组处理后,二维超声观察HIFU辐照前后肿瘤回声灰度变化情况,超声造影剂灌注缺损面积占总面积百分比评价不同治疗方式对裸鼠皮下移植瘤的消融能力。所制备的PFP平均粒径为1.2 μm,形态呈规则球形。细胞试验显示,HIFU联合PFP治疗组乳腺癌细胞死亡率(23.50±1.34)%显著高于单纯HIFU治疗组(14.34±0.55)%和HIFU假照组(11.76±0.62)%(<0.05);动物试验显示HIFU联合PFP治疗组肿瘤消融面积占总面积百分比(84.03±4.47)%显著高于单纯HIFU治疗组(41.23±4.24)%(<0.05),HIFU假照组无明显灌注缺损区域。HIFU联合PFP可显著增强对乳腺癌细胞及组织的消融能力。
高强度聚焦超声;乳腺肿瘤;全氟戊烷液滴;治疗
0 引言
乳腺癌是女性常见的恶性肿瘤,在中国城乡女性常见癌症中排第五位[1]。目前,乳腺癌的微创治疗包括冷冻消融、射频消融、激光消融、微波消融和高强度聚焦超声(High-Intensity Focused Ultrasound, HIFU)消融[2-4]。
全氟戊烷液滴(Perfluoropentane droplets, PFP)具有液气相变的特性,其常温下为液体状态,温度升高或高强度超声辐照能使其转化为气态,该过程也被称为声致相变效应(Acoustic Droplet Vaporization, ADV)[5],HIFU作用下PFP可产生气泡,声波下气泡的振荡和破裂可增强HIFU治疗空化效应,提高产热能力,潜在地增强HIFU消融效率[6-7]。本试验从细胞及动物两个层面,探讨HIFU联合PFP在乳腺癌治疗增效中的可行性及有效性。
1 材料和方法
1.1 仪器和试剂
主要仪器:细胞培养箱(Hyclone, 美国),流式细胞分析仪(Beckman Coulter, 美国),小动物脉冲型聚焦超声肿瘤治疗仪(无锡海鹰电子医疗系统有限公司),超声诊断仪(MyLabTM90, Esaote, 意大利)。
主要试剂:RPMI-1640培养基(Gibco, 美国),胰蛋白酶(Gibco, 美国),PBS缓冲液(Gibco, 美国),胎牛血清(Ausbian, 澳大利亚),青霉素-链霉素双抗(Hyclone, 美国),活细胞/死细胞双染试剂盒(Calcein-AM/PI, 中国上海贝博公司),超声造影剂(SonoVue, Milan, 意大利)。
1.2 细胞株与细胞培养
鼠源性乳腺癌4T1细胞株购于中国科学院上海典藏细胞库,乳腺癌细胞为贴壁生长。使用RPMI-1640培养基培养乳腺癌4T1细胞,培养基中含1%青霉素-链霉素双抗溶液,9%胎牛血清,细胞放置于37°C饱和湿度及5% CO2培养箱中培养,每2~3天传代一次。当4T1细胞达到对数生长期时进行消化离心制备成单细胞悬液,进行细胞计数,细胞实验时使用六孔板培养细胞,每个孔中加入2 mL配置好的RPMI-1640培养基及1×105个乳腺癌4T1细胞。
1.3 实验方法
1.3.1 乳腺癌皮下移植瘤模型构建
模型采用裸鼠(Balb/c nude mice)作为实验动物(上海西普尔-必凯实验动物有限公司,SCXK(沪)2013-0016),约6周龄,饲养于上海市第六人民医院动物房无特定病原体(Specific Pathogen Free, SPF)级屏障设施中。鼠源性乳腺癌4T1细胞作为瘤源,将对数生长期的4T1细胞制成细胞悬液,1 mL PBS重悬后用细胞计数板进行细胞计数,于裸鼠背部皮下注射约每200 μL 5×106~10×106个的细胞量。用手固定小鼠,75%乙醇棉球消毒小鼠背部皮肤,后将细胞悬液注射到小鼠右侧背部皮下形成皮丘,缓慢退针,确保穿刺点无液体渗出。注射后每天持续观测瘤鼠状态及肿瘤生长情况,定期测量裸鼠肿瘤的最长径(单位mm)、最宽径(单位mm)。
1.3.2 全氟戊烷液滴制作
实验所用的相变全氟戊烷液滴(PFP)制备与文献[8-9]所用方法相同。简而言之,25%全氟戊烷(Strem Chemicals, 美国)和75%脂质在声振仪细胞破碎仪(450 Digital Sonifier, 美国)中处理30 s,设置功率为10 W。所得混合溶液于4°C储存。实验前采用库尔特粒度仪(Beckman Coulter, 美国)对稀释一万倍后的液滴数目及直径进行测量,所测液滴的平均粒径为1.2 μm,其中99%的粒径小于3 μm。在用于实验之前,使用PBS将液滴密度稀释至每mL 1.5×107个的细胞量。显微镜下全氟戊烷微滴照如图1所示。

图1 显微镜下全氟戊烷微滴照(标尺20 μm)
1.3.3 小动物HIFU肿瘤治疗仪参数
治疗探头工作频率:4.00 MHz,焦距:11.5 mm,焦域横向尺寸(-6 dB):0.78 mm× 0.57 mm,焦域纵向尺寸(-6 dB):9.2 mm,最大输出功率:29.05 W,最大声强:8.14×103W·cm-2。
1.3.4 细胞试验HIFU分组治疗及流式细胞仪检测
按上述方法将4T1细胞置于六孔板内,分为HIFU假照组,单纯HIFU治疗组和HIFU联合PFP治疗组,每组各6孔。实验方法:(1) HIFU假照组,HIFU假照;(2) 单纯HIFU治疗组,孔内加入生理盐水0.1 mL,输入前述固定参数辐照30次;(3) HIFU联合PFP治疗组,孔内加入0.1 mL稀释后的PFP,输入前述固定参数辐照30次。HIFU辐照实景图如图2所示,为了减少六孔板内辐照能量的衰减,避免探头直接接触六孔板底部,探头与孔板之间放置厚度为5 mm的导声垫。
HIFU辐照后将不同分组的细胞放置于37°C、5% CO2培养箱中培养48 h后,对瓶内细胞进行消化离心(转速为1000 r·min-1,时长为5 min),并用PBS多次洗涤细胞后,按照活细胞/死细胞染色试剂盒操作说明,加入Calcein-AM染色液避光孵育15~30 min后再加入PI染色剂孵育1~5 min,用PBS多次洗涤细胞后重悬,使用流式细胞仪上机检测。荧光特性如下,Calcein-AM: 激发波长E=490 nm, 发射波长E=515 nm; PI:E=535 nm,E=617 nm。

图2 HIFU 辐照乳腺癌细胞实景图
1.3.5 荷瘤鼠的HIFU分组治疗及超声评价
荷瘤裸鼠(Balb/c)30只,雌性,约6周龄,肿瘤生长至28 d(最长径约8~10 mm,开始治疗),随机分为HIFU假照组,单纯HIFU治疗组和HIFU联合PFP治疗组,每组各10只。实验方法:碘伏常规消毒后,1%无巴比妥钠10 μL·g-1腹腔注射麻醉,麻醉起效后进行分组治疗:(1) HIFU假照组,肿块表面涂以超声耦合剂,HIFU假照;(2) 单纯HIFU治疗组,尾静脉注射生理盐水0.1 mL,30 min后肿块表面涂以超声耦合剂,输入前述固定参数辐照30次;(3) HIFU联合PFP治疗组,尾静脉注射稀释后的PFP 0.1 mL,30 min后肿块表面涂以超声耦合剂,输入前述固定参数辐照30次。
治疗前后分别使用二维超声观察肿块大小形态及回声灰度变化情况,HIFU治疗结束后即刻进行超声造影(MyLabTM90, Esaote, Italy, 12 MHz线阵探头)。首先,在二维模式下确定肿瘤位置,并在瘤鼠尾静脉插入一根静脉输液针。随后,混匀超声造影剂,将0.2 mL造影剂通过尾静脉以团状注射方式注入,以1 mL生理盐水冲管。选取皮下瘤最大横截面作为观察平面,并在造影剂注射时启动视频录制。造影结束后,选取最大横截面用Image J软件计算肿瘤充盈缺损区域面积。
1.4 统计分析

2 实验结果
2.1 细胞试验结果
流式检测结果图3所示,横坐标为Calcein-AM染色结果,阳性代表活细胞;纵坐标为PI染色结果,阳性代表死细胞。图4的结果表明,HIFU假照组细胞存活率最高(88.62±0.62)%,死亡率最低(11.76±0.62)%,其次为单纯HIFU治疗组,存活率为(85.66±0.55)%,死亡率为(14.34±0.55)%,HIFU联合PFP治疗组细胞存活率最低(75.94±1.34)%,死亡率最高为(23.50±1.34)%,进行两两比较,各组间的细胞存活和死亡率均具有统计学意义(<0.05)。

图3 流式细胞仪检测图
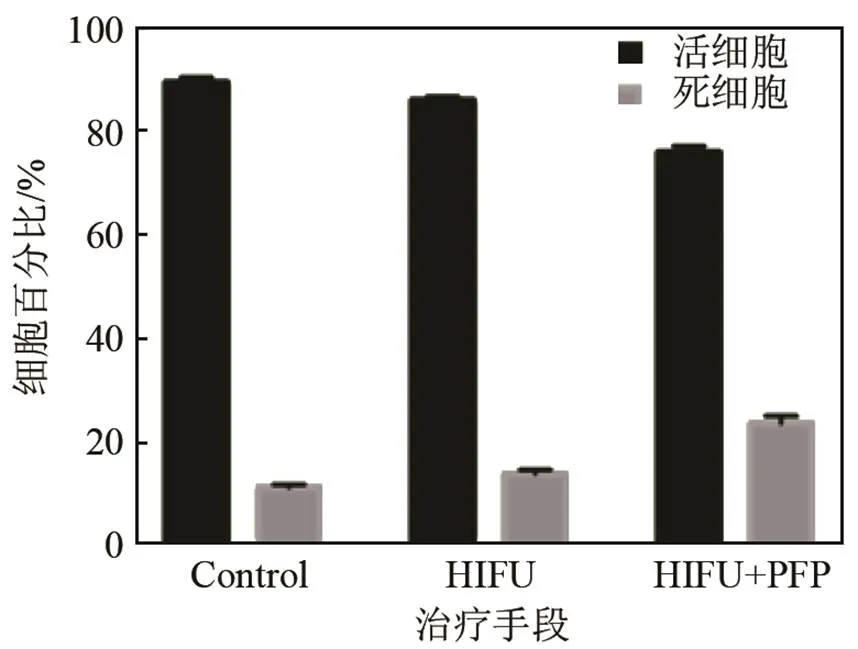
图4 不同组活细胞及死细胞百分比(%)
2.2 动物试验结果
单纯HIFU治疗组和HIFU联合PFP治疗组肿瘤消融面积百分比如图5所示,HIFU联合PFP治疗组肿瘤充灌注损面积占总面积百分比(84.03±4.47)%,显著高于单纯HIFU治疗组(41.23±4.24)% (<0.05)。图6显示了HIFU治疗前后肿瘤的二维超声及超声造影图像。3组肿瘤区域HIFU治疗前,二维超声均表现为形态规则,边界清晰的均匀低回声区。HIFU假照组超声造影表现为造影剂在肿块内快速而均匀地强化,无灌注缺损区(图6中a1、a2、a3);单纯HIFU治疗组治疗后二维超声可见肿块内点状、小片状回声增高区,超声造影显示肿块中心少量灌注缺损区,周围呈环形强化(图6中b1、b2、b3);HIFU联合PFP治疗组,HIFU辐照后二维超声观察到肿块回声的显着变化,呈均匀高回声,超声造影显示肿块大部分区域无造影剂灌注,周边见少量环形强化(图6中c1、c2、c3)。

图5 单纯HIFU治疗组和HIFU联合PFP治疗组肿瘤消融面积百分比
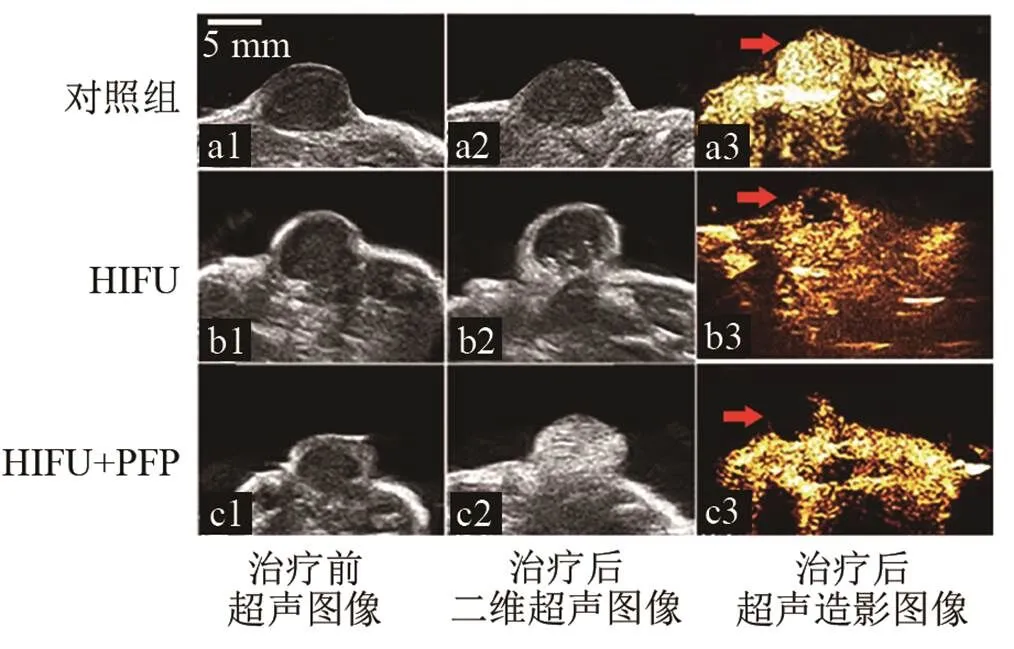
图6 荷瘤鼠HIFU治疗前后二维超声及超声造影图像(箭头所示为HIFU辐照区域,标尺 5 mm)
3 讨论
HIFU消融作为乳腺癌局部微创治疗的手段[10],与射频消融等相比具有非侵入性的特点,其消融肿瘤组织的机制主要为机械效应、空化效应及热效应,并可以与放疗及化疗等结合使用以增强肿瘤治疗效果[11-12]。
在临床工作中,由于组织声衰减,使得治疗较大的实体肿瘤时需要更高的声能和更长的时间,为了提高HIFU在乳腺肿瘤中的临床效用,需要增加HIFU消融效率以及缩短治疗时间,减少患者痛苦和并发症的发生率,HIFU增效剂的研究逐渐引起重视。相变型液态氟碳材料受到研究者的关注[13],该材料可在HIFU的高声压和产热作用下,发生相变产生气泡,作为外源性空化核,能降低空化阈值促进空化发生,气泡的非线性振动有利于超声产生热量,可在超声作用下爆破产生机械效应导致细胞损伤,引起肿瘤微血管的破裂提高HIFU疗效,并且气泡相互融合可阻塞微血管,造成肿瘤内部缺氧的同时减少肿瘤细胞进入血液循环[14]。
Zhang等[15]使用含白蛋白的凝胶模块,通过对白蛋白变性情况的观察来判断HIFU联合相变纳米乳剂治疗效果,研究发现纳米乳剂产生的气泡可显著减少凝胶模块中蛋白变性所需的时间及声功率。王修杰等[16]使用不同强度的HIFU处理人乳腺癌细胞MCF-7,观察到HIFU作用下细胞增殖减少,凋亡增加及热休克蛋白的表达增加,表明HIFU具有明显损伤癌细胞及抑制其生长的作用。本试验使用同等强度的HIFU辐照小鼠乳腺癌4T1细胞,增加了HIFU联合PFP治疗,结果显示联合治疗相较于单纯HIFU治疗可显著提高乳腺癌细胞死亡率,试验表明HIFU联合PFP治疗在细胞层面具有增效作用,为进一步进行体内验证打下基础。
Gao等[17]通过超声造影评价临界温度聚焦超声(sub-threshold focused ultrasound, FUS)消融裸鼠皮下瘤效果,与MRI相较,超声造影具有实时动态显像,简便易操作及耗时短等优点,并且造影剂无灌注区能很好地显示肿瘤内部坏死区域。陈莉等[18]使用超声造影剂评价高强度聚焦超声治疗骨肿瘤的疗效,治疗区域显示为造影剂灌注缺损区,而未治疗的肿瘤组织仍有超声造影剂灌注,结果表明超声造影成像能清楚地显示肿瘤范围及治疗后灌注缺损区的大小。本研究利用二维超声及超声造影评价裸鼠皮下移植瘤HIFU治疗效果,结果显示相同HIFU治疗参数下,HIFU联合PFP治疗后肿瘤内部灌注缺损面积占总肿瘤面积百分比显著高于单纯HIFU治疗,试验表明HIFU联合PFP治疗在动物体内具有增效可行性。
综上所述,本试验通过细胞及动物两个层面验证了HIFU联合PFP在乳腺癌治疗增效中的可行性及有效性,为临床实践提供理论基础。
4 结语
本研究针对相同HIFU辐照参数联合相同浓度PFP对乳腺肿瘤消融的影响,未涉及HIFU强度变化及PFP浓度变化。在后续研究中,可设置不同HIFU辐照强度与不同PFP浓度的组合,进一步对HIFU联合PFP消融乳腺癌细胞及组织的最佳协同剂量进行研究。
[1] GUAN L M, XU G. Damage effect of high-intensity focused ultrasound on breast cancer tissues and their vascularities[J]. World J Surg Oncol, 2016, 14(1): 153-153.
[2] OKITA K, NARUMI R, AZUMA T, et al. Effects of breast structure on high-intensity focused ultrasound focal error[J]. J Ther Ultrasound, 2018(6): 4-16.
[3] 卫刚. 高强度聚焦超声治疗乳腺癌的临床研究[D]. 合肥: 安徽医科大学, 2014.
WEI Gang. Clinical research of high intensity focused ultrasound treatment of breast cancer[D]. Hefei: Anhui Medical University, 2014.
[4] HAAR G T. HIFU Tissue ablation: concept and devices[J]. Adv Exp Med Biol, 2016, 880: 3-20.
[5] LIN C Y, PITT W G. Acoustic droplet vaporization in biology and medicine[J]. Biomed Res Int, 2013: 404361.
[6] 朱媚莉, 张爱丽, 向昱, 等. 全氟戊烷微滴乳剂增强HIFU疗效的研究[J]. 中国医疗器械杂志, 2013, 37(3): 169-172.
ZHU Meili, ZHANG Aili, XIANG Yi, et al. Perfluoropentane droplets enhanced HIFU therapeutic effect[J]. Chinese Journal of Medical Instrumentation, 2013, 37(3): 169-172.
[7] ALIABOUZAR M, KUMAR K N, SARKAR K. Acoustic vaporization threshold of lipid-coated perfluoropentane droplets[J]. J. Acoust. Soc. Am., 2018, 143(4): 2001.
[8] FABIILLI M L, HAWORTH K J, FAKHRI N H, et al. The role of inertial cavitation in acoustic droplet vaporization[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 2009, 56(5): 1006-1017.
[9] ZHU M L. JIANG M L, FABIILLI A, et al. Treatment of murine tumors using acoustic droplet vaporization-enhanced high intensity focused ultrasound[J]. Phys Med Biol, 2013, 58(17): 6179-6191.
[10] MAURI G L, NICOSIA Z, XU S, et al. Focused ultrasound: tumour ablation and its potential to enhance immunological therapy to cancer[J]. Br J Radiol, 2018, 91(1083): 20170641.
[11] MALONEY E, HWANG J H. Emerging HIFU applications in cancer therapy[J]. Int J Hyperthermia, 2015, 31(3): 302-309.
[12] van den BIJGAART R J, D C EIKELENBOOM, HOOGENBOOM M. et al. Thermal and mechanical high-intensity focused ultrasound: perspectives on tumor ablation, immune effects and combination strategies[J]. Cancer Immunol Immunother, 2017, 66(2): 247-258.
[13] SHPAK O, VERWEIJ M, VOS H J, et al. Acoustic droplet vaporization is initiated by superharmonic focusing[J]. Proc Natl Acad Sci USA, 2014, 111(5): 1697-1702.
[14] XIN Y, ZHANG A, XU L X, et al. The effects on thermal lesion shape and size from bubble clouds produced by acoustic droplet vaporization[J]. Biomed Eng Online, 2018, 17(1): 163-163.
[15] ZHANG P, KOPECHEK J A, PORTER T M. The impact of vaporized nanoemulsions on ultrasound-mediated ablation[J]. J Ther Ultrasound, 2013(1): 2-2.
[16] 王修杰, 袁淑兰, 张洁, 等. 高强度聚焦超声对人乳腺癌细胞的生长抑制作用及机理研究[J]. 四川大学学报(医学版), 2004, 01: 60-63.
WANG Xiujie, YUAN Shulan, ZHANG Jie, et al. A study of the inhibition effect of HIFU and its mechanism of action on the proliferation of human breast cancer cells[J]. J Sichuan Univ (Med Sci Edi), 2004, 35(1): 60-63.
[17] GAO Y H, WU L, WANG R, et al. Contrast-enhanced ultrasound evaluation of pancreatic cancer xenografts in nude mice after irradiation with sub-threshold focused ultrasound for tumor ablation[J]. Oncotarget, 2017, 8(23): 37584-37593.
[18] 陈莉, 姜立新, 胡兵. 超声造影早期评价HIFU治疗兔移植性骨肿瘤的初步研究[J]. 声学技术, 2016, 35(5): 430-434.
CHEN Li, JIANG Lixin, HU Bing. Preliminary research on evaluating efficacy of HIFU treatment for transplantable VX2 bone tumor with contrast-enhanced ultrasound[J]. Technical Acoustics, 2016, 35(5): 430-434.
Treatment of breast cancer using perfluoropentane droplets enhanced high-intensity focused ultrasound: an experimental study
YU Qian, GAO Yihui, XU Pingping, YAO Yijing, WANG Rui, CHEN Yini, JIANG Lixin
(Shanghai Jiaotong University Affiliated Sixth People's Hospital, Shanghai 200030, China)
To investigate the synergistic effect of high-intensity focused ultrasound (HIFU) combined with perfluoropentane droplets (PFP) on the treatment of mouse breast cancer 4T1 cells.PFP were prepared and their average particle size and morphology were examined. Three groups were set up in the experiment: blank control group, HIFU treatment group, HIFU combined with PFP treatment group, and the ability of HIFU combined with PFP for increasing the efficacy of 4T1 cells therapy in vitro was detected by flow cytometry; B-mode ultrasound was used to observe the gray changes before and after HIFU ablation and the percentage of perfusion defect in contrast-enhanced ultrasound to evaluate the synergistic ablation ability of HIFU combined with PFP for subcutaneously transplanted tumors in nude mice.The average particle size of the prepared PFP was 1.2 μm, and the shape was regular spherical. Cell tests showed that 4T1 cells mortality (23.50 ± 1.34)% in the HIFU combined with PFP treatment group was significantly higher than that in the HIFU-treated group alone (14.34 ± 0.55)% and that in the HIFU sham group (11.76 ± 0.62)%, (P <0.05). Animal experiments showed that the percentage of tumor necrotic area in the HIFU combined with PFP treatment group (84.03 ± 4.47)% was significantly higher than that in the HIFU treatment group alone (41.23 ± 4.24)%, (P <0.05), there was no obvious perfusion defect in the blank control group.HIFU combined with PFP can significantly enhance the ablation ability of breast cancer cells and tissues.
high-intensity focused ultrasound; breast cancer; perfluoropentane droplets; treatment
TB559
A
1000-3630(2020)-02-0195-05
10.16300/j.cnki.1000-3630.2020.02.012
2020-01-02;
2020-02-15
国家自然科学基金面上项目(81771850)、上海交通大学医工交叉基金(YG2017MS19)资助项目。
余倩(1993-), 女, 重庆人, 硕士研究生, 研究方向为肿瘤的超声治疗。
姜立新, E-mail: jinger_28@sina.com
