超声提取蜂胶黄酮的研究
2020-05-09卢燕珊彭文君贲永光
卢燕珊,彭文君,贲永光,
超声提取蜂胶黄酮的研究
卢燕珊1,彭文君2,贲永光1,2
(1. 广东药科大学药学院,广东广州 510006;2. 中国农业科学院蜜蜂研究所农业农村部授粉昆虫生物学重点实验室,北京 100093)
蜂胶黄酮是蜂胶的主要活性成分,具有抗氧化、抗菌等多种功效。优化蜂胶黄酮的超声提取工艺,为蜂胶产品的开发与利用提供了理论依据。首先进行了单因素试验,研究超声功率、超声时间和乙醇浓度这三个因素分别对蜂胶黄酮提取得率的影响。在此基础上,再采用响应面法优化蜂胶黄酮的超声提取条件。研究结果表明,影响蜂胶黄酮提取得率的主次因素依次是超声时间、乙醇浓度和超声功率。当超声功率为150 W、超声时间为16 min、乙醇浓度为86%时,蜂胶黄酮提取得率实际最大可达到21.10%±0.075% (=3)。经本实验分析可知,湖北孝感蜂胶属于蜂胶中的优等品。相比于其他超声提取蜂胶黄酮的方法,该实验的超声提取方法具有提取温度低、提取时间短的优势。
蜂胶黄酮;超声;提取得率;响应面法
0 引言
蜂胶是由蜜蜂采集的树脂和其腺体分泌物等形成的一种黏性胶状固体物质。蜜蜂用它来修补蜂巢,一方面可以抵御外敌入侵,另一方面可以抑制蜂巢内微生物的生长。蜂胶的成分极其复杂,现已被鉴定其含有20大类共300多种成分,主要含有黄酮类、酚酸类、萜烯类、酯类、甾体类、氨基酸和维生素等[1]。蜂胶的成分并非是一成不变的,它的成分是由地理区域、采集季节、植物种类和蜜蜂种群等因素所决定的。蜂胶具有广泛的药理活性,如抗细菌、抗真菌、抗炎、抗病毒、抗肿瘤、抗氧化活性和免疫调节作用[2]。近年来,蜂胶已经被广泛应用于食品工业、化妆品工业和药品工业等方面。黄酮类化合物是蜂胶的重要活性物质,它具有抗氧化、抗微生物、抗癌和免疫调节等多种生物活性。因此,优化蜂胶黄酮的提取工艺,提取蜂胶黄酮的产率,对蜂胶的开发和研究有重要的参考价值,对工业和社会的发展有重要意义。
目前,提取蜂胶黄酮的方法有很多种,主要有浸渍法、加热回流法、微波提取法、超声提取法、超高压提取法和超临界CO2萃取法。浸渍法操作简便,但耗时长并且需要大量的溶剂;加热回流法溶剂用量较小,但操作麻烦,提取时间长,提取温度较高,活性成分易被破坏;微波提取法工艺简便,提取时间短,但是较高的提取温度容易破坏活性成分;超高压提取法和超临界CO2萃取法耗时短,耗能低,无污染,但是设备成本较高[3]。相比于上述的提取方法,超声提取法设备简单,操作简便,耗时短,效率高,耗能低,溶剂用量较小。超声波通过机械作用和空化效应降低原材料的粒径大小,有效地破坏细胞结构,加强溶出物的传质速率,从而提高产率[4]。
本实验以湖北蜂胶为原料,超声提取蜂胶黄酮,采用响应面法优化超声提取工艺,以期获得最佳提取工艺条件,为蜂胶黄酮资源的开发利用提供理论基础。
1 实验材料与方法
1.1 实验材料
实验所用材料有:蜂胶(湖北孝感蜜蜂养殖场),芦丁标准品(上海源叶生物科技有限公司),DFY-600型万能粉碎机,FA2004电子天平(上海舜宇恒平科学仪器有限公司),KQ-300DE数控超声波清洗器(昆山市超声仪器有限公司),UV-5500PC紫外可见分光光度计(上海元析仪器有限公司),其余化学试剂均为分析纯级别。
1.2 实验方法
1.2.1 芦丁标准曲线的制备
采用三氯化铝比色法测定芦丁的标准曲线[5]。分别精密吸取1.0、2.0、3.0、4.0、5.0、6.0 mL的芦丁储备液(质量浓度为0.2 mg·mL-1)到25 mL容量瓶中,加入5.0 mL三氯化铝溶液(浓度为0.1 mol·L-1),然后用95%乙醇定容。摇匀,静置15 min后,用紫外可见分光光度计测定其在400 nm波长处的吸光度。以芦丁的质量浓度(单位mg·mL-1)作为横坐标,吸光度作为纵坐标,绘制标准曲线,得到的回归方程为
式(1)中:为芦丁的质量浓度,mg·mL-1;为吸光度;为相关系数。
1.2.2 超声提取蜂胶黄酮
将粗蜂胶放置在-5℃的冰箱中冰冻24 h后,用万能粉碎机快速粉碎已变得硬脆的粗蜂胶并通过20目筛,然后将已过筛的蜂胶粉末置于冰箱中保存。实验流程图如图1所示。称取1 g蜂胶粉末到试管中,加入一定浓度的乙醇溶液20 mL,再将试管固定在超声清洗槽内左上角,槽内水的高度为10 cm,试管插入水面以下6 cm。在40℃水温条件下,用设定功率的超声进行处理。结果显示,槽内水温在试验过程中变化较小,基本在40~43℃范围,试验可忽略温度的变化。
1.2.3 蜂胶黄酮提取得率的测定
超声提取后,将提取液在4 000 r·min-1的转速下离心10 min,收集上清液。然后采用三氯化铝比色的方法测定蜂胶黄酮的含量。蜂胶黄酮提取得率的计算公式如下:

式中:为蜂胶黄酮提取得率,%;为蜂胶黄酮的质量浓度,mg·mL-1;为提取体积,mL;为蜂胶的质量,g。
1.2.4 实验设计
1.2.4.1 单因素试验
探究超声功率(120、150、180、210、240 W),超声时间(1、6、11、16、21 min),乙醇浓度(50%、60%、70%、80%、90%)分别对蜂胶黄酮提取得率的影响。
1.2.4.2 响应面试验
基于单因素试验的结果,采用三因素三水平的Box-Behnken试验设计(Box-Behnken Design, BBD)进一步优化蜂胶黄酮提取的自变量(超声功率,超声时间,乙醇浓度)[6]。自变量的水平范围如表1所示,Box-Behnken实验设计如表2所示。
2 结果与讨论
2.1 单因素试验结果
2.1.1 超声功率对蜂胶黄酮提取得率的影响
实验结果如图2a所示。随着超声功率的增加,提取得率先增加并在180 W时达到最大值,随后降低。增加超声功率会加强空化效应,产生更多的空化气泡,加快传质速率,从而提高提取得率。但是超声功率太高会破坏蜂胶黄酮的结构,导致提取得率降低[6],因此180 W是较佳的提取功率。

表1 Box-Behnken设计的因素与水平
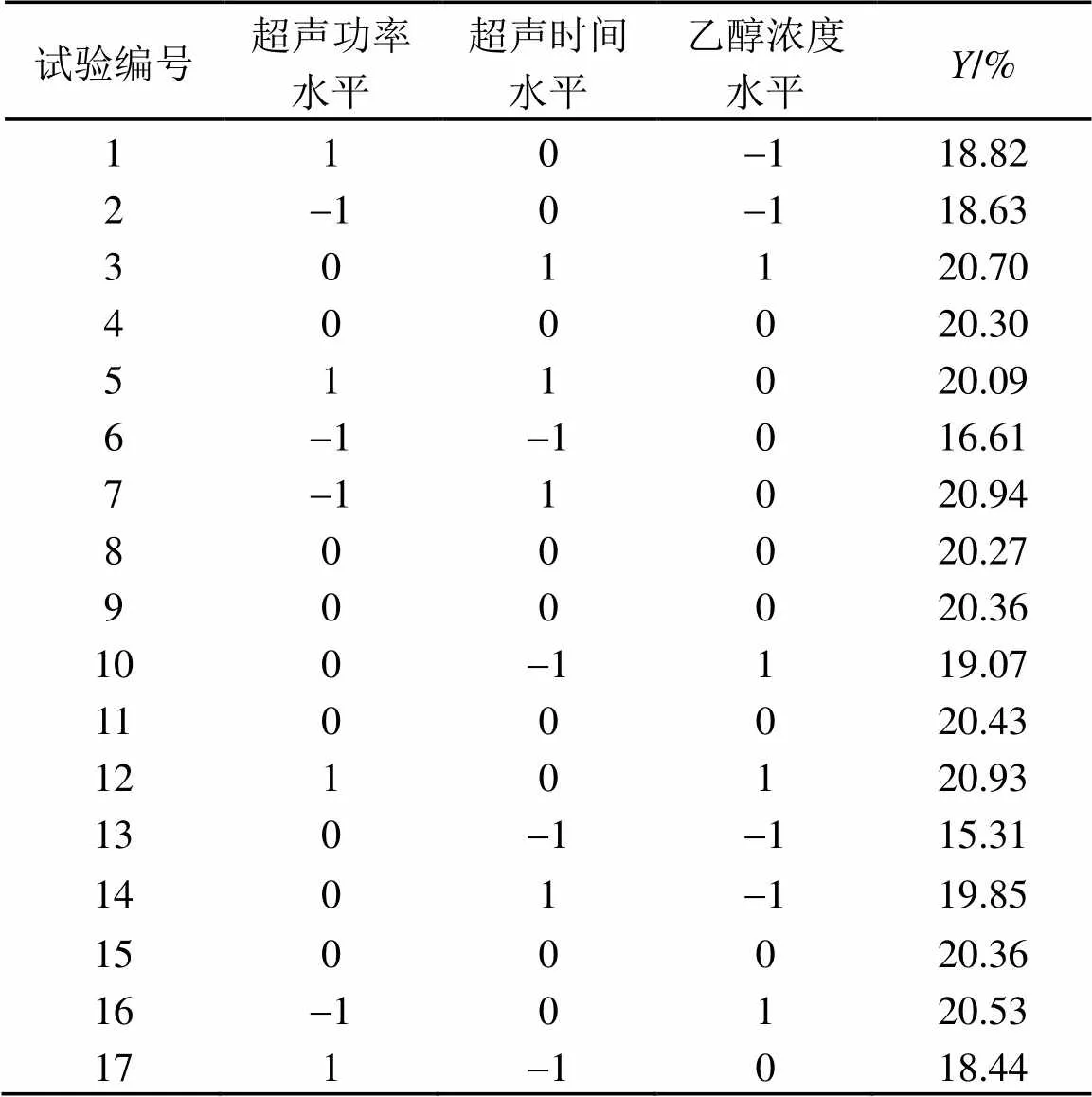
表2 Box-Behnken设计的实验结果
2.1.2 超声提取时间对蜂胶黄酮提取得率的影响
实验结果如图2(b)所示。逐渐增加超声提取时间,提取得率先快速地增加并在11 min时达到最大值,然后缓慢地降低。由超声波产生的空化气泡在急剧崩溃破灭时会释放出很大的能量,这些能量不仅使细胞破裂,而且在固液界面上产生湍流振动,从而加快传质速率,提高提取得率。超声时间过长可能会导致蜂胶黄酮的分解,造成提取得率降低[7]。因此11 min是较合适的提取时间。
2.1.3 乙醇浓度对蜂胶黄酮提取得率的影响
实验结果如图2(c)所示。当乙醇浓度由50%增加到70%时,提取得率迅速地增加,然而继续增加乙醇浓度,提取得率几乎保持不变。增加乙醇浓度使更多的蜂胶黄酮分子溶解到乙醇溶剂中,从而提高了提取得率。继续增加乙醇浓度,提取得率基本不变,可能是因为蜂胶黄酮分子在乙醇溶剂中的溶解接近于饱和状态。所以70%是较合适的乙醇浓度。

图2 超声功率、超声时间和乙醇浓度对蜂胶黄酮提取得率的影响
2.2 响应面法优化蜂胶黄酮的提取因素
2.2.1 回归方程的构建与分析
由表2可知,Box-Behnken设计方案有17个试验点。通过对试验点的实验数据进行回归拟合分析,得到以下的二次多项式回归方程:



表3 回归方程的方差分析结果

二维的等高线图跟三维的响应面图用来判断自变量之间的相关性。由图的形状可看出自变量之间的交互作用是否显著。椭圆形的等高线图和弯曲的响应面图表明自变量之间的交互作用显著。二维的等高线图跟三维的响应面图如图3所示。研究其中两个变量的相关性时,第三个变量应保持不变。图3(c)的响应面图比图3(a)和3(b)的响应面图更陡峭,这表明乙醇浓度和超声提取时间之间的交互作用更显著,与图3中的等高线图和表3中的结果一致。
2.2.2 最佳超声提取条件的确定与验证
通过Design Expert 8.0.6软件的分析,得到了最佳的提取条件:超声功率为163.38 W,超声提取时间为15.89 min,乙醇浓度为85.67%。在此条件下,预测提取得率为21.11%。为了进一步验证回归模型的可靠性和准确性,采用上述的最佳条件进行验证实验。考虑到实际情况的可操作性,将最佳条件修正为:超声功率为150 W,超声提取时间为16 min,乙醇浓度为86%。在此条件下,蜂胶黄酮的提取得率为21.10%±0.075% (试验次数=3),接近于模型的预测值,因此证实了该模型准确可靠。

图3 3种自变量之间交互作用的响应面图和等高线图
2.3 超声提取方法的比较分析
一般来说,根据蜂胶黄酮的含量来判断蜂胶的品质,含量在5%以上为合格品,含量大于15%为优等品。本实验的蜂胶黄酮提取得率在最佳超声提取条件下实际可达到21.10%,所以该实验所用的湖北孝感地区的蜂胶属于优等品。
蜂胶黄酮的含量与蜂胶的地域性有直接的关系,不同地区蜂胶黄酮的含量差异较大。本次实验所用的蜂胶尚未有相关文献报道,与现有文献的蜂胶来源不同,所以根据蜂胶黄酮的得率来判断超声工艺的优劣是不恰当的,因此只比较提取条件的优劣。曹小燕等[7]用超声提取陕西蜂胶黄酮,得到最佳提取工艺为:超声时间为20 min,提取温度为50 ℃,料液比为1:30,乙醇浓度为80%,黄酮的得率为9.60%;李帅[6]通过响应面法优化吉林蜂胶黄酮的超声提取工艺,得到最佳提取条件为:超声时间为27 min,提取温度为66℃,超声功率为220 W,乙醇浓度为73%,黄酮得率为23.38%;安砚波等[8]通过实验得到山东蜂胶黄酮的最佳超声提取工艺参数为:超声时间为25 min,乙醇浓度为72%,超声功率为82%,实际的黄酮得率为13.07%。与现有报道的蜂胶黄酮的超声提取工艺相比,本实验的超声提取方法具有提取温度低、提取时间短的优点。
3 结论
本文通过响应面法优化蜂胶黄酮的超声提取工艺,得到结论如下:
(1) 蜂胶黄酮的提取得率随着超声功率和超声提取时间的增加先升高后降低,随着乙醇浓度的增加先升高后保持不变。
(2) 通过对回归方程进行方差分析,可得到影响蜂胶黄酮提取得率的主次因素依次是超声提取时间、乙醇浓度和超声功率。
(3) 通过响应面软件的分析以及考虑实际操作的可行性,可得到最佳提取条件为:超声功率为150 W,超声提取时间为16 min,乙醇浓度为86%。在此条件下,蜂胶黄酮提取得率的预测值为21.11%。对上述提取条件进行验证实验,可得到蜂胶黄酮提取得率为21.10%±0.075% (=3),接近于模型的预测值,因此证实了该模型准确可靠。
(4) 目前湖北孝感蜂胶尚未有任何相关文献报道,经过本实验的提取工艺优化与分析,可知湖北孝感蜂胶黄酮的含量约为21%,大于15%,这说明湖北孝感蜂胶是优等品。通过与其他超声提取蜂胶黄酮的方法进行对比,可知本实验的超声提取方法具有提取温度低、提取时间短的优势。
[1] AHN M R, KUMAZAWA S, HAMASAKA T, et al. Antioxidant activity and constituents of propolis collected in various areas of Korea[J]. Journal of Agricultural and Food Chemistry, 2004, 52(24): 7286-7292.
[2] BANKOVA V, POPOVA M, TRUSHEVA B. Propolis volatile compounds: chemical diversity and biological activity: a review[J]. Chemistry Central Journal, 2014, 8(1): 28.
[3] 张凯妮, 沈艳婷, 张长峻, 等. 蜂胶黄酮超声提取工艺的正交优化及不同地域蜂胶黄酮含量的比较[J]. 安徽农业科学, 2014, 42(17): 5610-5613.
ZHANG Kaini, SHEN Yanting, ZHANG Changjun, et al. Orthogonal optimization of ultrasonic-assisted extraction of flavonoids in propolis and comparison of flavonoids content in propolis obtained from different regions[J]. Journal of Anhui Agricultural Sciences, 2014, 42(17): 5610-5613.
[4] WANG Y J, CHENG Z, MAO J W, et al. Optimization of ultrasonic-assisted extraction process of Poria cocos polysaccharides by response surface methodology[J]. Carbohydrate Polymers, 2009, 77(4): 713-717.
[5] ZHANG S Q, XI J, WANG C Z. High hydrostatic pressure extraction of flavonoids from propolis[J]. Journal of Chemical Technology & Biotechnology, 2010, 80(1): 50-54.
[6] 李帅. 响应面优化超声波辅助乙醇提取蜂胶黄酮工艺的研究[J]. 饲料与畜牧:新饲料, 2015(7): 33-38.
LI Shuai. Study on optimization of ultrasonic-assisted ethanol extraction of propolis flavonoids by response surface methodology[J]. Feed and Animal Husbandry: New Feed, 2015(7): 33-38.
[7] 曹小燕, 杨海涛. 蜂胶中黄酮的提取及其自由基清除活性研究[J]. 粮油食品科技, 2015, 23(5): 45-49.
CAO Xiaoyan, YANG Haitao. Study on extraction of flavonoids from propolis and the activity of scavenging free radicals[J]. Science and Technology of Cereals, Oils and Foods, 2015, 23(5): 45-49.
[8] 安砚波, 王浩. 响应面法优化蜂胶总黄酮的提取工艺[J]. 中国蜂业, 2016, 67(9): 46-49.
AN Yanbo, WANG Hao. Optimization of extraction process of total flavonoids from propolis by response surface methodology[J]. Apiculture of China, 2016, 67(9): 46-49.
Ultrasonic extraction of flavonoids from propolis
LU Yanshan1, PENG Wenjun2, BI Yongguang1,2
(1. College of Pharmacy, Guangdong Pharmaceutical University, Guangzhou 510006, Guangdong, China; 2. Key Laboratory of Pollinating Insect Biology, Ministry of Agriculture and Rural Affairs, Beijing 100093, China)
Flavonoids are the main bioactive components in propolis, which exhibit a variety of physiological activities such as anti-oxidative and antibacterial effects. Optimization of ultrasonic extraction of propolis flavonoids will provide a theoretical basis for exploitation and utilization of propolis products. Firstly, single-factor experiments are carried out. The effects of three extraction parameters (ultrasonic power, extractiontime and alcohol concentration) on extraction yield of propolis flavonoids are investigated. Secondly, based on the single-factor tests, the ultrasonic extraction conditions of flavonoids from propolis are optimized by usingresponse surface methodology. The experimental results show that the order of factors affecting the extraction yield is extraction time, alcohol concentration and ultrasonic power. The maximum extraction yield of propolis is 21.10%±0.075% (=3) while ultrasonic power is 150 W, extractiontimeis 16 min and alcohol concentration is 86%. According to the analysis of this experiment, it is found that the propolis from Xiaogan, Hubei is identified as premium grade product in propolis. Compared with other ultrasonic extraction methods of propolis flavonoids, the ultrasonic extraction method used in this study has the advantages of lower extraction temperature and shorter extraction time.
propolis flavonoids; ultrasound; extractionyield; response surface methodology
O426
A
1000-3630(2020)-02-0190-05
10.16300/j.cnki.1000-3630.2020.02.011
2019-10-01;
2019-12-27
农业农村部授粉昆虫生物学重点实验室开放基金(2017MFNZS06)、广东省自然资源厅项目(GDOE2019A27)、广东省科技计划项目(2016A020210133)
卢燕珊(1993-), 女, 广东东莞人, 硕士研究生, 研究方向为天然产物超声技术。
彭文君,E-mail: pengwenjun@caas.cn
贲永光, E-mail: biyongguang2002@163.com
