曲格列酮诱导人心肌细胞氧化应激和自噬的作用
2020-05-09李凤祥李宇杰张林聪彭双清郭家彬康金森
李凤祥,张 弛,唐 瑶,李宇杰,张林聪,彭双清,郭家彬,康金森
(1.新疆医科大学药学院,新疆 乌鲁木齐 830011;2.中国人民解放军疾病预防控制中心,北京 100071)
曲格列酮(troglitazone)是一种噻唑烷二酮类胰岛素增敏剂,临床主要用于治疗2型糖尿病和胰岛素抵抗,其药理学作用机制主要是通过竞争性激活过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ),调节胰岛素反应性基因的转录。但曲格列酮上市后发现,其具有严重的肝毒性,2000年被美国食品药品管理局(FDA)撤市。FILION等[1]研究显示,曲格列酮具有引起心脏衰竭[2]、心肌肥大[3-4]和充血性心力衰竭等心血管疾病风险,提示曲格列酮具有潜在的心脏毒性,但其心脏毒性特征及机制均有待阐明。线粒体是细胞能量代谢的主要场所,也是细胞内活性氧(reactive oxygen species,ROS)的主要来源。研究提示,线粒体是曲格列酮诱发肝毒性的重要靶位,曲格列酮通过损伤肝线粒体DNA,激活氧化应激而诱导肝线粒体功能障碍[5]。心肌细胞线粒体约占心肌总体积的40%,且这些线粒体十分活跃,在维持心肌细胞功能、氧化应激稳态和损伤修复等生命活动中发挥至关重要的作用。但曲格列酮对心肌细胞线粒体功能的影响至今尚不清楚。
近年来研究提示,曲格列酮的毒作用与自噬密切相关[6-7]。自噬是细胞内蛋白分解代谢的一种过程,通过吞噬受损的细胞器或错误折叠的蛋白以维持细胞内环境的稳态[8]。然而,自噬的过度激活会导致细胞内的正常成分被降解,激活细胞Ⅱ型程序性死亡。越来越多的研究提示,自噬在多种药物诱导的心脏毒性中发挥重要作用。为此,本研究拟采用体外培养的人源心肌细胞揭示曲格列酮所诱导的心肌细胞毒性特征,并从线粒体氧化应激和自噬角度探讨其潜在的毒性作用机制。
1 材料与方法
1.1 主要试剂和仪器
曲格列酮(货号3114,英国TOCRIS公司);DMEM细胞培养基(美国Gibco公司);青霉素和链霉素(美国Hyclone公司);CCK-8试剂盒(日本同仁化学研究所);乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒(中国碧云天公司);TMRM和CM-H2DCFDA探针(美国Invitrogen公司);Hoechest 33342探针(美国Sigma公司);一抗:兔抗人微管相关蛋白Ⅰ/Ⅱ轻链3(microtubule-associated proteinⅠ/Ⅱlight chain 3,LC-3Ⅰ/Ⅱ)多克隆抗体(货号12741S)和兔抗人脂质体1/p62(sequestosome-1/p62,SQSTM1/p62)多克隆抗体(货号 39749S)(美国Cell Signaling公司);抗GAPDH抗体(Proteintech公司);HRP标记山羊抗兔IgG抗体(二抗)(美国Invitrogen公司)。
JJT-1300超净工作台(北京亚泰科隆);MCO-18AIC二氧化碳培养箱(日本SANYO公司);MK3多功能酶标仪(美国Thermo公司);CKX41倒置显微镜(日本OLYMPUS公司);5200化学发光成像系统(中国Tanon公司)。
1.2 细胞培养和分组处理
人成年的心室样心肌细胞系AC16购自美国American Type Cell Culture公司。AC16细胞常规培养:AC16细胞接种于含新鲜DMEM培养基(含10%FBS+双抗)的细胞培养皿中,置于37℃,5%CO2的培养箱中培养。待细胞融合度达到约80%时进行传代。取对数生长期的AC16细胞,胰酶消化、重悬,以每孔5000个细胞的密度接种至96孔板,培养24 h后分别加入曲格列酮0,5,10,20和40 μmol·L-1孵育24 h。
1.3 倒置显微镜观察细胞形态
取1.2分组处理的细胞,置于CKX41倒置显微镜下观察每组细胞的形态变化并采集图片。
1.4 CCK-8法检测细胞存活率
取1.2分组处理的细胞,移除培养板中含药培养基,于每孔加100 μL CCK-8工作液,置于37℃,5%CO2的培养箱中孵育50 min,用酶标仪检测450 nm波长下的各孔吸光度(A450nm),计算细胞存活率。细胞存活率(%)=给药组A450nm/对照组A450nm×100%。
1.5 漏出法检测LDH释放量
取1.2分组处理的细胞,距给药终点前30 min,在最大酶活性组加LDH释放剂10 μL,37℃,5%CO2培养箱中孵育至给药终点。分别取各孔上清液80 μL,加入到一个新的96孔板相应孔中,各孔分别再加LDH检测工作液40 μL。混匀,室温避光孵育30 min。用酶标仪检测490 nm波长下的吸光度(A490nm),计算细胞LDH释放量。LDH释放量(%)=(给药组A490nm-对照组A490nm)/(细胞最大酶活性组A490nm-对照组A490nm)×100%。
1.6 高内涵活细胞成像法检测线粒体膜电位和细胞ROS含量
取经1.4检测细胞存活率≥40%的1.2分组处理的细胞,用预热至37℃的1×PBS分别配制含有细胞核染料 Hoechst33342(1 μmol·L-1)和线粒体膜电位染料TMRM(100 nmol·L-1),及含有细胞核染料 Hoechst33342(1 μmol·L-1)和全细胞活性氧染料CM-H2DCFDA(10 μmol·L-1)的混合活细胞染料。每孔用100 μL的1×PBS轻轻洗涤1次,分别加入100 μL混合活细胞染料,37℃,5%CO2培养箱中染色30 min,再用100 μL 1×PBS轻轻洗涤2次,加100 μL 1×PBS,采用高内涵活细胞成像系统采集图片并分析每组的平均荧光强度。
1.7 Western印迹法检测LC3-Ⅱ/LC3-Ⅰ比值和P62蛋白表达水平
取对数生长期的AC 16细胞接种于60 mm皿中,分别给予曲格列酮0,0.2,1,5,10和20 μmol·L-1处理24 h后,用1×PBS轻轻洗涤3次,加入RIPA裂解液100 μL,冰上裂解40 min,12 000×g离心20 min。取上清,采用BCA法进行蛋白定量。等量样品经10%SDS-PAGE分离后,转至0.45 μm PVDF膜上,脱脂牛奶室温封闭2 h,一抗4℃摇床过夜(LC3-Ⅰ,LC3-Ⅱ和SQSTM1/P62的稀释倍数1∶1000),二抗抗体室温作用 1 h(稀释倍数 1∶10 000),使用ECL超敏发光液在成像系统上显影。Image J软件分析条带积分吸光度值,以目标蛋白与内参蛋白积分吸光度值比值表示蛋白的相对表达水平。
1.8 统计学分析
2 结果
2.1 曲格列酮对AC16细胞形态学的影响
如图1所示,细胞对照组的AC16细胞生长状态良好,细胞轮廓清晰,多为细胞质饱满的长梭形或多角形(图1A和1F)。曲格列酮5 μmol·L-1组(图1B和1G)细胞形态无明显变化,存在极少量的细胞凋亡;10 μmol·L-1组(图1C,1H)细胞呈轻微程度的细胞质皱缩,少量细胞凋亡;20 μmol·L-1组(图1D和1I)细胞胞体收缩明显,细胞间连接明显变得稀疏,培养基中漂浮的死细胞数量明显增多;40 μmol·L-1组(图1E和1J),细胞形态出现明显改变,并伴有大面积脱落死亡。
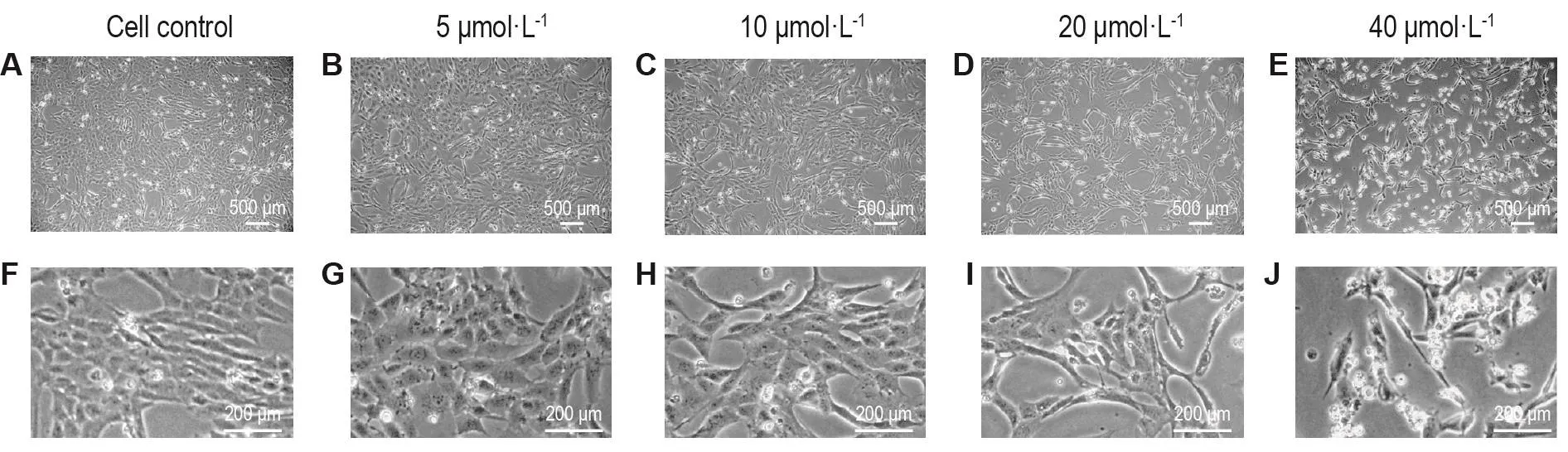
Fig.1 Effect of troglitazone on cell morphology of AC16 cells.The AC16 cells were treated with troglitazone at the concentrations of 0,5,10,20 and 40 μmol·L-1for 24 h.F-G:enlarged view of A-E,respectively.
2.2 曲格列酮对AC16细胞存活率和LDH漏出的影响
如表1所示,曲格列酮0,5,10,20和40 μmol·L-1作用于AC16细胞24 h后,细胞存活率随着给药浓度的增加而明显降低,IC50约为(27.0±3.0)μmol·L-1。与细胞对照组相比,曲格列酮10 μmol·L-1细胞存活率显著降低(P<0.05);40 μmol·L-1时,细胞生存率降至20%以下,提示细胞出现大量死亡。与细胞对照组相比,曲格列酮20和40 μmol·L-1组,LDH释放量分别增加了(70±10)%和(278±40)%,表明曲格列酮可损伤膜完整性致LDH释放量增加。
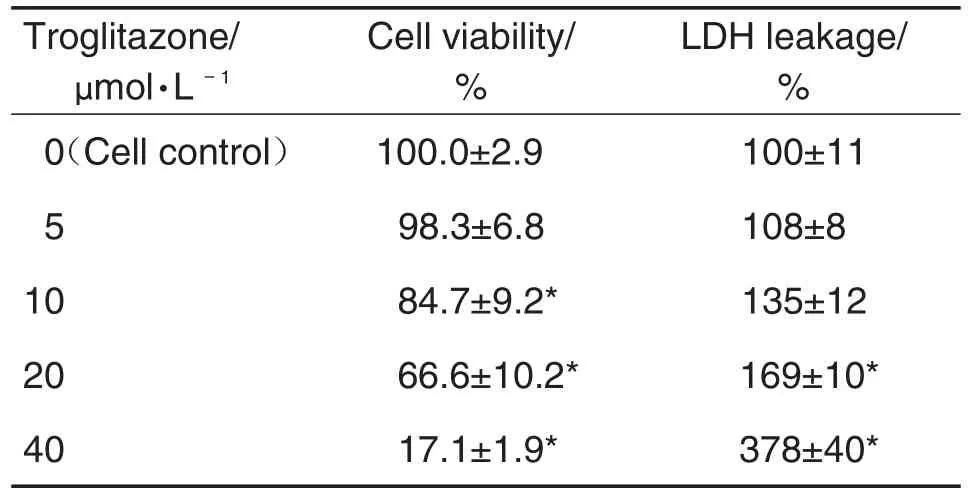
Tab.1 Effect of troglitazone on cell viability and layered double hydroxide(LDH)leakage of AC16 cells
2.3 曲格列酮对AC16细胞线粒体膜电位的影响
如图2所示,曲格列酮可导致细胞线粒体出现结构紊乱,TMRM荧光强度降低。定量分析结果表明,在曲格列酮浓度≥5 μmol·L-1时,膜电位呈浓度依懒性降低(r=-0.945,P<0.05)。表明曲格列酮可浓度依赖性地诱导心肌细胞线粒体功能紊乱。
2.4 曲格列酮对AC16细胞ROS含量的影响
如图3所示,与细胞对照组相比,当曲格列酮≥5 μmol·L-1时,细胞内ROS含量呈显著性上升趋势 (P<0.05)。提示曲格列酮处理可明显诱导AC16心肌细胞ROS生成增加。
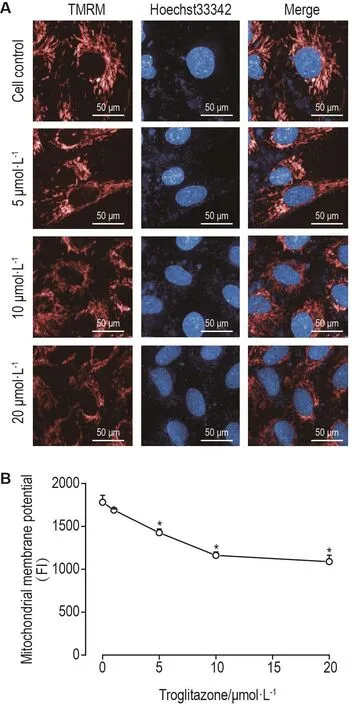
Fig.2 Effect of troglitazone on mitochondrial membrane potential of AC16 cells detected by TMRM fluorescent staining.The AC116 cells were treated with troglitazone for 24 h.A:TMRM(red)and Hoechst33342(blue)staining(scale bar=50 μm).B:the quantitative result of TMRM fluorescence intensity(FI).±s,n=3.*P<0.05,compared with cell control group.
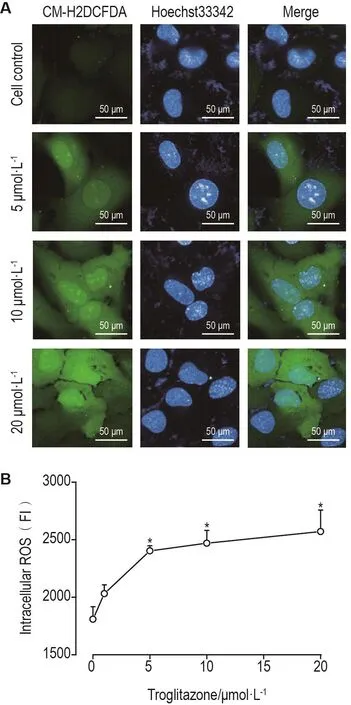
Fig.3 Effect of troglitazone on intracellular ROS in AC16 cells detected by CM-H2DCFDA fluorescent staining.See Fig.2 for the cell treatment.A:CM-H2DCFDA(green)and Hoechst33342(blue)staining.B:the quantitative result of A.±s,n=3.*P<0.05,compared with cell control group.
2.5 曲格列酮对AC16心肌细胞LC3-Ⅱ/LC3-Ⅰ比值和P62蛋白表达的影响
如图4所示,与细胞对照组比较,AC16细胞给予不同浓度的曲格列酮处理24 h后,LC3-Ⅱ蛋白表达呈上调趋势。曲格列酮≥5 μmol·L-1可明显增加自噬标志蛋白LC3-Ⅱ/LC3-Ⅰ比值(P<0.05)。曲格列酮在10 μmol·L-1可显著上调自噬流标志蛋白P62的表达水平(P<0.05)。
3 讨论
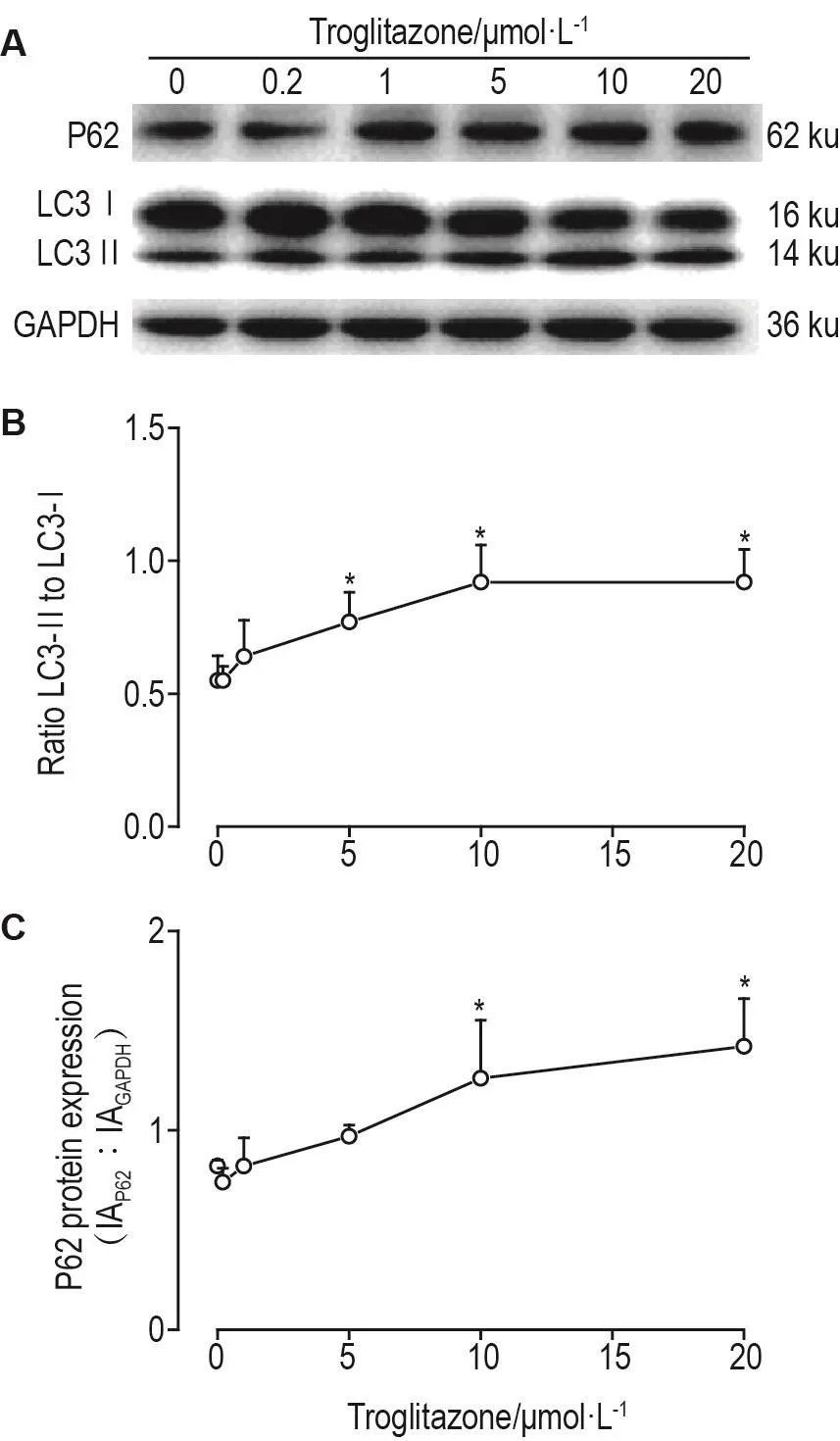
Fig.4 Effect of troglitazone on protein expressions of LC3-Ⅱ/LC3-Ⅰ(A,B)and P62(A,C)in AC16 cells by Western blotting.The AC16 cells were treated with troglitazone 0,0.2,1,5,10 and 20 μmol·L-1for 24 h.B and C:The semi-quantitative result of A.±s,n=3.*P<0.05,compared with cell control group.
本研究发现,当曲格列酮浓度>10 μmol·L-1时,AC16心肌细胞的胞质明显皱缩,培养基内漂浮的死细胞数目增多,细胞存活率显著下降,LDH释放量增加,且呈浓度依赖性,提示曲格列酮对AC16细胞有毒性作用。进一步研究发现,不同浓度曲格列酮处理AC16细胞24 h后,线粒体膜电位下降,全细胞ROS含量上升,自噬标志蛋白LC3-Ⅱ和P62的表达均显著上调,表明曲格列酮可浓度依赖性地引起AC16细胞凋亡和线粒体功能障碍,其机制与线粒体氧化应激和自噬体降解受阻有关。
噻唑烷二酮类药物中以曲格列酮的肝线粒体毒性作用最强[9],罗格列酮和吡格列酮因增加用药者心血管疾病等风险而受到特殊警告[10]。研究提示,曲格列酮毒性作用机制可能与其诱导ROS生成有关,过量ROS不仅可以改变基因和蛋白表达,影响细胞的功能与表型,还可以攻击细胞内的核酸、蛋白质和脂质等重要成分,抑制线粒体生物合成,进一步加剧线粒体功能障碍,最终引发细胞的凋亡[11]。本研究结果显示,给予曲格列酮处理后的AC16细胞线粒体膜电位降低,全细胞ROS含量增加,提示曲格列酮对AC16细胞毒作用可能通过激活线粒体途径促进细胞的氧化应激损伤。
自噬主要包括自噬体的形成及自噬体与溶酶体结合形成自噬溶酶体,最终与内容物一起被降解[12]。当自噬发生时,LC3-Ⅰ被脂质化为LC3-Ⅱ,与自噬小泡结合形成自噬体。因此,LC3-Ⅱ或LC3-Ⅱ/LC3-Ⅰ比值与自噬体数量呈正相关[13]。另外,选择性自噬底物蛋白P62通过与自噬体膜上的LC3-Ⅱ相互作用,形成自噬溶酶体将受损细胞器降解[14]。P62蛋白的积累通常被认为是自噬体与溶酶体结合受到阻碍[15-16]。本研究结果表明,曲格列酮在10和20 μmol·L-1可明显上调 AC16细胞中 LC3-Ⅱ的表达水平,增加LC3-Ⅱ/LC3-Ⅰ比值,提示曲格列酮可诱导AC16细胞自噬的发生。然而,P62蛋白表达水平的上调,提示曲格列酮阻滞了AC16细胞中自噬体与溶酶体的融合,导致自噬体堆积。MA等[17]的研究也证实了此研究结果,自噬流受阻所引发的自噬体堆积会增加ROS的产生,改变线粒体的膜通透性,导致心肌细的凋亡。
综上所述,本研究结果提示,曲格列酮引起的心肌细胞损伤与线粒体氧化应激和自噬体降解受阻密切相关。上述发现不仅能增加对噻唑烷二酮类药物致心脏毒性的认识,同时也为探讨氧化应激与自噬调节在预防及治疗噻唑烷二酮类药物引起的心脏毒性中的潜在临床应用价值提供重要科学依据和实验基础。
