孕烷X受体/NF- κB信号通路在美沙拉嗪改善大鼠溃疡性结肠炎中的作用
2020-05-09冯小娟邵云云刘俊瑾郭一婷侯锐钢
冯小娟,邵云云,刘俊瑾,郭一婷,侯锐钢
(山西医科大学1.药学院,2.第二医院,山西 太原 030000)
溃疡性结肠炎(ulcerative colitis,UC)是一种以黏膜炎和溃疡形成为主要表现的非特异性慢性炎症性肠疾病,可发生于结直肠的任意部位,患者常出现腹泻腹痛,体质量减轻和脓血便等症状[1-2]。该病常年迁延不愈且易复发,严重影响患者及其家人的生活质量,目前,认为炎症反应及免疫失衡对疾病的发生发展有重要作用[3-4]。美沙拉嗪(mesalazine,Mes)作为临床上治疗UC的常用药物,具有良好的抗炎作用,疗效确切,效果显著,但其具体分子作用机制尚不清楚。新近研究发现,孕烷X受体(pregnane X receptor,PXR)作为一种重要的配体依赖性转录调控因子,在大鼠结肠组织中大量分布,且与炎症性肠疾病的发生发展密切相关[5-6],如SHAH等[7]研究表明,PXR激活可抑制炎症而改善硫酸葡聚糖钠诱导的炎症肠疾病等;MENCARELLI等[8]研究表明,PXR依赖性途径可抑制NF-κB通路从而调节利福昔明对肠上皮细胞先天免疫反应。Mes是否可通过调节PXR/NF-κB信号通路来抑制炎症从而治疗溃疡性结肠炎尚不明确。
本研究采用Mes干预UC模型大鼠,通过观察PXR/NF-κB信号通路及炎症因子的变化,探讨其在Mes干预UC中的作用,进一步为Mes的临床应用提供参考依据。
1 材料与方法
1.1 试剂和仪器
Mes缓释颗粒(国药批准字H20143164,上海爱的发制药有限公司);注射用利福平(rifampicin,Rif,批号:20170941,重庆华邦制药有限公司);酮康唑(ketoconazole,Ket,批号:20180422,武汉东康源科技有限公司);2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid solution,TNBS,美国Sigma公司);髓过氧化物酶(myeloperoxidase,MPO)测试盒(南京建成有限公司);肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、干扰素γ(interferon-γ,IFN-γ)、白细胞介素4(interleukin-4,IL-4)和IL-13 ELISA试剂盒(上海优选有限公司);Pxr,NF-κB,NF-κB p65,κB抑制因子α(inhibitor of κB alpha,IκB-α)引物(生工生物工程股份有限公司);一抗:小鼠抗大鼠β肌动蛋白单克隆抗体(美国ABcam公司),兔抗大鼠PXR多克隆抗体和兔抗大鼠磷酸化NF-κB p65(p-P65)多克隆抗体(北京博奥森生物技术有限公司);辣根酶标记山羊抗兔lgG二抗(北京中杉金桥生物技术有限公司)
SQP型电子分析天平购买自德国Sartorius公司,Spectra MAX 190酶标仪购买自美国Molecular Device公司,Vortex-5型涡旋仪购买自中国Kylin-bell公司,SB3200型超声仪购买自上海Brandson公司,DY89-Ⅱ型电动玻璃匀浆机购买自宁波新芝生物科技,Biofuge primo R型离心机和DYY-7C型电泳仪购自美国Thermo公司,WD-9405F型脱色摇床和HH.S21-6型水浴锅购自北京六一生物科技有限公司;StepOne Plus型RT-PCR系统购自美国Applied Biosystems。
1.2 动物、模型制备和评价[9]
40只6~8周龄SPF级雄性SD大鼠,体质量180~220 g,合格证号SCXK(京)2014-0013(中国食品药品检定研究所实验动物中心)。山西医科大学第二医院动物中心进行为期1周的适应性饲养,期间可自由摄食和饮水。
适应性饲养1周后,造模。大鼠乙醚吸入麻醉,特制的硅胶导管插入离大鼠肛门8 cm处,结肠缓慢灌注含50%乙醇的TNBS(3.6 g·L-1)溶液,每只0.8 mL,正常组结肠灌注等量生理盐水。给药结束后,为防止药液遗漏,倒置1 min,后将大鼠倒置放于泡沫板(45°斜面)上直至苏醒。造模完成后,连续4 d每日监测大鼠体质量变化并记录粪便性状和便血情况,计算病变活动指数(disease activity index,DAI)[10]。具体计算方法如下:体质量下降率(<1%计0分;1%~5%计1分;5%~10%计2分;10%~15%计3分;>15%计4分)、粪便性状(正常0分;成形软便2分;不成形软便3分;腹泻4分)和潜血状态(无出血0分;轻微出血2分;严重出血4分)。DAI=(体质量下降分数+便潜血分数+大便性状分数)/3,模型组病变活动指数若为正常组的2倍以上,则视为造模成功。
1.3 给药和样品采集
大鼠随机分为5组,每组8只,即正常对照组、UC模型组、Mes 300 mg·kg-1组、PXR激动剂Rif 50 mg·kg-1+Mes组和PXR抑制剂Ket 35 mg·kg-1+Mes组。取1.2制备成功的模型大鼠,ig给予Mes混悬液(剂量根据动物与人体每公斤体质量剂量折算系数表换算得到),连续7 d。实验期间,所有大鼠可自由获取水和食物。实验结束后,7%水合氯醛深度麻醉,腹主动脉取血;解剖大鼠,肉眼观察大鼠远端结肠组织黏膜的变化,于-80℃保存。
1.4 HE染色观察近端结肠病理变化
近端结肠用4%甲醛固定,HE染色观察大鼠结肠病变情况,根据肉眼评分标准(水肿、缩短变窄、溃疡形成、充血)和组织病理学评分标准(病变范围、黏膜损失和腺体排列)[11-12],评估各组大鼠的差异。
1.5 ELlSA检测血浆中TNF- α,lFN- γ,lL-4和lL-13含量
肝素抗凝的大鼠血液,4000×g离心30 min取上清,制备血浆。使用试剂盒测定血浆中TNF-α,IFN-γ,IL-4和IL-13的含量。操作步骤按样品说明书进行。
1.6 比色法检测结肠组织髓过氧化物酶(myeloperoxidase,MPO)活性
称取约0.04 g结肠组织样本,按质量体积比为1∶19加匀浆介质制备成5%组织匀浆,不需进行离心。取5%组织匀浆0.9 mL加试剂盒中的3号试剂0.1 mL,充分混匀后37℃水浴15 min,取出后待测。按说明书配制对照管和测定管,混匀,60℃水浴10 min,取出后立即使用紫外可见分光光度计(460 nm)测各管吸光度值。按公式测定MPO活性,单位为U·g-1组织。
1.7 实时 PCR测定结肠组织中Pxr,NF- κB,NF- κB p65和I κB- α mRNA表达水平
称取结肠组织样本约0.015 g,用动物组织总RNA提取试剂盒快速提取总RNA,酶标仪检测其纯度和浓度,若A260nm/A280nm在1.8~2.1之间则以RNA为模板合成第一链cDNA,并进行PCR扩增,采用 20 μL反应体系,反应条件为 95℃预变性15 min,95℃ 变性 15 s,60℃ 退火 31 s,72℃ 延伸30 s,共50个循环;β肌动蛋白作为内参基因。引物序列见表1。以2-ΔΔCt法计算mRNA相对表达水平。
1.8 Western印迹法检测结肠组织PXR和p-P65蛋白表达水平
称取各组大鼠结肠组织0.04 g,加0.4 mL RIPA与PMSF的混合裂解液提取总蛋白,用BCA法确定浓度。配制分离胶和浓缩胶后,上样,电泳(200 V,1 h),转膜(50 V,3 h 10 min),TBST洗3次,5%牛奶室温封闭30 min,将PVDF膜置于一抗(1∶1500)孵育盒,4℃过夜,TBST洗3次,再与二抗(1∶1500)室温孵育1 h,TBST洗膜3次,ECL发光液孵育后曝光成像。用Image J软件定量分析条带积分吸光度值,以目标蛋白与内参蛋白比值表示蛋白相对表达水平。
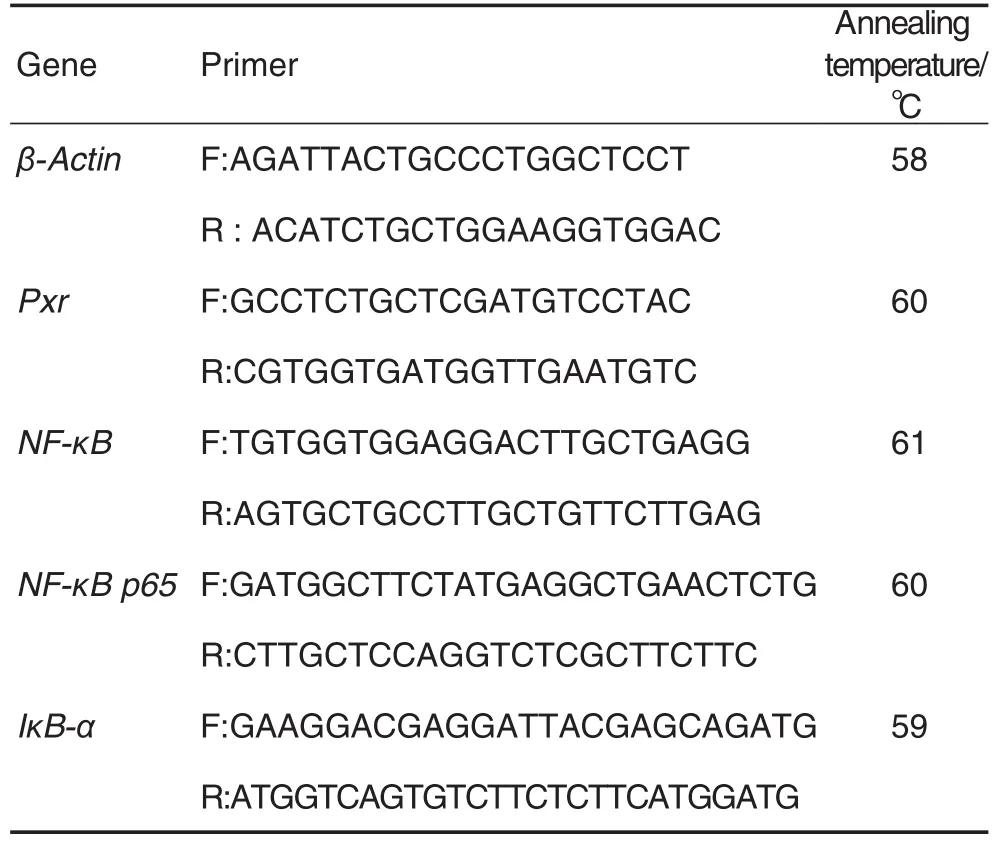
Tab.1 Primers used in real-time PCR
1.9 统计学分析
2 结果
2.1 美沙拉嗪对溃疡性结肠炎模型大鼠体质量的影响
模型组大鼠行动迟缓,食欲缺乏,体质量明显下降并伴有稀便、血便的症状,DAI指数均为正常对照组的2倍以上。与模型组相比,给药组大鼠体质量回升明显,大便恢复正常;模型+Mes+Rif组体质量也回升,大便恢复正常;模型+Mes+Ket组大鼠行动正常,体质量呈下降趋势,部分大鼠有稀便症状。与模型+Mes组相比,造模后模型+Mes+Rif组体质量回升明显(P<0.05);而模型+Mes+Rif组大鼠体质量整体呈下降趋势(图1)。
2.2 美沙拉嗪对溃疡性结肠炎模型大鼠结肠组织的影响

Fig.1 Effect of mesalazine(Mes)on body mass of ulcerative colitis rats.A model of male Sprague-Dawley rats were established by rectal administration of 2,4,6-trinitrobenzenesulfonic acid(TNBS)0.8 mL per rat.The body mass and fecal traits of each group were observed every day for 4 d,and the disease activity index(DAI)was calculated.Model rats were given ig Mes 300 mg·kg-1·d-1(Mes group),rifampicin 50 mg·kg-1·d-1+Mes group(Rif+Mes group)and ketoconazole 35 mg·kg-1·d-1+Mes group(Ket+Mes group)was given Rif and Ket first,and Mes were given 4 d later for 7 d.±s,n=8.*P<0.05,compared with normal control group;#P<0.05,compared with model group;△P<0.05,compared with model+Mes group.
肉眼观察正常对照组大鼠结肠黏膜组织形态正常,镜下肠道结构清晰,未发生黏连,无明显充血、糜烂和溃疡形成。模型组大鼠肠道发生严重黏连,肠壁变厚,黏膜及下层可见多个大小不一的溃疡和多处炎症细胞浸润,局部发生水肿糜烂,肉眼评分和病理评分明显高于正常对照组(P<0.01);模型+Mes组病变程度减轻,仅部分可见充血和糜烂,溃疡基本愈合,仅可见少量炎症细胞浸润,肉眼评分和病理评分低于模型组(P<0.05);模型+Mes+Rif组溃疡面积减少,仍有部分炎症细胞浸润(P<0.05);模型+Mes+Ket组仍有溃疡,也有部分炎症细胞浸润(图2)。
2.3 美沙拉嗪对溃疡性结肠炎模型大鼠血浆中TNF- α,lFN- γ,lL-4和lL-13含量及结肠组织中MPO活性的影响
与正常对照组相比,模型组大鼠血浆中IFN-γ和TNF-α含量及结肠中MPO活性明显升高(P<0.01,P<0.05),IL-4和IL-13的含量明显下降(P<0.05);与模型组相比,模型+Mes组和模型+Mes+Rif组大鼠血浆中IFN-γ和TNF-α含量及结肠中MPO活性均显著降低(P<0.05,P<0.01),IL-4与IL-13的含量显著升高(P<0.05,P<0.01);模型+Mes+Ket组炎症因子的水平差异无统计学意义。与模型+Mes组相比,模型+Mes+Rif组和模型+Mes+Ket组大鼠血浆炎症因子的水平差异无统计学意义(表2)。
2.4 美沙拉嗪对溃疡性结肠炎模型大鼠结肠组织中Pxr,NF- κB,NF- κB p65和I κB- α mRNA 表达水平的影响
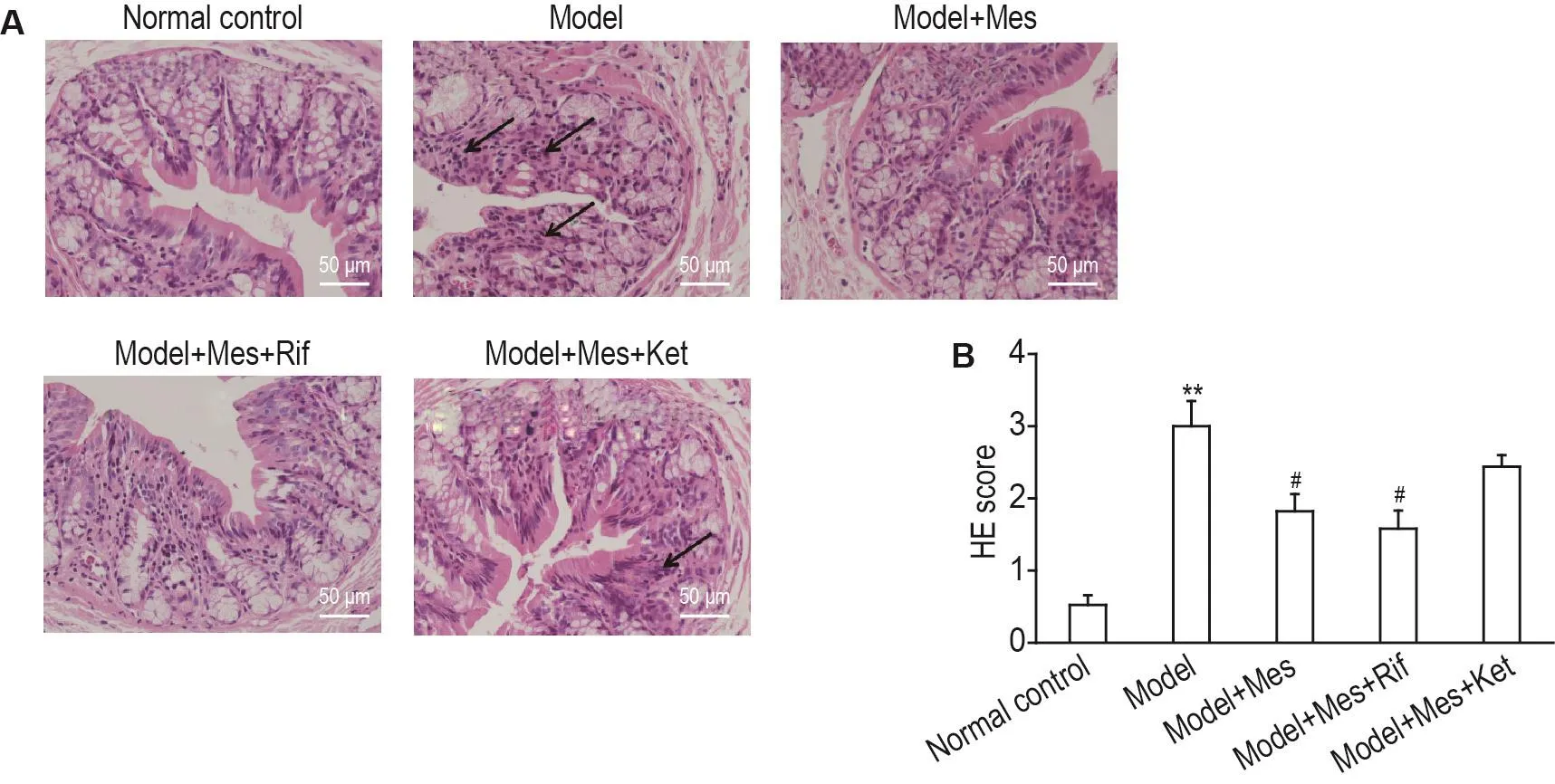
Fig.2 Effect of Mes on pathological changes in colonic tissue of ulcerative colitis rats.See Fig.1 for the rat treatment.Arrows in Fig.A show multiple ulcers of different sizes and infiltration of inflammatory cells in the mucosa and submucosa.±s,n=8.**P<0.01,compared with normal control group;#P<0.05,compared with model group.
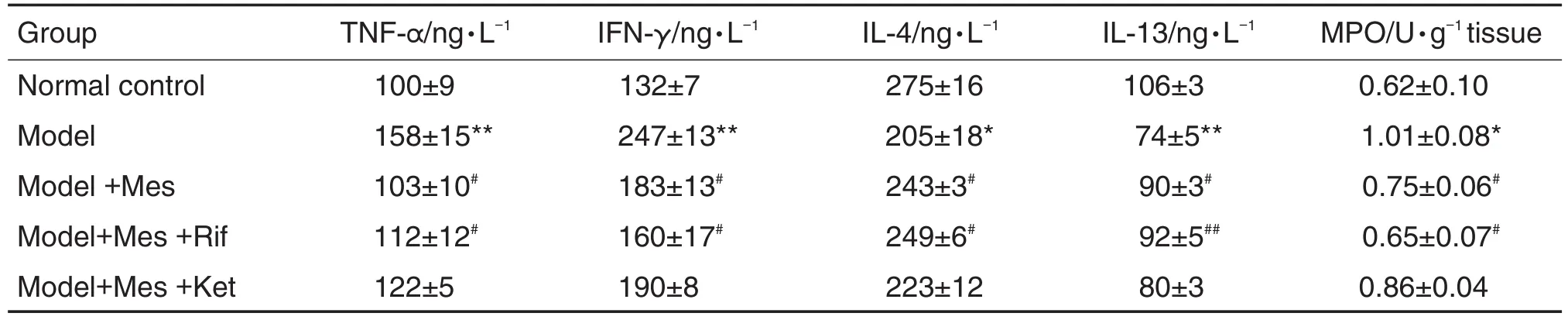
Tab.2 Effect of Mes on plasma tumor necrosis factor- α(TNF- α),interferon- γ(lFN- γ),interleukin 4(lL-4)and lL-13 contents and myeloperoxidase(MPO)activity in colon tissue of ulcerative colitis rats
与正常对照组相比,模型组Pxr,NF-κB p65和IκB-αmRNA水平均明显下降(P<0.05,P<0.01),而NF-κBmRNA水平显著上升(P<0.01);与模型组相比,模型+Mes组和模型+Mes+Rif组Pxr,NF-κB p65和IκB-αmRNA水平均显著升高(P<0.05,P<0.01),NF-κBmRNA水平下降(P<0.05),模型+Mes+Ket组差异无统计学意义;而与模型+Mes组相比,模型+Mes+Ket组中Pxr和IκB-αmRNA水平显著下降(P<0.05),模型+Mes+Rif组各炎症因子水平差异无统计学意义(表3)。
2.5 美沙拉嗪对溃疡性结肠炎模型大鼠结肠PXR和p-P65蛋白表达的影响
与正常对照组相比,模型组大鼠PXR蛋白表达降低,p-P65蛋白表达升高(P<0.05);与模型组大鼠相比,模型+Mes组和模型+Mes+Rif组PXR蛋白表达升高,而p-P65蛋白表达降低(P<0.05),模型+Mes+Ket组无统计学差异;与模型+Mes组相比,模型+Mes+Rif组无统计学差异,而模型+Mes+Ket组PXR蛋白表达降低(P<0.01),p-P65蛋白表达变化无统计学差异(图3)。
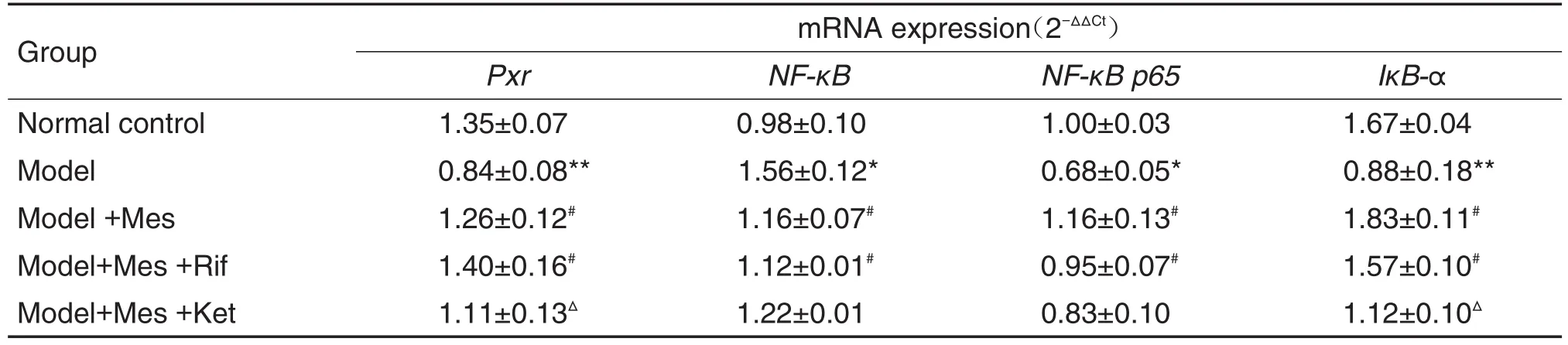
Tab.3 Effect of Mes on mRNA expressions of Pxr,NF- κB,NF- κB p65 and I κB- α in colon tissue of ulcerative colitis rats
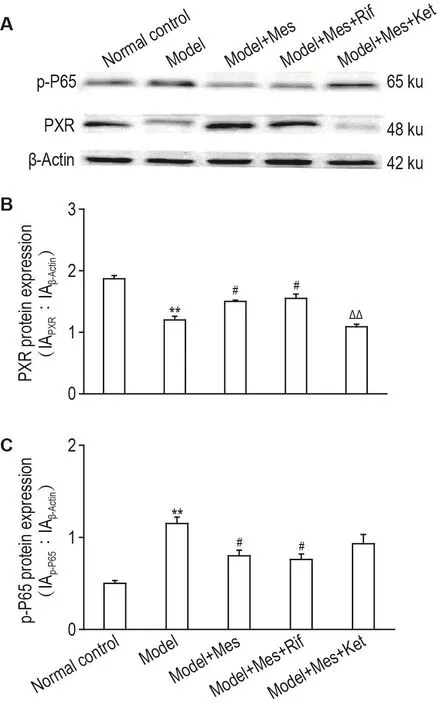
Fig.3 Effect of Mes on PXR and p-P65 protein expressions in colon of ulcerative colitis rats.See Fig.1 for the rat treatment.B was the semi-quantitative result of A.IA:intergated absorbance.±s,n=8.**P<0.01,compared with normal control group;#P<0.05,compared with model group;△△P<0.01,compared with model+Mes group.
3 讨论
本研究结果显示,PXR在UC大鼠中显著降低,与在UC患者中的表达一致[13]。NF-κB作为一条经典的炎症信号通路,对诱发炎症有重要作用。各种刺激因子会诱导IκB磷酸化,待IκB降解后可激活NF-κB,调节炎症介质的合成与释放,从而促进炎症反应的发生发展[14-15]。据报道,PXR和NF-κB之间的相互作用对炎症因子的相关表达具有重要调控作用,NF-κB激活能抑制PXR活性,而PXR的激活可抑制NF-κB活性及其靶基因的表达[16-17]。如Garg 等[13]研究表明,PXR活化可抑制NF-κB信号通路,减轻炎症,从而缓解肠上皮屏障功能障碍;Zhang等[17]研究表明,人参皂苷可通过调节PXR/NF-κB信号通路缓解DSS诱导的结肠炎。
TNBS混合50%乙醇灌肠诱导UC大鼠模型是一种很成熟的造模方法[18-19],本研究结果显示,UC大鼠体质量显著下降,DAI指数明显升高,且镜下观察结肠有充血溃烂,形成大面积溃疡灶,与文献报道一致[20],提示造模成功。Mes作为临床治疗UC的常用药物,其具体抗炎机制不清,本研究给予PXR激动剂Rif后,PXR显著升高,再给予Mes,发现UC的症状显著改善,并且NF-κB及其下游促炎因子明显下调;而先给予PXR抑制剂Ket,PXR表达水平显著降低,再给予Mes,药效降低,大鼠NF-κB及其下游促炎症因子无显著变化。说明Mes对UC的治疗效果很可能与PXR的表达水平相关,但Mes是否为PXR的底物尚不明确,有待进一步验证。
综上,Mes对UC的治疗效果可能与PXR/NF-κB信号通路有关。本研究为临床上使用Mes治疗UC提供了更充分的实验依据。
