纳米材料表观遗传学效应的研究进展
2020-05-09荀佳雨严俊霞龚春梅
荀佳雨,严俊霞,龚春梅
(1.中南大学湘雅公共卫生学院,湖南 长沙 410000;2.深圳市慢性病防治中心,广东 深圳 518020)
近年来,随着纳米技术的发展成熟,纳米材料也应运而生。纳米材料,广义上是指三维空间中至少有一维处于纳米尺度范围或以该尺度范围的物质为基本结构单元所构成的材料的总称[1]。纳米尺寸的物质具有与宏观物质所迥异的表面效应、小尺寸效应、宏观量子隧道效应和量子限域效应,因此,纳米材料具有异于普通材料的光、电、磁、热、力学和机械等性能。根据物理形态划分,纳米材料大致可分为纳米颗粒(nanoparticle,NP)、纳米纤维纳米管〔(nanotube,NT)、纳米线〕、纳米膜、纳米块体和纳米相分离液体等5类[2]。
纳米材料因其特殊的理化性质,被广泛应用于各大领域,如服装、电子产品、工艺用品、日用品和化妆品等[3-4]。纳米材料良好的生物相容性和生物降解性使其在生物医药和食品工业领域的应用也有所发展[5-7]。此外,燃烧的煤炭和石油及汽车尾气也会产生NP污染物[8]。随着生活中人们暴露于NP的机会增加,其生物安全问题受到了全世界的广泛关注,相应的安全性和生物学效应的研究就非常有必要,继而产生了纳米毒理学学科。
纳米毒性效应是指NP在分子、细胞、组织、器官和有机体水平上所造成的不良生物学效应。NP具有体积小比表面积大等独特的性质,能促进反应活性,但也易产生毒性[9]。金属NP主要经胞吞作用进入细胞[10],在细胞内直接或经代谢后间接损伤遗传物质,引起细胞DNA链断裂,形成DNA加合物,扰乱细胞周期[11-13],或导致DNA的氧化损伤[14],还可造成基因突变和染色体畸变,使生殖器官和生殖细胞遗传物质受损,抑制胚胎生长和个体发育,引起胚胎畸形,甚至令细胞死亡或发生恶性转化,诱导严重的遗传毒性效应[15]。纳米材料还可通过抑制线粒体的活性、破坏细胞膜完整性、改变细胞膜通透性及造成氧化应激诱导细胞凋亡或坏死,从而产生细胞毒性[16],造成细胞损伤。此外,纳米材料进入细胞后,可刺激产生大量的促炎性因子和趋化因子,诱发细胞炎症反应,引起免疫毒性[17]。
以往,纳米材料毒性效应研究多集中于细胞毒性和遗传毒性效应方面。近年来,越来越多的证据表明,纳米材料可以引起表观遗传学效应的改变,相关的研究也逐渐增多。2017年,Wong等[18]对已发表的相关文献进行了综述,本文在此基础上进行了补充更新,包括纳米材料对DNA甲基化和羟甲基化水平的影响、组蛋白修饰和微RNA(microRNA,miRNA,miR)表达水平调控等,以对此方面的研究进展进行更新,为相关的研究提供参考。
1 纳米材料表观遗传学效应的体外实验研究
1.1 纳米材料介导的DNA甲基化改变
DNA甲基化是指在DNA甲基化转移酶(DNA methylation transferase,DNMT)的作用下,基因组CpG二核苷酸的胞嘧啶5’碳原子共价键结合一个甲基基团形成5-甲基胞嘧啶(5-methylcytosine,5-mC)的过程[19]。DNA羟甲基化是指在10-11易位(ten-eleven translocation,TET)家族蛋白的作用下,5-mC上增加一个羟基形成5-羟甲基胞嘧啶的过程。DNA甲基化改变在调控基因表达、维持染色质结构、基因印记、X染色体失活以及胚胎发育等生物学过程中发挥着重要作用[20]。DNA甲基化作为一种可遗传的修饰方式,为非编码DNA的长期沉默提供了一种有效的抑制机制。DNA复制后胞嘧啶的甲基化会改变DNA的构象,使DNA的大沟无法与DNA结合蛋白正常结合,从而使这些非编码区长期保持无表达活性的状态[19]。
1.1.1 纳米材料的种类对DNA甲基化的影响
纳米材料种类不同,对DNA甲基化的影响不同(表1)。纳米银可使肺腺癌A549细胞基因组整体甲基化水平升高[21]。氧化锌纳米颗粒(zinc oxidenanoparticle,ZnO2-NP)处理人胚肾HEK-293细胞后,可降低基因组整体甲基化水平[22];氧化钛纳米颗粒(titanium oxide-nanoparticle,TiO2-NP)可显著降低人支气管上皮16 HBE细胞基因组整体甲基化水平[23],晶体二氧化硅纳米颗粒(silicon dioxidenanoparticle,SiO2-NP)可降低Bhas 42细胞(将v-Ha-ras基因导入小鼠胚成纤维细胞中而建成的细胞系)基因组整体甲基化水平[24],非晶体SiO2-NP可引起人皮肤表皮HaCaT细胞基因组整体甲基化程度降低,且呈浓度依赖性[25]。但有些纳米材料对基因组整体甲基化水平并无显著影响。有研究发现,用碳纳米管(carbon nanotube,CNT)处理人单核细胞白血病THP-1细胞和16 HBE细胞,其基因组整体甲基化水平无明显变化[26-27],BONADIO等[28]用磁铁矿纳米颗粒(magnetite nanoparticle,MNP)处理人乳腺癌MCF-7细胞后,基因组整体甲基化水平未受到影响。
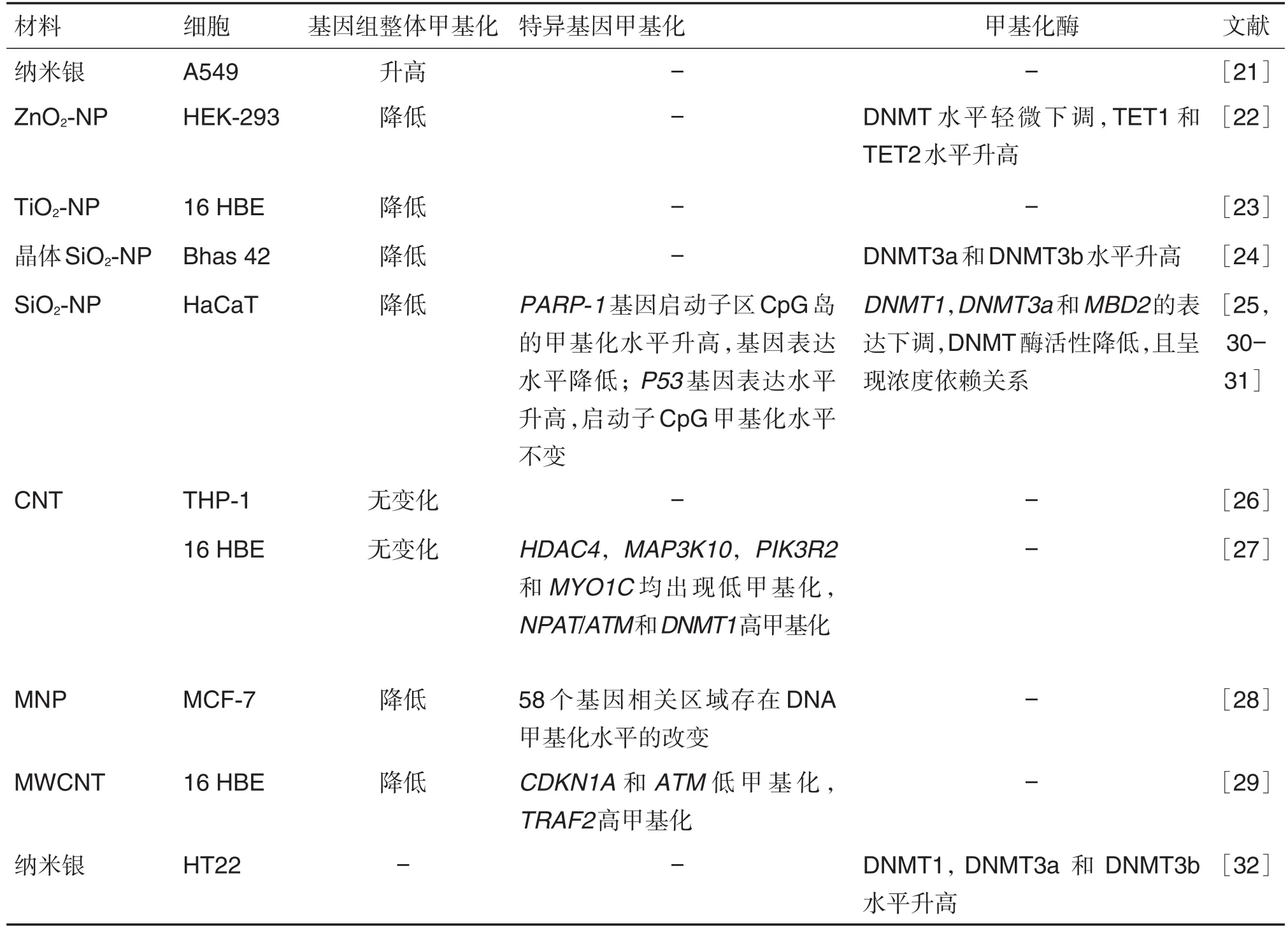
表1 不同纳米材料对基因组甲基化影响的体外实验
有些纳米材料虽对基因组整体甲基化水平无明显影响,但其可影响特异基因甲基化水平(表1)。CNT处理16 HBE细胞后,组蛋白脱乙酰酶4基因(histone deacetylase 4,HDAC4)、丝裂原激活蛋白激酶10基因(mitogen-activated protein kinase kinase kinase 10,MAP3K10)、磷酸肌醇3激酶调控亚单位2基因(phosphoinositide-3-kinase regulatory subunit 2,PIK3R2)、肌球蛋白-1C基因(myosin-1C,MYO1C)和细胞周期蛋白依赖性激酶抑制剂1A基因(cyclin dependent kinase inhibitor 1A,CDKN1A)均出现低甲基化,AT区域的核蛋白基因/ATM丝氨酸/苏氨酸激酶基因(nuclear protein in the AT region/ATM serine/threonine kinase,NPAT/ATM)、DNA甲基化转移酶1基因(DNA methyltransferase 1,DNMT1)和TNF受体相关因子2基因(TNF receptor associated factor 2,TRAF2)表现为高甲基化[27,29]。同样,经MNP处理的MCF-7中,有58个基因相关区域存在DNA甲基化水平的改变,包括癌症相关的一些基因[28]。SiO2-NP可使HaCaT细胞中PARP-1基因启动子区CpG岛的甲基化程度升高来降低表达水平[30],细胞中p53基因表达上调却未发现与其启动子区CpG岛的甲基化水平的关系[31]。
纳米材料的种类对DNA甲基化酶也有影响(表1)。ZnO2-NP可使HEK-293细胞中所有DNMT蛋白水平轻微下调,使TET家族的TET1和TET2水平升高[22];晶体 SiO2-NP 使 Bhas 42细胞的DNMT3a和DNMT3b蛋白水平升高[24];纳米银可使小鼠海马神经元HT22细胞中DNMT1,DNMT3a和DNMT3b蛋白水平升高[32]。非晶体SiO2-NP处理的HaCaT细胞中,DNMT1,DNMT3a和甲基磷酸胞苷酰鸟苷结合蛋白2基因(methyl-CpG binding domain protein 2,MBD2)表达下调,DNMT的酶活性降低,且呈浓度依赖关系[25]。
1.1.2 纳米材料的性质对DNA甲基化的影响
同种纳米材料不同性质,如存在形式和形态等,对DNA甲基化水平的影响不同(表2)。CNT的存在形式有多壁碳纳米管(multiwalled carbon nanotube,MWCNT)和 单 壁 碳纳 米管(single walled carbon nanotube,SWCNT)2种。研究显示,MWCNT比SWCNT更易引起基因甲基化水平的改变,包括基因组整体甲基化[26]和特异基因甲基化的改变[29,33]。SEIDEL 等[24]在非细胞毒性浓度下,用结晶型和非结晶型2种形态的SiO2-NP处理Bhas 42细胞,结晶型SiO2-NP可导致基因组整体甲基化水平降低,DNMT3a和DNMT3b水平升高,这可能是由于DNMT水平的升高只是介导了特定位点甲基化水平的升高;而非结晶型SiO2-NP对基因组整体甲基化水平和DNMT水平均无影响。
1.1.3 纳米材料的浓度对DNA甲基化的影响
一些研究表明,DNA甲基化水平会受到纳米材料浓度的影响(表2)。BLANCO等[21]分别用纳米银100和200 mg·L-1处理A549细胞后,基因组整体甲基化水平升高,且高浓度组的甲基化水平更高。CHOUDHURY等[22]用ZnO2-NP 25和50 mg·L-1处理HEK-293细胞,基因组整体甲基化水平降低,且呈浓度依赖性。EMERCE等[29]用MWCNT 25和100mg·L-1处理16 HBE细胞后,呈现明显浓度依赖性的基因组整体低甲基化和RNA腺苷低甲基化。WMCNT处理人正常肺上皮BEAS-2B细胞后,有453个基因相关的755个CpG位点甲基化水平改变,多表现为低甲基化,且呈浓度和暴露时间效应,高浓度长时间暴露所致甲基化水平降低更明显[34]。然而,有些研究表明,NP浓度和DNA甲基化水平无明显关联。ONER等[26]分别用CNT 25和100 mg·L-1处理THP-1细胞,两浓度所致基因组整体甲基化水平均无明显变化,GHOSH等[23]用TiO2-NP 3.25,12.5和25 mg·L-1处理16 HBE细胞,结果与ONER相同。不同浓度的TiO2-NP处理BEAS-2B细胞后,有22个特异基因CpG位点甲基化水平发生改变,但不受浓度和暴露时间的影响[34]。
1.2 纳米材料介导的组蛋白修饰
组蛋白修饰是指组蛋白在相关酶作用下发生甲基化、乙酰化、磷酸化、腺苷酸化、泛素化和ADP核糖基化等修饰的过程[35]。组蛋白是真核生物染色质中主要的蛋白成分,包括H1,H2A,H2B,H3和H4 5种类型。约146bp的DNA通过左旋的方式环绕由分子H2A-H2B二聚体和H3-H4四聚体组成的核心颗粒1.75圈,形成辅助DNA折叠[36-37]。DNA折叠的紧密性依赖于组蛋白的氨基(N)端的几种修饰,这些修饰从核小体中伸出,从而影响基因的转录。迄今报道的与纳米材料表观遗传学效应相关的组蛋白修饰有乙酰化、甲基化和磷酸化。纳米材料介导的组蛋白修饰最常见的是组蛋白乙酰化,即组蛋白赖氨酸残基上添加或去掉1个乙酰基的过程,由组蛋白乙酰转移酶和组蛋白去乙酰化转移酶(histone deacetyl transferase,HDAC)催化[38]。组蛋白的乙酰化修饰,对染色质重塑和基因表达具有重要作用。组蛋白乙酰化后,DNA与蛋白质相互作用减弱,DNA更易被解离,最终上调基因表达;反之,组蛋白去乙酰化可导致DNA的转录抑制[38]。
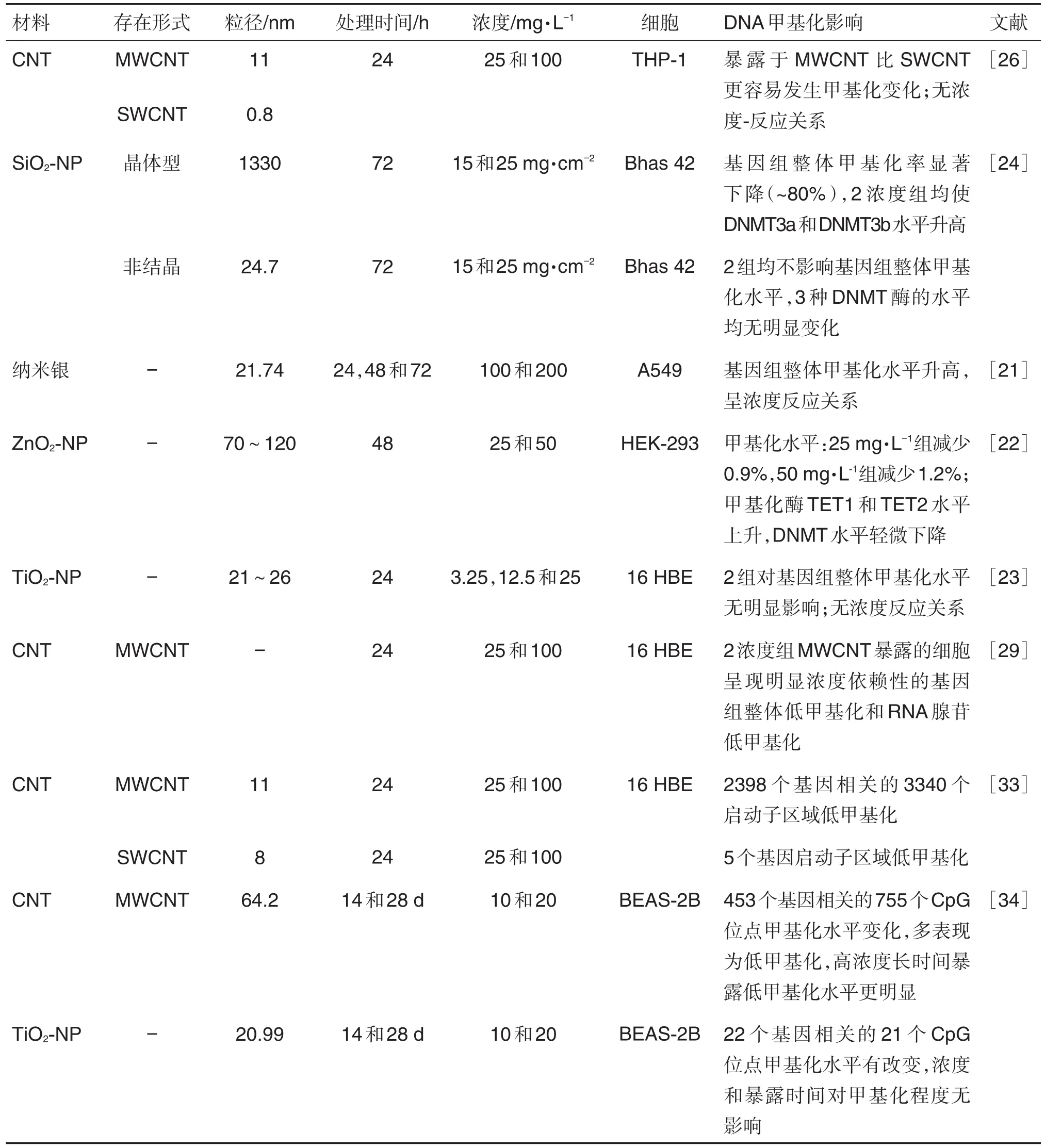
表2 纳米材料的性质及处理条件对DNA甲基化影响的体外实验
1.2.1 纳米材料介导的组蛋白去乙酰化作用
研究表明,NP可使组蛋白H3去乙酰化(表3)。BLANCO等[21]研究发现,高浓度纳米银可诱导A549细胞中组蛋白H3去乙酰化和总组蛋白H3水平升高,且组蛋白去乙酰化伴随着DNA甲基化的发生,此外,该研究还发现染色质结构的改变和细胞形态学的变化可能与组蛋白去乙酰化相关。纳米金可使MCF-7细胞中H3去乙酰化[39]。纳米材料对HDAC基因表达水平也有影响。纳米铜处理的A549细胞中HDAC蛋白水平明显下降,纳米铜对HDAC的抑制程度和HDAC抑制剂效果相当,即纳米铜可以作为HDAC的抑制剂[40]。目前,抑制HDAC的活性已广泛应用于肿瘤细胞增殖的调控,可作为肿瘤治疗的一个新靶点[41]。
1.2.2 纳米材料介导的组蛋白磷酸化作用
除了乙酰化,纳米材料还可介导组蛋白H3(Ser10)磷酸化修饰磷酸组蛋白H3(Ser10)〔phospho-histone H3(Ser10),p-H3S10〕(表3)。研究发现,纳米银处理A549细胞会产生p-H3S10,可能是由于细胞内的纳米银释放银离子,改变肌动蛋白丝动力学,这种变化激活了aurora激酶,诱导了不依赖于细胞周期的p-H3S10的产生[42]。另有研究发现,纳米银诱导的p-H3S10早期形成是通过活化MAPK通路,尤其是Jun的氨基末端蛋白激酶和细胞外信号调节激酶通路发生的。晚期纳米银诱导的p-H3S10的形成是通过激活整个MAPK级联发生的[43],说明NP介导的p-H3S10有多个生物学通路参与。
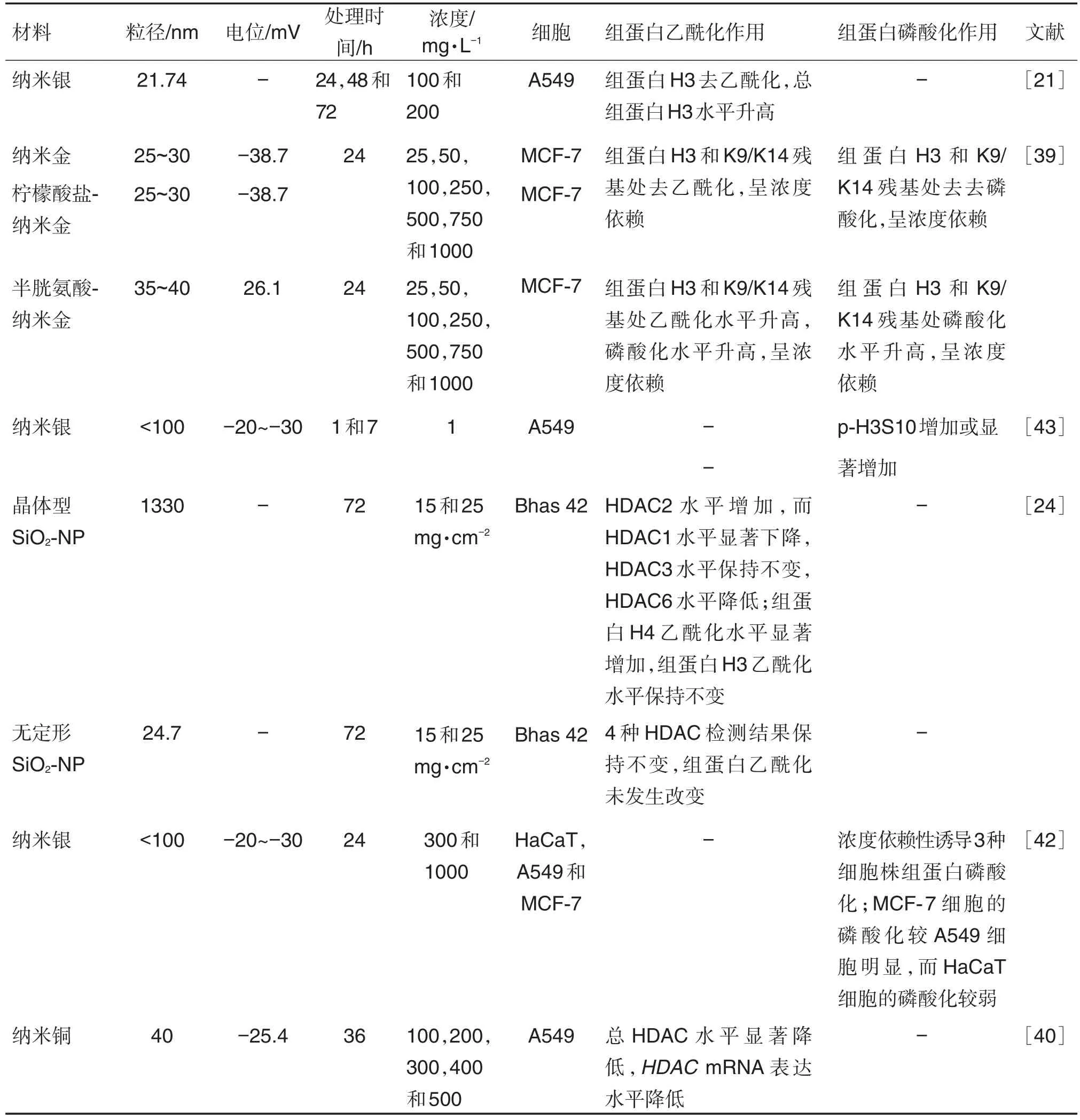
表3 纳米材料介导的组蛋白去乙酰化作用的体外实验
1.2.3 纳米材料性质对组蛋白修饰作用的影响
组蛋白修饰的方式与纳米材料性质也有关系。带有不同电荷或不同存在状态的NP会产生不同的调节方式(表3)。SURAPANENI等[39]用纳米金与柠檬酸和半胱氨酸结合,使其分别带正电荷和负电荷,带负电荷的纳米金使MAPK磷酸酶1基因(MAPK phosphatase 1,MKP-1)基因表达上调、使组蛋白H3 Ser10和K9/K14残基处去磷酸化和去乙酰化,从而延缓细胞死亡过程。而带正电荷的纳米金使MKP-1表达下调、组蛋白H3 Ser10和K9/K14残基处磷酸化和乙酰化,从而加快细胞破坏。纳米材料不同存在状态(晶体,非晶体)对组蛋白修饰作用也不同,晶体状态更易导致组蛋白酶水平的改变[24]。
1.3 纳米材料介导的miRNA表达的改变
miRNA是一类单链内源性非编码小分子RNA,它可通过对mRNA进行降解或切割,从而抑制被调控基因的表达,减弱或消除下游基因的功能[44]。miRNA可参与细胞增殖、分化和凋亡等过程,与细胞分化、肿瘤发生和机体防御作用密切相关[45-46]。随着表观遗传学研究技术的成熟,纳米材料对miRNA表达水平调控的研究也逐渐增多。
1.3.1 纳米材料的种类对miRNA表达的影响
已有多项研究报道了纳米材料对miRNA调控的影响。纳米材料和实验对象不同,受影响的miRNA和表达调控情况也不同(表4)。人肝癌HepG2细胞为实验对象时,纳米银的处理使miR-122-5p,miR-449a,miR-656-3p和miR-34a-5p表达水平下调,miR-1-3p和miR-212-3p上调;纳米金的处理使miR-449a和miR-491a-5p下调,miR-15-3p和 miR-1258b-3p 上调[47];超顺磁性氧化铁 NP(superparamagnetic iron oxide nanoparticle,SPION)使细胞中miR-491-5p下调,miR-1-3p上调[47]。纳米金处理A549细胞后,智人发夹微小RNA-2116前体(precursor hairpin_Homo sapiens-microRNA,hp_hsa-miR-2116),hp_hsa-miR-502_x,hsamiR-342-3p,hp_hsa-miR-149,hsa-miR-93,hsamiR-149,hsa-miR-744,hsa-miR-34c-3p,hsamiR-423-3p,hp_hsa-miR-501,hsa-miR-1180 和hsa-miR-130下调,hsa-miR-198,hsa-miR-548a-3p,hsa-miR-606,hsa-miR-570和hp_hsa-miR-548i-4上调[48]。四氧化三钴NP(cobalt oxide nanoparticles,Co3O4-NP)和TiO2-NP使A549细胞中自噬相关的miRNA表达发生变化[49]。经MWCNT染毒的人胸膜间皮MeT-5A细胞和人胸膜间皮瘤细胞中,hsamiR-155表达上调,hsa-miR-28-5p,hsa-miR-30d-5p,hsa-miR-34c-5p和hsa-miR-324-5p表达下调[50]。小鼠精母细胞经SiO2-NP处理后,有15个miRNA差异表达,包括5个上调和10个下调的miRNA[51]。
也有不同纳米材料介导相同miRNA差异表达,如在HepG2细胞中,暴露于纳米金和纳米银后miR-499-a均表现为下调,暴露于纳米金和SPION后,miR-491-5-p均表现为下调;暴露于纳米银和SPION后,miR-1-3p均表现为上调[47]。
1.3.2 纳米材料性质对miRNA表达的影响
纳米材料的粒径,带电等对miRNA表达水平也有影响(表5)。不同大小的纳米材料引起的miRNA表达水平改变不同。Huang等[52]分别用5,20,50,100和200 nm纳米银处理人真皮成纤维细胞后,5 nm组的miRNA差异表达倍数最大,然后依次是200,100和50 nm组,而20nm组miRNA表达谱所受影响最小。纳米材料表面电荷不同对miRNA表达谱的影响不同,Choi等[48]分别用枸橼酸盐和壳聚糖修饰纳米金使其带正电或负电同时处理A549细胞,带正电的纳米金比带负电更易导致miRNA的差异表达。以合金形式存在的镍钛合金纳米管处理人原代冠状动脉内皮HCAEC细胞,也出现了miRNA表达水平的异常,包括21个上调和4个下调miRNA,其功能主要与调控肌动蛋白细胞骨架、Notch和磷脂酰肌醇等重要信号通路有关[53]。
1.3.3 纳米材料处理时间和浓度对miRNA表达的影响
纳米材料处理时间对miRNA表达水平也有影响(表5)。YANG等[54]用SiO2-NP处理16 HBE细胞,培养至第10代和第30代进行微阵列杂交检测,结果显示,细胞中25个miRNA上调,3个miRNA下调,且30代比10代细胞中miRNA表达差异更明显,即miRNA差异表达具有时间依赖性,差异表达miRNA中,miR-494下调最为明显,但相同条件下SiO2-NP短期染毒使miR-494表达上调,这可能与miR-494-3p在SiO2-NP致细胞急性损伤和慢性损伤中发挥着不同的作用有关。此外,有研究表明,MWCNT对A549细胞中miR-1的表达有抑制作用,且随着时间的增加,miR-1的表达水平逐渐降低,具有时间依赖性[55]。YIN等[50]在MWCNT对MeT-5A miRNA表达影响研究中也发现了miRNA差异表达程度和处理时间存在着相关关系。
纳米材料的浓度对miRNA表达谱也有影响(表5)。YANG等[54]用SiO2-NP 5,10和20 mg·L-1处理16 HBE细胞,进行短期染毒实验发现,随着暴露浓度的增加,miR-494-3p表达水平呈现逐渐升高的趋势,有浓度依赖性。
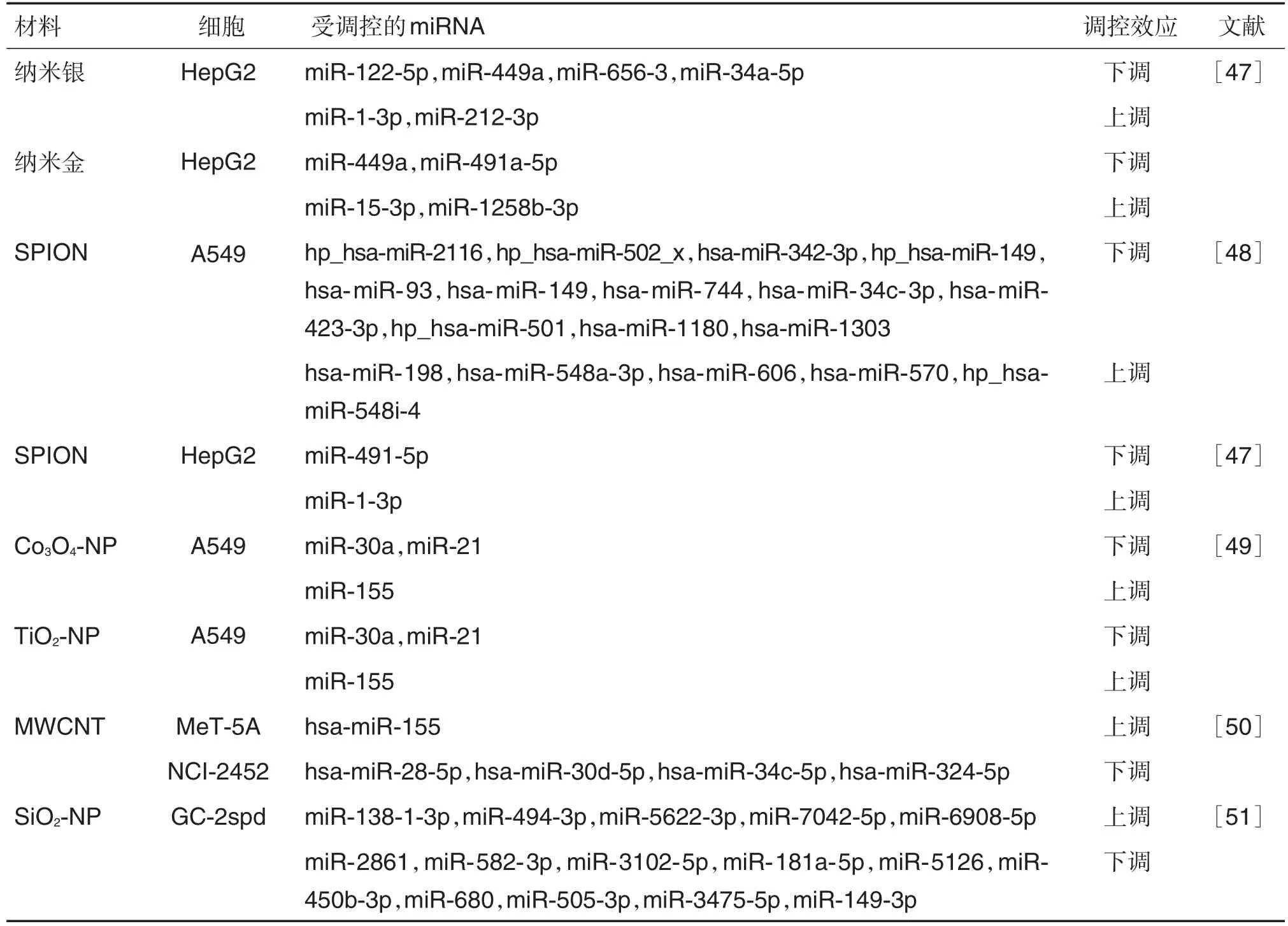
表4 纳米材料的种类对miRNA表达影响的体外实验
2 纳米材料表观遗传学效应的在体实验研究
2.1 纳米材料介导的DNA甲基化改变
2.1.1 以人为研究对象
纳米材料的暴露可使人体血液中全基因组甲基化及特异基因甲基化水平发生改变,且存在剂量依赖性(表6)。LIOU等[56]对暴露于纳米材料工人血液中的基因组甲基化进行了评估,包括TiO2-NP,SiO2-NP和氧化铟锡(indium tin oxide,ITO)暴露工人,在未调整年龄性别等混杂因素前,纳米材料暴露组的基因组整体甲基化水平均降低,根据纳米材料分层比较后,结果与未分层相同,调整混杂后,仅ITO组甲基化水平降低。GHOSH等[57]分别对MWCNT工厂中未暴露及暴露于低(1 μg·m-3)、中(7 μg·m-3)、高(45 μg·m-3)3种浓度梯度MWCNT工作环境中的工人进行血样采集检测。结果显示,暴露组的基因组整体甲基化水平与对照组相比无明显差异,但暴露组存在特异基因甲基化水平的改变,且不同暴露浓度组中基因CpG甲基化位点也不同。低剂量组的DNMT1-CpG1,CpG5,HDAC4-CpG7,SKI原癌基因(SKI proto-oncogene,SKI)-CpG3和CpG5位点,中剂量组的DNMT1-CpG1,CpG2,CpG5,HDAC4-CpG7,SKI-CpG3和CpG5位点及高剂量组DNMT1-CpG1,CpG5,HDAC4-CpG2,SKI-CpG3和CpG5位点发生了甲基化水平的改变。
2.1.2 以动物为研究对象
纳米材料介导的甲基化作用在体研究对象包括大鼠、小鼠和斑马鱼。除与体外实验结果相似外,还发现了纳米材料所致甲基化水平改变具有可逆性和组织特异性,对幼龄大小鼠的效应更强。
OGNIK 等[58]将 3.25和6.5 mg·kg-1的CuCO3和纳米铜混入饲料,以不加铜的矿物质混合物为对照,喂养大鼠4周后,检测血液中DNA甲基化水平变化。结果显示,与不加铜饲料组相比,CuCO3和纳米铜均降低基因组整体甲基化水平,纳米铜对甲基化水平的降低作用比微米级的CuCO3更显著;当减少大鼠铜的摄入,甲基化水平升高,即纳米铜所致DNA甲基化水平的改变作用具有可逆性。有研究有相同结果,纳米银具有类似于DNA高甲基化剂的作用,其可诱导HT22中5-mC和DNA甲基化转移酶DNMT1,DNMT3a及DNMT3b蛋白的水平增加,而去除纳米银暴露后,这3种蛋白水平的增加程度均有所下降[32]。纳米材料对基因组整体甲基化水平的影响具有可逆性,可能是通过可逆调节DNMT蛋白水平实现的(表7)。
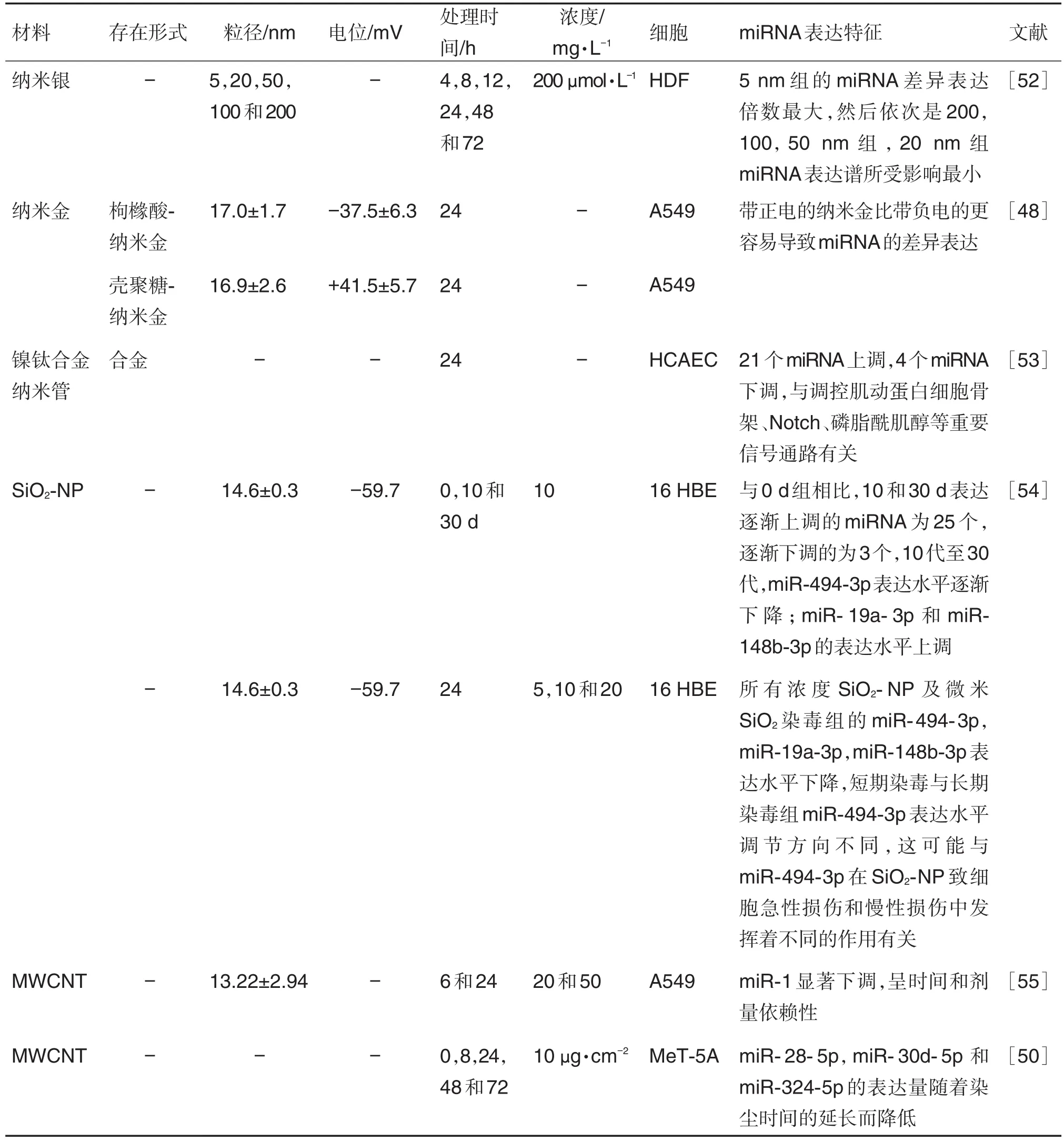
表5 纳米材料的性质和处理条件对miRNA表达影响的体外实验
同一纳米材料的处理条件和不同性质等对有机体DNA甲基化水平也有不同的影响。纳米材料与DNA甲基化水平调节之间存在剂量反应关系,且具有组织特异性(表7)。Lu等[59]对健康雄性大鼠鼻腔灌注SiO2-NP 10,20和30 mg·kg-1,检测睾丸组织中基因组整体甲基化水平,较之空白对照组,随剂量的增加,暴露组基因组整体甲基化水平不断下降,尤其是在30 mg·kg-1组中,DNA甲基化水平下降到对照组的78.9%。OGNIK等[58]发现,高剂量组纳米铜所致大鼠血液中DNA甲基化降低程度高于低剂量组,存在剂量依赖性。经纳米金灌胃的雄性小鼠肺组织中基因组整体甲基化水平并无明显变化,但可诱导特异基因启动子甲基化水平的改变,且呈剂量效应和尺寸效应[60]。HU等[61]用纳米石墨烯量子点(nano-graphene quantum dot,GQD)2,10和50 mg·L-1处理斑马鱼,发现其肝、小肠和腮组织中基因组整体甲基化水平上升,且剂量越高,甲基化越明显。此外,还发现,GQD所致斑马鱼甲基化水平变化具有组织特异性,低剂量下多蓄积于小肠,剂量升高时,肝组织中甲基化水平升高;GQD表面化学修饰对基因组甲基化水平也有影响,NH2修饰的GQD和还原GQD能迅速增加小肠组织基因组整体甲基化水平,还原GQD比OH和NH2修饰的GQD更易引起肝组织基因组高甲基化,且这些影响不具有可逆性。
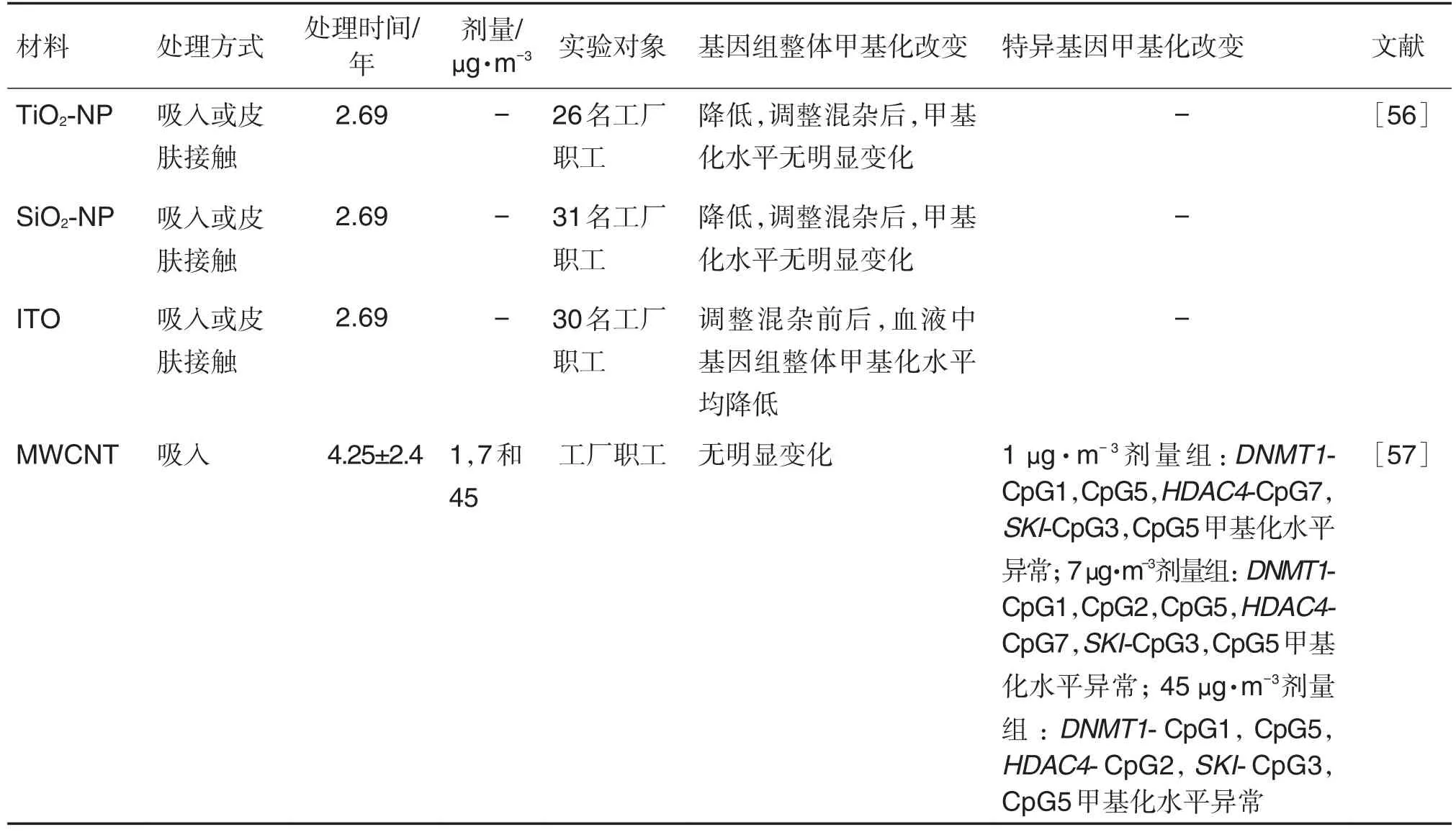
表6 纳米材料暴露对人体基因甲基化的影响
纳米材料对不同年龄组小鼠DNA甲基化水平的影响也不同,幼龄小鼠更易受到纳米材料的影响(表7)。有研究结果显示,分别对5周龄(幼龄)和10周龄(成年)小鼠,经鼻吸入TiO2-NP 20 mg·kg-130 d,只在5周龄组的肺组织中检测到了基因组整体甲基化和羟甲基化水平的降低,肿瘤坏死因子α(tumor necrosis factor α,TNF-α)基因和胸腺细胞抗原1基因(thymus cell antigen 1,Thy-1)的启动子出现甲基化,与10周龄组相比,5周龄组小鼠肺炎和肺纤维化程度更为严重,可能与TNF-α和Thy-1启动子甲基化调节与炎症反应和肺纤维化过程有关[62]。
2.2 纳米材料介导的miRNA表达的改变
不同剂量和处理时间的SiO2-NP暴露对雄性SD大鼠miRNA表达的影响不同(表8)。YANG等[63-64]对大鼠鼻腔灌注SiO2-NP 6.25,12.5和25 g·L-1以后,每浓度组均饲养至7,15,30,60和90 d,发现,随剂量和暴露时间的增多,大鼠肺组织中表达上调的miRNA总数量呈下降趋势,表达下调的miRNA总数量呈上升趋势[64]。肺损伤早期(7,15和30 d)的miRNA差异表达数量无明显时间规律,肺损伤晚期(60和90 d)的miRNA差异表达数量随时间的增加而增加。SiO2-NP引起肺损伤早期的差异共表达miRNA分别为大鼠微RNA-208(Rattus norvegicus-microRNA,rno-miR-208)和rno-miR-212上调,而肺损伤晚期的差异共表达miRNA为rno-miR-18a上调,其靶基因主要与调控肺发育不良、MAPK和肿瘤生长因子信号通路有关[63-64]。
3 结语
近年来,纳米材料的表观遗传学效应越来越受到关注,相关的研究主要包括了DNA甲基化及羟甲基化改变、组蛋白修饰和miRNA表达等。本文在Wong等[18]发表综述的基础上进行了补充,总结了不同种类的纳米材料介导的表观遗传学效应,纳米材料的性质,如大小、形状、浓度和暴露时间等对表观遗传学的影响。然而,有些研究表明,NP的不同浓度等对表观遗传学影响的结果并不一致,纳米材料所致DNA甲基化及DMNT水平异常改变是否可逆,研究结果也存在争议,需要进一步验证。虽有研究已报道了NP对组蛋白修饰的作用,但多为组蛋白乙酰化及磷酸化,其他甲基化、泛素化和去乙酰化等仍有待研究。对于非编码RNA的表达,miRNA研究较多,但每个研究多集中于几个miRNA,结果异质性大,其他长链非编码RNA,循环RNA的研究仍为空白。此外,对于纳米材料介导的表观遗传学效应是否具有可遗传性,仍有待研究。
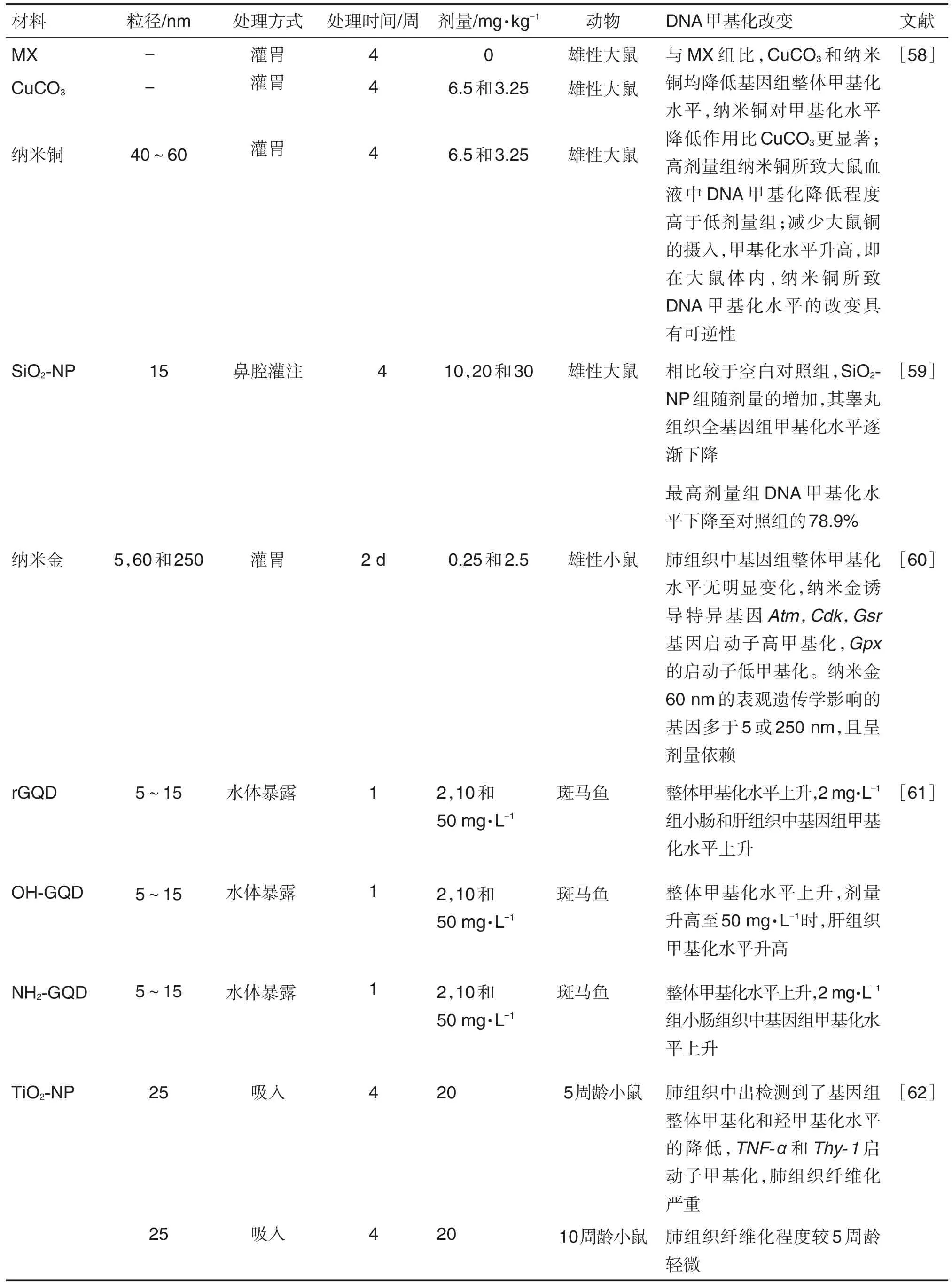
表7 纳米材料介导的基因组甲基化作用的在体实验

表8 纳米材料对miRNA表达影响的在体实验
