农药境外登记GLP项目的委托及审阅策略
2020-05-09李红霞王文涛王欣童温华珍林吉柏
李红霞,高 静,王文涛,王欣童,温华珍,林吉柏
(北京颖泰嘉和分析技术有限公司,北京 102206)
我国是农药生产大国,也是农药出口大国。随着农药市场的开放,我国农药企业加快开拓国外市场。农药进入相关国家市场前须在各国相关部门进行登记,获取批准。农药境外登记人员在准备登记一个农药产品之前,需要先对该产品的可行性、运营模式和登记时间、费用等进行分析,确定其数据缺口,从而进行相关的试验安排。在获取试验报告后,准备相应的卷宗,提交后跟踪进度,直至获得登记许可。
良好实验室规范(Good Laboratory Practice,GLP)是一种质量管理体系,是实验室研究从计划、试验、监督、记录到试验报告等一系列的管理而制定的法规性文件,用于对农药、医药等化学品进行安全性评价。GLP的目的就是降低试验的误差,确保试验结果的真实性。许多国家在登记资料要求中,都规定企业提交的数据报告需由具有GLP资质的实验室出具。因此,作为境外登记人员,需要了解GLP项目的基本程序,委托、跟踪 GLP项目执行及审阅GLP报告时应重点关注的问题。本文概要介绍了境外登记人员如何进行相关的试验委托,并对几种常见的登记试验项目如何进行审阅做了重点阐述。
1 选择适合的GLP实验室
境外登记人员在进行登记试验准备工作时首先要确认登记试验的种类,研究拟申请登记国家的相关要求,对可以提交查询数据的材料,不需要安排GLP试验,以避免不必要的资源浪费;但对登记资料要求中明确规定有关数据和报告必须符合GLP要求的项目,则必须选择由具有GLP资质的实验室开展试验并出具报告。此时,选择、确定合适的GLP实验室,就成为保障境外登记成功非常重要的一个环节。首先,境外登记人员要对备选的实验室资源进行分析,考察GLP实验室的资质、能力以及GLP报告提交该国的通过情况等;其次,对GLP实验室的报价、时间安排和周期等进行考察。此外,境外登记人员还要特别注意备选的GLP实验室是否有多个地址,试验在哪里进行等问题。
需要特别指出的一个细节是,境外登记人员在选择GLP实验室时还要考虑到拟登记产品的性质及运输条件,例如烯草酮这类易降解产品对运输条件要求较高,优先选择本地的GLP实验室会减少GLP试验的风险。
2 明确委托方及受托 GLP实验室的责任与义务
根据经济合作与发展组织(OECD) GLP准则[1]的定义,委托方是指委托、资助及提交非临床健康和环境安全研究的实体和单位。试验委托方在GLP准则实施中有很多的任务和责任,GLP项目不单是GLP实验室的责任,委托方参与整个GLP项目的过程,从确定项目内容,提供相应信息开始,到样品确认,方法筛选,杂质确认,签署研究计划,试验期间的沟通,审阅、审批最终报告等,委托方都不可或缺。
委托方在项目运行的各个阶段都需要明确其相应的职责并发挥作用:⑴ 试验前阶段:委托方需要对实验室的资源进行分析,确认要进行的试验类型,登记地所要求的试验指南,提供合适的被试物信息。明确委托方和试验机构的各自职责。⑵ 计划书阶段:对预试验结果、试验计划、企标情况和可能出现问题等进行沟通。⑶ 试验阶段:当试验结果出现问题或可疑数据等要及时沟通。例如动物死亡的原因,剂量调整,异常数据等。⑷ 报告阶段:要仔细审核草稿报告,对出现的问题及时联系实验室进行修改或者补充试验。当提交最终报告遇到登记当局的疑问时,要及时联系实验室协助解决。
在GLP项目的运行中,委托方要注意把关好被试物的质量,提供的相应信息准确无误,并在GLP项目运行期间和实验室保持良好沟通。与此同时,承担项目的GLP实验室要严格按照程序要求进行试验,确保试验的质量,并及时汇报沟通。只有委托方和实验室双方通力合作、沟通顺畅,才能确保GLP项目的顺利完成。
3 实施GLP项目的基本程序
进行一个GLP项目的基本程序如下:⑴ 委托方和 GLP实验室签署协议,确认要进行的项目及检测内容。⑵ 委托方提供被试物及相关信息。⑶ GLP实验室获得样品后展开预试验。⑷ GLP实验室撰写项目试验计划方案,质量保证人员(QA)审核,委托方进行确认。⑸ GLP实验室根据审核批准后的试验计划实施GLP试验。⑹ GLP实验室根据试验结果出具草稿报告,经QA和委托方审核后出具最终签字版报告。
4 跟进GLP项目试验过程
根据OECD GLP准则[1]的要求,试验项目负责人(SD)是对试验项目的实施和管理全面负责的人员,SD的首要职责是确保研究工作遵从GLP的要求。在GLP试验体系中,质量保证是一个独立于试验操作、旨在保证试验单位遵循GLP准则的系统。QA会科学、客观地对试验设施、GLP软硬件运转状态、研究计划、试验操作、原始数据及试验报告等是否符合GLP规范进行监督检查。
GLP实验室对其GLP项目的试验过程有严格的要求,所有操作都需要按照实验室的标准操作程序进行,试验过程严格按照计划书执行。计划书、试验关键过程及最终报告QA都会进行审查以确保研究工作遵从GLP。境外登记人员在GLP项目实施过程要和SD保持良好的沟通以便GLP项目顺利实施。
GLP项目的最终成果是GLP报告,境外登记人员最需要关注的就是GLP项目的报告。根据GLP准则要求,每个试验项目均应当有一份最终试验报告。试验项目负责人应在最终试验报告上签署姓名和日期,对数据有效性、真实性和完整性负责,同时说明遵从本规范和试验计划的程度,以及偏离对试验结果的影响。试验报告修订应明确说明修改或补充的理由,并由试验项目负责人签署姓名和日期。此外,最终试验报告需要包括以下内容:⑴ 试验项目基本情况;⑵ 委托方和试验单位的情况;⑶ 试验开始时间和完成时间;⑷ QA声明,QA声明中需要列出检查类型、检查内容、检查结果等信息;⑸ 仪器、试剂、材料和方法等信息;⑹ 项目中的偏离和修订,需要说明偏离规范和试验计划的程度,评价偏离的影响;⑺ 所做试验的描述和结果,需要报告所用试验计划中要求的所有信息和数据。
境外登记人员在审阅GLP报告时,尤其要注意报告中的GLP遵循部分的说明,这部分内容会说明该项目对遵循GLP准则程度或情况。正常情况下,GLP遵循中除被试物的信息或有些基于SD经验做出的谱图解析或解释之外,其他不遵循GLP准则的地方要特别引起重视,可能会对登记造成不良影响。此外,审阅人也要特别注意报告中的偏离和修订,判断其是否影响整个报告质量。
5 审阅GLP报告及重点注意事项
GLP项目需要完全按照签署的研究计划进行实施,而GLP报告需要完全精确地反映研究的实施和研究数据。不管是试验方案还是报告草案都需要仔细的审查,一旦签字确认后,根据GLP的规范,任何的修改都需要以修订或偏离的形式出现,并显示在报告中。如果修订或偏离过多,可能会降低登记审查机关对该GLP报告的好感,影响登记进程。无论是GLP实验室,还是作为委托方代表的登记人员或咨询顾问,都要在草案阶段尽可能的去避免相应的错误和疏漏。
中国绝大多数企业的产品境外登记是相同产品登记,本文就目前市场相同产品登记中经常使用的几种类型的GLP项目,整理了一些需要重点注意的事项以供参考。
5.1 GLP项目中的信息审阅
根据不同国家的要求,检测项目和导则会不同。在GLP项目的草稿计划过程中,实验室和委托方一定要审查研究计划中的检测项目和对应的试验方法和导则。提供准确的样品信息是委托方的责任,样品信息虽然看起来简单,但是出现的问题很多,要给予特别重视。样品产品分析单(COA)中容易出现如下情况:⑴ COA中样品名称、物理特性等与GLP试验中使用的不一致;⑵ COA中质检报告日期晚于试验开始日期;⑶ COA中含量、批号与试验使用的不一致;⑷ 同一个批号供试品的COA不一样,或者单位印章位置不同;⑸ 样品COA信息与邮件、方案中不一致;⑹ 样品COA保存条件前后不一致;⑺ 样品COA中含量与GLP报告中差距较大;⑻ 样品COA中只有公司印章,没有责任人签字;⑼ 需要注意,在巴西除五批次外的GLP报告都需要GLP的COA。
此外,在进行GLP项目中,有时需要委托方提供其他与试验相关的数据,如分散性、持久起泡性和悬浮性等,需要提供稀释倍数等。
5.2 五批次项目审阅
农药原药的五批次分析是指针对有效成分、含量达到0.1%及以上的任何显著杂质,以及FAO (联合国粮食及农业组织)、WHO (世界卫生组织)、欧盟或者是各国农药主管部门规定的相关杂质定性和定量分析。五批次全分析鉴定出的组分总量在98%~102%,一般是由委托方提供五个批次的工业化原药来进行。
GLP的五批次报告是进行国外市场开发及农药登记不可或缺的重要技术资料。目前绝大多数国家的登记都需要提供五批次报告,一些中高端市场更是日趋严格,越来越多的市场要求登记申请人提供 GLP五批次报告。五批次报告是解析原药产品组分的核心登记资料,是判定原药产品质量是否合格的关键要素,也是农药药效、毒理和环境等一系列试验的源头。
GLP的五批次报告对判断产品的质量至关重要,该报告的结论直接反映了原药的品质。在几乎所有的高端市场,原药的五批次分析报告还作为评价原药产品是否符合相同产品的判定依据,直接决定产品是否可以按照相同产品原则进行登记——即是否可以以最低的登记成本取得登记。一份高质量的五批次报告,几乎可以在全球通用,可以说是市场开发的敲门砖。
对于GLP的五批次报告的具体要求,各国之间存在一定的差别。对于GLP的五批次报告的格式,除了符合OECD GLP导则中的规定内容外,美国环境保护署(EPA)提出了一定的要求,如报告要增加是否有保密部分的声明等[2]。按照美国EPA要求出具的GLP报告在其他国家提交基本没有问题,一般不需要为各国准备各自的报告模板。在五批次项目运行过程中,实验室和委托方还要注意以下这些可能存在的问题。
5.2.1 各国对五批次的不同要求
一般而言,各国对五批次的定性、定量的要求基本一致,有效成分的定性一般2种方法就可以(一般接受核磁共振波谱和质谱法定性),定量分析方法验证也基本都认可遵从欧盟的SANCO 3030[3]指南。但在细节要求上,还存在一定的差异,需要实验室和委托方给予重视。
欧盟会根据生产工艺的资料来评估原药整个生产过程中用到的所有溶剂或溶剂催化剂的毒性。毒性评估可以直接从官网上下载 MSDS (物质安全数据单),并对毒性进行比较。如果所用溶剂的毒性大于原药主成分的毒性,就需要对溶剂进行测定。在实验室检测过程中,建议将定量限设为至多 0.01%或0.02%,以保证溶剂不会影响原药的毒性。此外,溶剂测定的期限最好是距离生产日期近一些,这样更容易反映出在生产过程中溶剂的真实残留情况。
5.2.2 五批次GLP报告中的杂质确认及毒性评价
GLP的五批次分析一般包含2个阶段,首先是实验室进行的预扫描阶段,这部分内容不体现在GLP五批次报告中。在这个阶段,实验室和委托方要确认正式GLP试验中要进行检测的杂质,包括毒性相关杂质和大于0.1%的任何显著杂质。这是一个五批次报告是否能顺利拿到等同登记的关键,需要委托方和实验室共同确认。在确认好杂质种类及准备好杂质标准品后,实验室就进入到GLP阶段,对有效成分及杂质进行定性、定量分析。
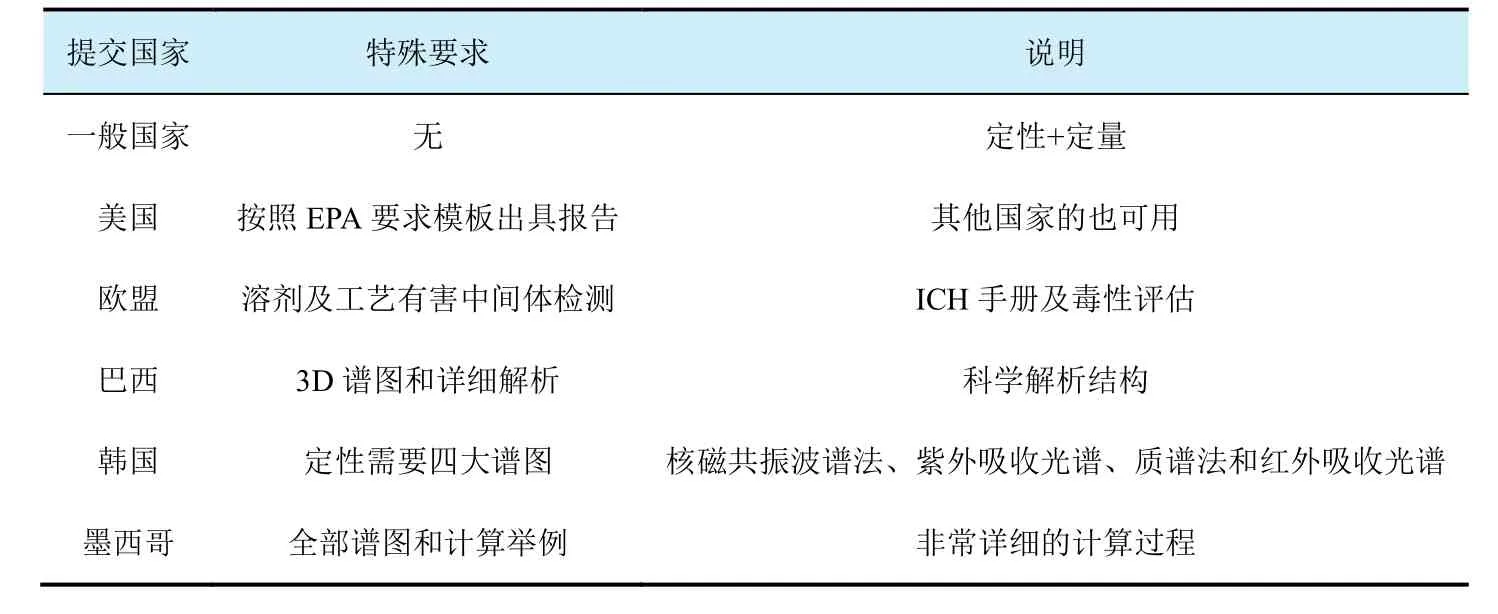
表1 各国对GLP五批次报告的特殊要求
因此,确认及收集有关产品的杂质信息非常重要,这对评估产品是否符合登记要求以及制定研究计划等非常有帮助。除了FAO/WHO规格上会提到相关杂质,在欧盟、澳大利亚和加拿大等官网上可以查询及下载已登记产品的评价报告,会提及需要关注的杂质。GLP的五批次报告必须满足登记国的要求,要考虑到报告的使用范围,确认好相关杂质。
对于显著杂质而言,其是否会有毒性,是否会影响登记是委托方非常关心的问题。对于不确认的杂质,可以根据预分析的结构,先用定量构效关系(QSAR)来评判一下该化合物的毒性。QSAR是指定量的构效关系,是使用数学模型来描述分子结构和分子的某种生物活性之间的关系。有很多免费的QSAR软件可以帮助来进行毒性评估,如 QSAR toolbox、Toxtree、VEGA等。
5.2.3 农药的储存条件
大部分农药在常温下储存,其杂质及性质长时间不会发生改变。但有些特殊农药要特别注意特殊储存条件以免影响到五批次的结果。吸水性强的农药,如烟嘧磺隆,需要在干燥条件下储存,实验室在称量样品时也需要注意空气中水分的影响。有些农药在常温下易分解,主成分含量还没有显著变化时,杂质变化就已经异常明显,如烯草酮原药,建议最好选择国内实验室进行分析,且以冷冻状态进行运输,避免运输途中杂质发生变化。
5.2.4 水分、不溶物等其他组分
水分含量是五批次项目中必须测试的项目。有些时候,根据不同产品的生产工艺,需要做干燥失重、不溶物或硫酸盐灰分等项目。在进行这些项目时,要多思考其相关性。如干燥失重量远大于水分含量,需要解释其他组分可能会是什么。五批次报告中的不溶物如果含量超过0.1%,在韩国登记时会被要求对这些不溶物进行定性。
此外,在GLP五批次分析中,也要格外注意样品的COA和五批次检测项的符合程度,虽然可能由于测量方法的不同造成 COA中的含量和五批次结果中不一致,但是如果相差太大,将难以解释。
5.2.5 农药的异构体现象
农药的异构体现象很普遍,其异构体分几何异构体和光学异构体。有的异构体之间,生物活性有明显甚至很大的差别,有的则差别不明显。在GLP五批次报告中,实验室首先需要仔细查询该农药的有效组分究竟是其中的单一组分还是混合体。一般而言,如果有效成分是混合体,可以不用分开检测,但是各国对异构体拆分要求的严格程度不同,需要根据登记市场进行确认。此外,杂质的光学异构体一般不再要求拆分检测。
5.2.6 质量平衡及产品规格
五批次GLP全分析分析报告中鉴定出的组分总量应该为 98%~102%,当测得的各种组分含量的总和不足98%时,应采用其他可能的方法进一步鉴定分析;当各种组分含量的总和超过102%时,应分析原因并做出合理解释。绝大部分国家在制定登记产品的规格时,是根据五批次GLP报告中的平均数据加减三倍标准偏差进行计算的,所以在预分析阶段,就要关注其结果的可能分布情况。
5.3 理化项目审阅
任何化学物质都具有自己独特的物理性质和化学性质。物理性质是指不经过化学变化就能体现出来的性质,如外观、熔点和密度等;化学性质是物质经过化学变化才能体现出来的性质,如闪点、燃点、可燃性和爆炸性等。物理性质和化学性质简称“理化性质”或“物化性质”。
和五批次GLP报告不同,各国和地区对理化性质报告的要求差别很大,这就要求委托方在进行理化试验项目的安排前,必须先设计好要登记的国家及地区。此外,在审阅理化项目中,还需要关注如下问题。
5.3.1 理化性质的导则
理化性质有很多国际通用的导则文件,普遍使用的有经济合作与发展组织(OECD)、欧盟(EU)、美国环境保护署(EPA)及国际农药分析协作委员会(CIPAC)方法,它们之间既有联系也有不同。GLP实验室在进行项目前需要仔细核对。
很多指南对某个理化性质给出了多种测试方法,一般情况下可酌情选择其中一种。比如密度的测量有8种方法,蒸气压的测定有6种方法等。在使用不同的分析方法时,要注意指南对应的检测范围是否合适。
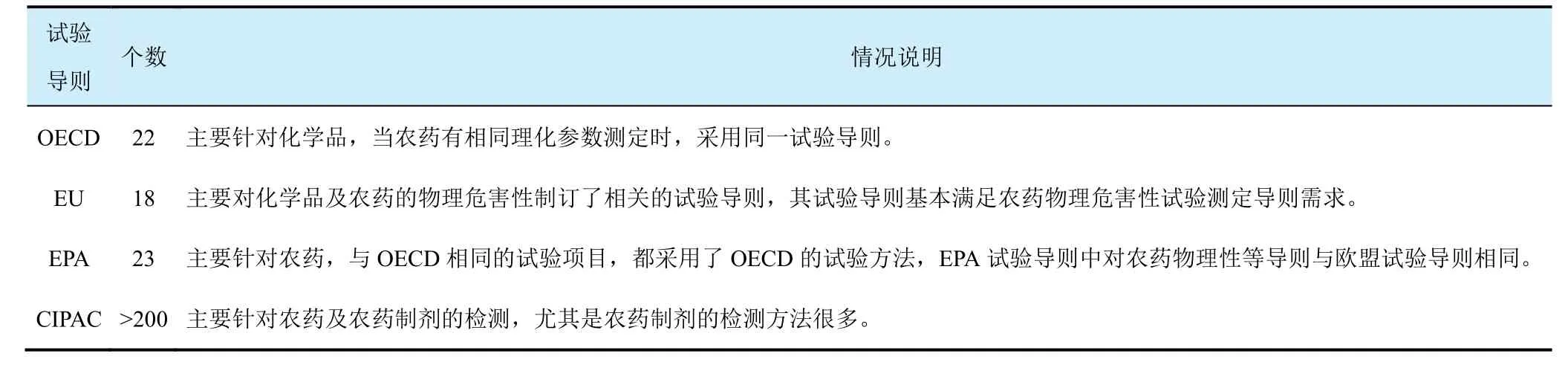
表2 理化性质的国际指南文件
5.3.2 和文献值不一致的情况
在实施理化性质测定中,实验室和委托方有时会发现,GLP报告中的数据和文献报道值相差很大,这一方面可能是由于不同实验室使用了不同的分析方法;另外一方面,不同实验室之间的操作也会引起一定的差异。尤其是数值较小的检测项目,如蒸气压,不同的分析方法测定的结果差异很大。在遇见结果差异很大的情况下,实验室应该首先进行自查,看是否属于自身操作引起的误差,并合理分析偏差存在的原因。
5.4 毒理项目审阅
毒理试验项目可以简单分为生态毒理和哺乳动物毒理。生态毒理试验是研究各种有毒有害因素,尤其是化学环境污染物对生态环境影响及其对人类之外其他生物种类包括动物、植物和微生物等的损害作用。哺乳动物毒理试验是研究外来化合物对生物体的损害作用及其机理。哺乳动物毒理试验主要是应用动物来进行,所观察到的毒性反应与人体有很多相似之处,但有些方面也有很大差异。因此,一定要进行综合分析,不能简单外推于人。
不同国家和地区对毒理试验的要求差别很大。目前只有巴西对生态毒理项目有要求,墨西哥和泰国等国家要求急性毒理试验,巴西、阿根廷和中国台湾除了急性毒性试验外,还要求致突变试验。因此,委托方必须要确认好要登记地区的要求。此外,毒理试验中还应该注意以下问题。
5.4.1 试验导则
绝大多数国家和地区都认可按照OECD的试验导则进行的GLP试验,但对于同一个试验,OECD也有多种指南文件,比如急性经口毒性试验方法,就有 OECD TG420-固定剂量法(Fixed dose procedure,FDP)、OECD TG423-分级试验法(Acute toxic class method,ATC)和 OECD TG425-序贯法或上下移位法(Up-and-down procedure,UDP)。其中OECD TG423为大多数国家接受的方法。GLP实验室和委托方都要清楚这些要求及区别所在。
此外,由于毒理试验导则的更新较为频繁,试验室需要随时关注OECD网站上的更新,了解最新要求,避免使用已废止的导则进行GLP试验。
5.4.2 体外替代试验的新要求
因动物福利及动物试验方法的不确定性等原因,现在各国正推进毒性测试替代方法的进程。即使用没有知觉的试验材料代替活体动物,或使用低等动物代替高等动物进行试验。目前欧盟和巴西已经做出了相应的要求,因此实验室和委托方应关注各国对体外替代试验的要求,使报告符合登记注册的要求。
5.4.3 毒性等级
在进行毒理试验时,有时候需要用统计软件计算出毒性大小,通常用半致死中量(LD50)或致死中浓度(LC50)表示。毒性等级决定该农药产品是否能顺利登记。当毒性数据落在两个等级之间的数值时,要特别注意是否是统计方法引起的差异性。
5.4.4 文献数据
一般情况下,农药电子手册是境外登记人员经常查询的资料之一,需要注意的是农药电子手册上的数据存在一定的误差。当审阅草稿报告时,发现农药产品和文献数据不一致的情况时,要查询该产品在各国的登记材料加以佐证。
5.4.5 病理学报告
毒理病理学报告是一般毒理试验、啮齿类致癌性试验以及生殖发育毒理试验等GLP试验需要的。毒理病理学报告要求较高,专题病理学家要具有病理学专业技能,并在毒理病理报告中签字。毒理病理学报告中应该有试验方法、数据及特殊切片或技术的详细描述,并且有清晰的照片、图片帮助登记机构对结果进行确认。此外,报告中还需要给出给药相关的生物学和毒理学关系等的相关科学文献或试验背景数据等。
6 结 语
我国是农药生产和出口大国,要开拓海外市场,优秀的GLP报告是不可或缺的工具。GLP实验室和企业委托方是保证其质量的两大支柱。
一份优秀的 GLP报告要有国际通用的导则(一般是OECD Guidelines),以及国际通用的统计学方法,要完全按照导则中要求的试验条件、物种、年龄、性别和环境等条件等进行试验。在GLP报告中需要描述试验的详细步骤、给药方法、观察方法、毒性反应症状、体重变化、死亡时间、LD50和LD5及其可信限的计算方法和结果讨论等。试验报告中要提供各种清晰可辨代表性谱图或图片,要具有科学性的令人信服的解释。
随着我国企业对农药海外登记的重视,及国内GLP实验室的兴起,相信中国农药企业能够获得在国际市场更多的话语权,实现由农药大国向农药强国的转变。
