红细胞分布宽度对急性缺血性卒中患者静脉溶栓转归的预测价值
2020-05-09薛娟娟路蔚夏晓爽李新
薛娟娟,路蔚,夏晓爽,李新
急性缺血性卒中(AIS)是卒中最常见的类型,约占我国脑卒中的70%[1-2]。目前阿替普酶静脉溶栓被公认为是时间窗内就诊的AIS患者的首选治疗措施[3-4],但即使接受静脉溶栓治疗,患者恢复程度也各不相同[5-6]。红细胞分布宽度(red blood cell distribution width,RDW)是反映人体外周血红细胞体积异质性的一项血常规参数,最早应用于协助诊断贫血类型,现有诸多研究发现RDW除帮助诊断血液系统疾病外,还与许多心脑血管病的病情严重程度以及预后密切相关[7-8],近年来有少数研究进一步发现RDW水平的高低能一定程度预测AIS患者接受静脉溶栓治疗后的症状改善程度[9],但关于RDW对AIS患者静脉溶栓后转归预测价值的研究较少。本研究旨在通过回顾性分析RDW对接受静脉溶栓治疗的AIS患者转归的预测作用,旨在临床能早期识别静脉溶栓后的不良预后,早期进行干预以改善卒中预后。
1 对象与方法
1.1 研究对象 收集2017年1月—2019年1月于天津医科大学第二医院神经内科接受阿替普酶静脉溶栓并住院治疗的AIS患者。纳入标准:(1)年龄≥18岁。(2)发病至静脉溶栓治疗开始时间在4.5 h以内。(3)临床症状均符合中国急性缺血性脑卒中诊治指南2018制定的诊断标准[4]。(4)美国国立卫生研究院卒中量表(NIHSS)评分[10]4~25分。(5)患者或家属签署知情同意书。排除标准:(1)符合中国急性缺血性脑卒中诊治指南2018制定的3 h及3~4.5 h静脉溶栓的禁忌证[4]。(2)静脉溶栓后桥接进行血管内治疗。(3)合并恶性肿瘤。(4)近期使用影响尿酸代谢或影响凝血功能的药物。(5)伴有严重肝肾功能不全。(6)合并与高血糖有关的疾病,如甲状腺和肾上腺、垂体疾患。(7)合并慢性阻塞性肺病、严重心力衰竭、贫血(血红蛋白:男性<120 g/L,女性<110 g/L)。(8)伴有血液系统疾病、免疫系统疾病及结缔组织病。(9)入院前1个月内有严重感染。(10)人口统计学及相关基线临床资料不全。依据以上条件最终纳入122例患者,其中男74例,女48例,年龄45~89岁,平均(70.3±10.8)岁。
1.2 研究方法 所有患者均在急诊就诊(发病4.5 h内)时抽取外周静脉血,采血1 h内采用BC-6800全自动血细胞分析仪(深圳迈瑞生物医疗电子股份有限公司)检测血常规[白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白(HGB)、血小板计数(PLT)、红细胞分布宽度(RDW)];采用BS2000生化分析仪(深圳迈瑞生物医疗电子股份有限公司)检测尿酸(UA)、白蛋白(ALB);次日清晨空腹采血检验生化指标:空腹血糖(FBG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、总胆固醇(TC)、三酰甘油(TG)、空腹血糖(FBG)、高同型半胱氨酸(HCY)、超敏C反应蛋白(hs-CRP);采用NIHSS评价入院神经功能缺损程度;记录发病至溶栓时间(ONT)。
1.3 治疗方法 入选患者在行急诊头CT、心电图、静脉抽血、签署静脉溶栓知情同意书后,采用德国Boehringer Ingelheim公司生产的阿替普酶冻干粉(规格:20 mg和50 mg),按照0.9 mg/kg剂量溶于100 mL生理盐水,其中10%在1 min内进行外周静脉推注,剩余90%通过输液泵持续静脉滴注1 h,最大治疗剂量90 mg,溶栓后24 h复查头CT或进行头MRI检查,核实未出血者给予抗血小板聚集药及神经保护等治疗。
1.4 转归评价 在患者溶栓治疗后3个月随访,应用改良Rankin量表(modified Rankin Scale,mRS)评估临床转归[11],0~2分为转归良好,>2分为转归不良。根据评估结果将患者分为转归良好组69例,转归不良组53例。
1.5 统计学方法 采用SPSS 17.0软件进行统计学处理。符合正态分布的计量资料以均数±标准差()表示,2组间比较采用独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Kolmogorov-Smirnov Z检验;计数资料以例(%)表示,组间比较采用χ2检验。AIS患者转归不良的影响因素采用多因素Logistic回归分析;绘制受试者工作特征(receiver operator characteristic,ROC)曲线分析RDW对AIS患者静脉溶栓转归不良的预测效能。以P<0.05为差异有统计学意义。
2 结果
2.1 2组患者临床资料比较 转归不良组年龄、高血压史、卒中史、心脏病史、房颤史的比例以及入院NIHSS评分均高于转归良好组,差异有统计学意义;2组性别、糖尿病史、高脂血症史、吸烟、饮酒、入院收缩压、入院舒张压、ONT差异无统计学意义,见表1。
2.2 2组患者血常规及生化指标比较 转归不良组FBG、hs-CRP、UA和RDW均高于转归良好组,差异有统计学意义;2组HCY、TC、TG、LDL-C、HDL-C、ALB、WBC、RBC、HGB、PLT差异均无统计学意义,见表2。
2.3 AIS患者静脉溶栓治疗转归不良的危险因素分析 以静脉溶栓后转归为因变量(转归良好=0,转归不良=1),高血压史(无=0,有=1)、心脏病史(无=0,有=1)、卒中史(无=0,有=1)、房颤史(无=0,有=1)、年龄、入院NIHSS评分、FBG、hs-CRP、UA和RDW为自变量,结果显示,高FBG、高RDW、入院高NIHSS评分是AIS患者静脉溶栓转归不良的危险因素,见表3。
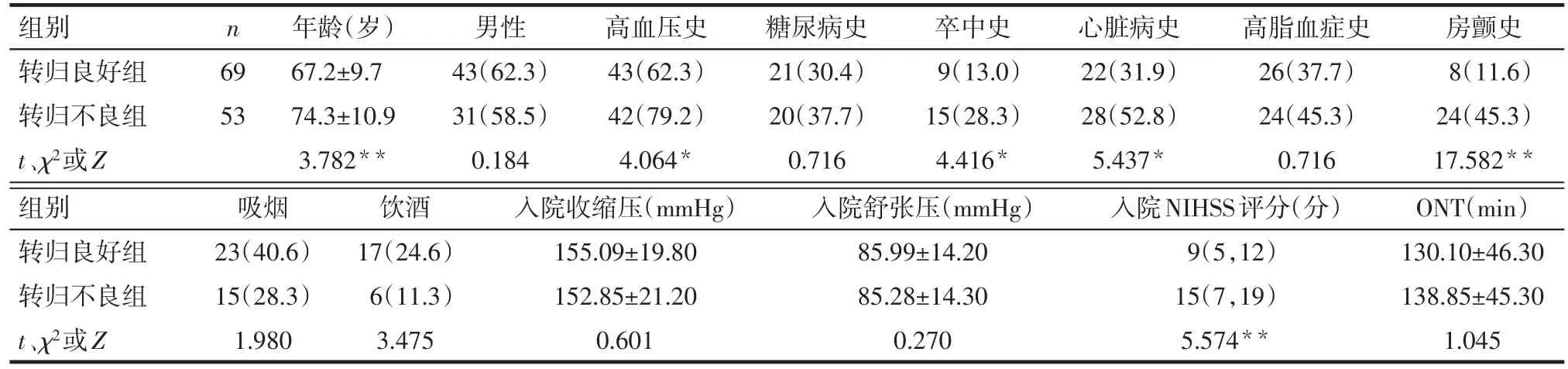
Tab.1 Comparison of clinical data between the two groups表1 2组患者临床资料比较
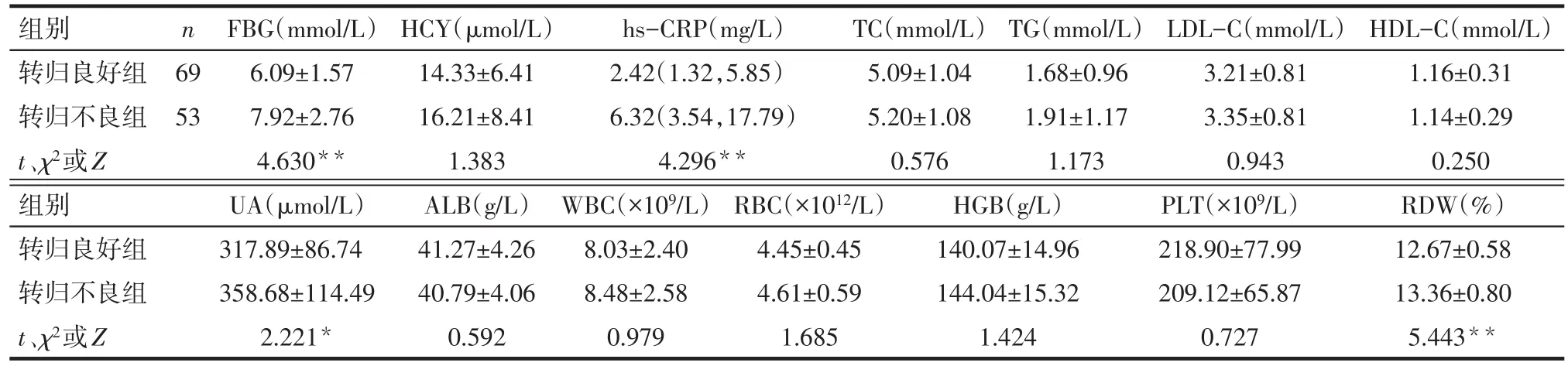
Tab.2 Comparison of blood count and biochemical data between the two groups表2 2组患者血常规及生化指标比较
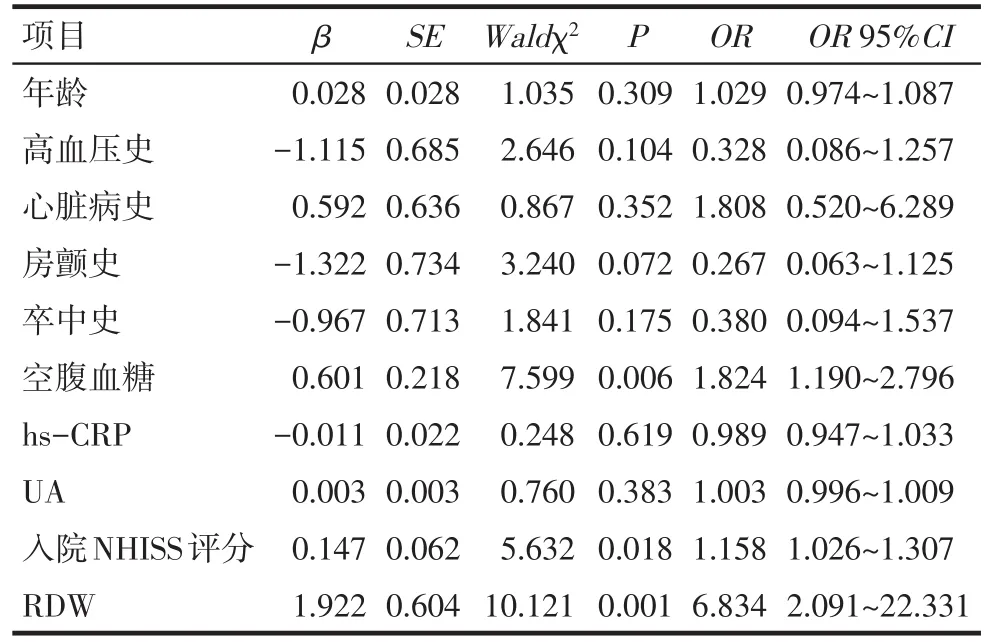
Tab.3 Multiple-factor Logistic regression analysis of factors affecting poor outcome in patients with AIS after intravenous thrombolysis表3 AIS患者静脉溶栓转归不良影响因素的多变量Logistic回归分析
2.4 RDW为变量对AIS患者静脉溶栓转归不良的ROC曲线及最佳临界值评估 将RDW纳入ROC曲线分析,RDW预测AIS患者静脉溶栓转归不良的ROC曲线下面积为0.754(95%CI:0.665~0.843),最大约登指数为0.464,其对应RDW临界值为13.15%,其敏感度为62.3%,特异度为84.1%,见图1。
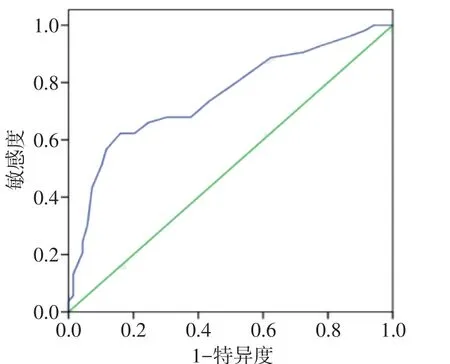
Fig.1 The ROC curve of RDW for predicting poor outcome of patients with AIS after intravenous thrombolysis图1 RDW预测AIS患者静脉溶栓转归不良的ROC曲线
3 讨论
AIS具有高发病率、高致残率、高病死率以及高复发率,静脉溶栓是治疗AIS的有效措施,目前超早期静脉溶栓已成为各国AIS治疗指南的首选推荐,但经静脉溶栓治疗后患者的转归情况各异。故进一步探索AIS患者静脉溶栓后转归不良的影响因素显得尤为重要。RDW是反映人体红细胞体积变化的一项血常规参数,用红细胞体积大小的变异系数来表示,RDW升高表明红细胞的体积异质性增大,最早用于临床上贫血的诊断与分类,近年来被越来越多的研究发现RDW与心血管疾病如心力衰竭、房颤、心脏骤停、急性心肌梗死等存在相关性[7,12-13],研究还发现RDW对其他疾病如危重症[14]、肿瘤[15]、急性肾损伤[16]等方面有预测价值。
目前研究还发现RDW还与脑血管疾病的发生、严重程度以及转归等方面密切相关[8]。Mo等[17]研究发现脑卒中患者的RDW水平要明显高于非卒中患者,且随访发现RDW水平较高的患者发生脑梗死的风险更高。Turcato等[9]研究发现高水平RDW不仅与AIS患者静脉溶栓后7 d临床症状无改善相关,且进一步长期随访发现RDW>14.5%与AIS患者经静脉溶栓治疗后1年死亡率呈正相关。本研究结果显示,转归不良组AIS患者静脉溶栓后3个月的RDW水平明显高于转归良好组,且多变量Logistic回归分析显示,在校正相关混杂因素后,RDW仍为AIS患者静脉溶栓后转归不良的危险因素,提示发病时基线RDW水平增高有可能预示静脉溶栓后转归不良。考虑原因可能包括以下方面:(1)炎性反应机制。已有研究发现RDW与hs-CRP、红细胞沉降率等炎性指标具有明确相关性[18],AIS发病往往伴随慢性炎症状态,炎性因子大量释放通过损伤缺血半暗带造成脑梗死病情加重[19],炎性反应还可以通过抑制促红细胞生成素合成,阻碍红细胞成熟,使幼稚红细胞进入血液循环而引起RDW升高[20]。(2)氧化应激机制。氧化应激通过破坏红细胞膜引起红细胞渗透脆性增加,增加红细胞变形能力,降低红细胞生命周期和成熟率,从而引起RDW升高,脑缺血-再灌注损伤机制与氧化应激密切相关,氧化应激增强致自由基清除能力下降,大量自由基生成造成卒中患者神经功能恶化和死亡[21]。(3)脂质代谢紊乱。缺血性卒中患者常合并脂质代谢紊乱,有研究表明,高胆固醇人群中RDW较高,高胆固醇水平缩短红细胞寿命,使红细胞更新速度加快,致RDW增高[22]。(4)血液凝集状态。RDW增高反映红细胞的凝集状态,静脉溶栓药物阿替普酶(rt-PA)为纤溶酶原激活剂,溶栓过程为该药物直接或间接使血栓中的纤维蛋白溶解,从而使阻塞的血管再通,而红细胞在纤维蛋白溶解的过程中起重要作用,红细胞凝集状态可促进血小板黏附、激活、聚集,阻碍纤维蛋白溶解,造成静脉溶栓血管再通失败、转归不良的结局[23]。(5)神经内分泌机制。缺血性卒中发生后神经内分泌系统被激活,血管紧张素Ⅱ等缩血管物质分泌增加,刺激促红细胞生成,进一步造成RDW升高[24];另外,AIS患者往往合并营养不良、高血压以及心房颤动等,这些情况均有可能引起RDW升高,亦有可能进一步引起溶栓后的不良结局[22]。总体来说,RDW升高能一定程度上预测AIS患者静脉溶栓转归不良可能是以上多种机制共同参与的结果。本研究进一步通过ROC曲线分析发现,当RDW临界值为13.15%时,其预测效能最高,提示RDW可作为预测AIS患者静脉溶栓后转归不良的临床指标。
本研究结果显示,高空腹血糖与入院高NIHSS评分亦是AIS患者静脉溶栓转归不良的独立危险因素,长期高血糖一方面会加重炎症反应,另一方面可导致机体大量氧自由基蓄积,通过氧化应激等机制促使缺血半暗带细胞坏死、削弱侧支循环,从而加重再灌注损伤,引起神经功能恶化致转归不良[25-26]。NIHSS评分是目前临床最常用的AIS发生后评估神经功能缺损严重程度的工具,NIHSS评分越高提示卒中程度越重,Wu等[27]研究表明,高NIHSS评分是预测AIS静脉溶栓后转归不良的高效能指标,入院NIHSS评分12分可作为静脉溶栓治疗后转归不良的最佳截断值,其敏感性为51%,特异性达84%,且在静脉溶栓后5~24 h后预测价值更高,本研究显示NIHSS评分高者转归较差,与之一致。
总之,许多研究已发现RDW的变化在一定程度上可以反映疾病发展状态,加之具有经济快速、结果易得及容易推广等优势,本研究也发现RDW对AIS患者静脉溶栓转归不良有一定的预测价值。然而,用RDW作为一项评估指标尚存在一些缺陷,比如RDW受干扰因素较多、且没有被接受的统一的临床诊断临界值,故较难真正应用于临床实践。另外,本研究尚有一些不足之处,由于本研究样本量较小,且为单中心回顾性研究,而且排除了严重感染、血液系统疾病等患者,存在一定的局限性,在今后的研究中,尚需进一步扩大样本量来稀释干扰因素引起的潜在偏倚,以期更可靠地反映RDW对于AIS患者预后的影响,并进行多中心随机对照试验来证实。
