抑制BHK21细胞STYK1/NOK基因的转录组分析
2020-05-09高婧雅张骊谢炎郭庆军田大治李俊杰蒋文涛刘力
高婧雅,张骊,谢炎,郭庆军,田大治,李俊杰,蒋文涛△,刘力
丝氨酸-苏氨酸-酪氨酸激酶1(serine threonine tyrosine kinase 1,STYK1)也称为NOK,是受体酪氨酸激酶,可选择性地使酪氨酸残基磷酸化,其在肿瘤形成与进展的过程中发挥作用[1-3]。大多数受体酪氨酸激酶包括胞内结构域、跨膜区和胞外结构域,但是STYK1/NOK的胞外结构域缺乏N端的信号肽。研究表明,STYK1/NOK可诱导裸鼠成瘤和肿瘤转移,因此认为其为癌基因[4-6]。同时STYK1/NOK在小儿脑胶质瘤中高表达,抑制STYK1/NOK表达可降低胆囊癌细胞磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)和蛋白激酶 B(AKT)蛋白表达,抑制细胞增殖和转移[7]。此外,STYK1/NOK在胆囊癌中也发挥促进肿瘤增殖的作用[8]。为了探讨抑制STYK1/NOK对BHK21细胞的具体影响,笔者进行了转录组分析,观察si-RNA抑制STYK1/NOK后BHK21细胞的基因表达变化及其生物学功能的影响。
1 材料与方法
1.1 细胞及试剂 BHK21细胞购于中国医学科学院基础医学研究所细胞资源中心,用含10%小牛血清的DMEM高糖培养基,在37℃、5%CO2培养箱中培养。DMEM培养基(Hyclone),小牛血清(百奥莱博),转染试剂Neofect(北京码因科技有限公司),胰酶(Gibco),One Step TB Green™PrimeScript™ RT-PCR KitⅡ 试剂盒(TaKaRa),CCK-8试剂盒(DOJIND公司),β-actin抗体、STYK1/NOK抗体(武汉三鹰),5%CO2培养箱(Thermo Fisher),倒置显微镜(北京澳浦),荧光定量PCR仪(Biorad Connect)。
1.2 方法
1.2.1 细胞瞬时转染及鉴定 将BHK21细胞均分为3组,分别转染6µg空载体pBs/U6(空载体组)、2µg si-STYK1/NOK质粒+4µg空载体pBs/U6(低转染浓度组)和6µg si-STYK1/NOK质粒(高转染浓度组)。消化,传代BHK21细胞,待第2天细胞长至70%~80%时开始转染。在转染前2 h更换培养基。应用半量原则,制作转染混悬液:3µL转染试剂+相应质粒+150µL无血清培养基,静置15 min后,逐滴逐部位加入培养皿中。3组细胞瞬时转染48 h后。消化并提取细胞总蛋白。BCA法定量后将制备好的15µL蛋白样品行SDS-PAGE(90 V至蛋白跑至分离胶,140 V,2 h)。随后,300 mA恒流冰浴转膜2 h。在37℃的振荡器中,5%脱脂牛奶封闭1 h,一抗4℃封闭过夜。次日TBST洗涤后二抗,37℃的振荡器中孵育1 h。显影。
1.2.2 转录组测序 根据转染效果,选取空载体组和高转染浓度组行转录组测序。在转染48 h后收集细胞,应用Trizol法提取总RNA。检测RNA质量后将每组RNA平均分为2份,置于-20℃保存。检测RNA质量,保证RNA在提取过程中未降解。RNA检测合格后,构建cDNA文库。随后,将双链cDNA进行末端修复、加A尾并连接测序接头;最后PCR扩增后,使用Illumina HiSeq测序仪进行测序。
1.2.3 测序结果分析 对Illumina HiSeq测序得到的raw data进行过滤,将过滤得到的clean reads比对到参考序列,采用HISAT将clean reads比对到参考基因组[9]。基于比对结果,进行差异基因分析,删选条件为P<0.001。获得差异表达基因后,应用R软件中的pheatmap函数进行层次聚类分析。多组差异基因同时聚类时,对组间交集差异基因与并集差异基因单独进行聚类分析。将差异表达基因进行功能分类,应用R软件中的phyper函数进行富集分析,对P值进行FDR校正,FDR=0.01的功能视为显著富集。将差异表达基因进行KEGG信号通路分析,要应用STRING蛋白质互作数据库(http://string-db.org/)中的互作关系进行差异基因蛋白互作网络的分析(Protein-protein interaction networks,PPI)。
1.2.4 实时定量基因扩增荧光(qRT-PCR)验证差异表达基因 随机抽取分析所得的差异表达基因进行qRT-PCR验证。应用同一批RNA,逆转录为cDNA后进行qRT-PCR。反应条件:42 ℃ 5 min;95 ℃ 10 s;95℃ 5 s,60 ℃ 30 s,40个循环。结果采用2ΔΔCt法采用分析,qRT-PCR引物序列见表1。

Tab.1 The primer of qRT-PCR表1qRT-PCR引物
1.2.5 CCK-8法检测细胞增殖 向12孔板的待测孔内各加入3×105个细胞,在37 ℃、5%CO2条件下培养约24 h,当细胞汇合度达80%~90%,开始转染。细胞转染48 h后胰酶消化,均匀分至96孔板中;置入培养箱培养2 h,待细胞贴壁后,加入5µL CCK-8试剂;再次放入细胞培养箱中,观察颜色变化,2~2.5 h后用酶标仪测定450 nm处各孔的吸光度。
1.3 统计学方法 所有数据采用SPSS 21.0进行分析,符合正态分布的计量资料以均数±标准差()表示,组间比较采用独立样本t检验;应用Graphpad Prism 8.0制作柱形图,以P<0.05为差异有统计学意义。
2 结果
2.1 si-RNA可抑制BHK21细胞STYK1/NOK蛋白表达 Western blot检测结果显示,si-RNA干扰后高转染浓度组STYK1/NOK表达较低转染浓度组和空载体组明显下降,见图1。
2.2 差异表达基因分析 测序结果显示,与空载体组相比,高转染浓度组共有44个差异表达基因,其中表达上调19个,表达下调25个(表2)。随后根据分析结果,利用差异表达基因制作热图(图2A)和MA图(图2B)。

Fig.1 WesternblotdetectionofSTYK1/NOKexpressionsinthreegroups图1 Western blot检测3组STYK1/NOK表达
2.3 差异表达基因GO功能和KEGG通路分析 差异表达基因GO功能分析结果分为生物学功能(biological process)、细胞组分(cellular component)和分子功能(molecular function)3部分。44个差异表达基因中,在生物学功能中主要集中在生物调控(biological regulation)、细胞进程(cellular process)、代谢调控(metabolic process)、细胞生物过程的调控(regulation of biological process)等方面;在细胞组分中主要集中在细胞(cell)、细胞部分(cell part)、胞外区(extracellular region)等方面;在分子功能上主要集中在配体(binding)和催化活性(catalytic activity)上,见图3A。KEGG通路分析发现差异表达基因主要集中作用于免疫系统(Immune system)、癌症(Cancers:Overview)、信号转导(Signal transduction)和氨基酸代谢(Amino acid metabolism)等方面,见图3B。
2.4 蛋白互作网络分析 根据差异表达基因制作蛋白互作网络图,发现丙氨酰tRNA合成酶(alanyl tRNA synthetase,AARS)、乙醛脱氢酶18家族成员A1(aldehyde dehydrogenase family18 member A1,Aldh18a1)、磷酸甘油酸脱氢酶(phosphoglycerate dehydrogenase,Phgdh)、亚甲基四氢叶酸脱氢酶1(methylenetetrahydrofolate dehydrogenase 1 like,Mthfd1l)、亚甲基四氢叶酸脱氢酶2(methylenetetrahydrofolate dehydrogenase 2,Mthfd2)、硫氧还蛋白还原酶1(thioredoxin reductase-1,Txnrd1)和L型氨基酸转运载体1(L-type amino acid transporter 1,LAT1,又称Slc7a5)等7个蛋白存在相互作用。细胞周期蛋白依赖性激酶抑制剂2C(cyclin-Dependent Kinase N2C,Cdkn2c)、细胞周期蛋白 D1(cyclin D1,Ccnd1)、内皮素 1(Endothelin1,Edn1)和XP_005077024.1(LOC101839392)等4个蛋白间存在相互作用。此外,结合珠蛋白基因(haptoglobin,Hp)、纤 维 蛋白原 γ链(fibrinogen gamma chain,Fgg)、纤维蛋白原 α 链(fibrinogen alpha chain,Fga)、凝血因子すA 链(coagulation factorすA chain,F13a1)的蛋白表达间亦存在相互作用。见图4。
2.5 qRT-PCR验证差异表达基因 根据转录组测序结果,选取2个上调表达基因[Mthfd2、转录激活因子5(activating transcription factor 5,Atf5)]和2个下调表达基因[ⅡA分泌型磷脂酶A2(phospholipase A2 group IIA,Pla2g2a)、6-磷酸果糖-2-激酶/果糖-2,6-双 磷 酸 酶 3(6-phosphofructo-2-kinase/fructose-2,6-biphosphatase 3,Pfkfb3)]行 qRT-PCR
验证。结果显示,抑制STYK1/NOK后,Mthfd2、Atf5表达上调,Pla2g2a、Pfkfb3表达下调,与测序结果相一致,见表3。
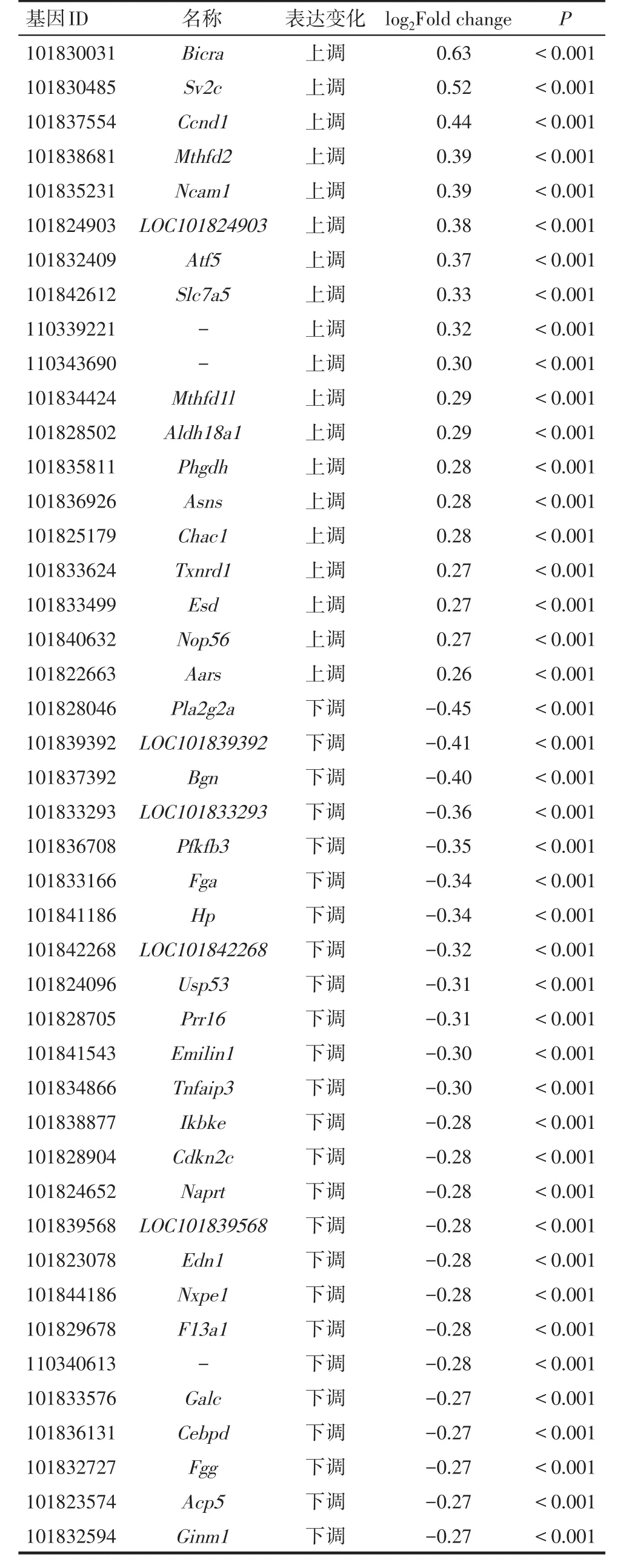
Tab.2 Differentially expressed genes in two groups after knocking down STYK1/NOK expression in BHK21 cells表2 抑制BHK21细胞STYK1/NOK表达后2组差异表达基因
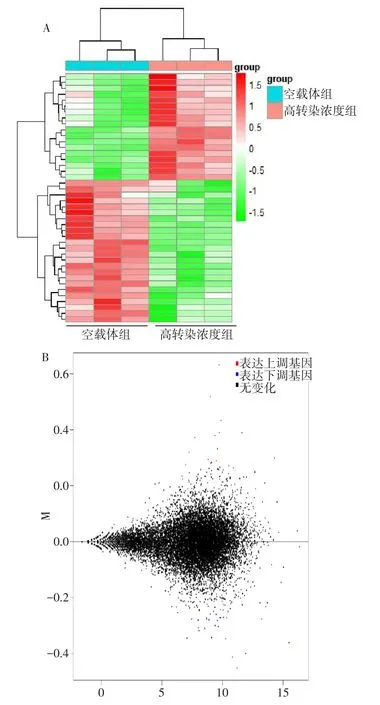
Fig.2 Cluster analysis of differentially expressed genes and differentially expressed MA map in empty vector group and high concentration transfection group图2 空载体组和高转染浓度组差异表达基因聚类分析和差异表达MA图
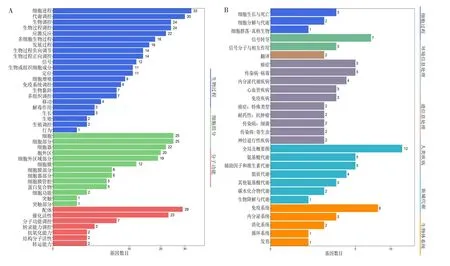
Fig.3 Functional analysis of differentially expressed genes in empty vector group and high concentration transfection group.图3 空载体组和高转染浓度组差异表达基因功能分析
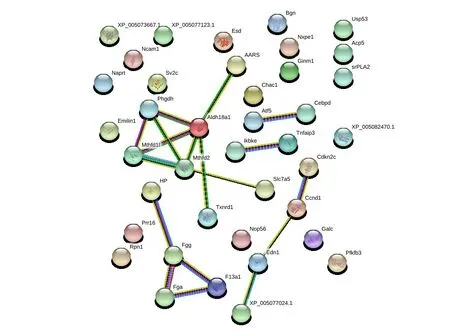
Fig.4 Protein-protein interaction networks of differentially expressed genes in empty vector group and high concentration transfection group图4 空载体组和高转染浓度组差异表达基因蛋白互作网络
2.6 2组细胞增殖情况分析 CCK-8结果显示,与空载体组相比,高转染浓度组细胞增殖水平升高,(0.88±0.12 vs.0.41±0.05),差异有统计学意义(n=3,t=6.245,P<0.01)。
3 讨论
许多研究已表明基因表达变异与疾病的发生发展相关,如抑制叉头框K1基因(FOXK1)可抑制肝癌细胞生长[10],上调基质金属蛋白酶16基因(MMP16)表达可促进肾癌生长和侵袭[11],抑制KCTD10可促进胃肠间质瘤转移与侵袭等[12]。BHK21细胞是仓鼠正常肾细胞,本研究主要探讨抑制BHK21细胞中的STYK1/NOK表达对细胞生物功能的影响。通过转录组测序分析发现,与空载体组相比,抑制STYK1/NOK后共有19个基因表达上调,25个基因表达下调,通过GO功能分析和KEGG通路分析发现,差异表达基因主要位于细胞、细胞部分、胞外区,参与细胞进程、代谢、细胞生物过程的调控,主要影响免疫系统、癌症、细胞周期、信号转导和氨基酸代谢等方面,其表达上调基因Mthfd1l[13]、Mthfd2[14]、Ccnd1[15],表达下调基因Cdkn2c、Cebpd均与肿瘤的发生发展相关。
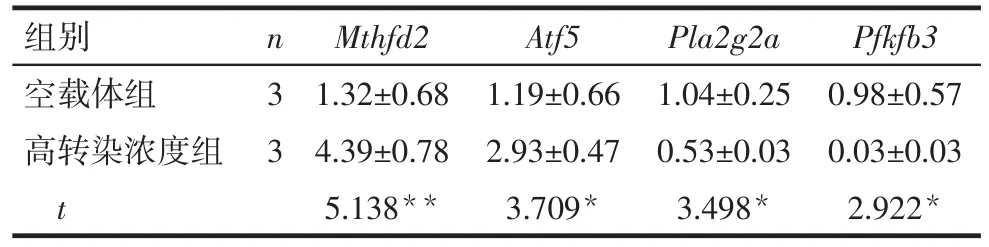
Tab.3 qRT-PCR analysis of differential gene expression in empty vector group and high concentration transfection group表3 qRT-PCR分析空载体组和高转染浓度组差异基因表达
Mthfd1l是叶酸循环中的一种酶,主要参与甲酸合成。研究表明Mthfd1l在大肠癌组织中高表达,抑制Mthfd1l表达可抑制大肠癌细胞增殖与侵袭,表明其与大肠癌的发生发展相关[13]。Yang等[16]也发现Mthfd1l在食管鳞状细胞癌组织中高表达,进一步发现其在食管癌细胞系TE-1和EC109中亦高表达,抑制其表达可降低TE-1细胞增殖,表明Mthfd1l在食管鳞状细胞癌中促进肿瘤进展。Eich等[17]发现Mthfd1l在膀胱癌中高表达,其过表达后促进膀胱癌细胞系增殖与集落形成。
Mthfd2是一种参与叶酸代谢的线粒体酶,位于线粒体内,发挥亚甲基脱氢酶和环水解酶的双功能酶。研究发现Mthfd2在非小细胞肺癌组织及细胞系中高表达,敲低非小细胞肺癌细胞系H1299的Mthfd2表达,可降低细胞周期相关蛋白细胞周期蛋白 A2(cyclin A2,CCNA2)、微小染色体维持蛋白 7(mini-chromosome maintenance protein 7,MCM7)和S期激酶相关蛋白2(S-phase kinase-associated protein2,SKP2)的蛋白和mRNA表达,提示Mthfd2可能通过影响细胞周期促进肿瘤增殖[18]。Lin等[19]研究发现,Mthfd2过表达与肾癌患者临床分期及较差预后相关(P<0.05),敲低肾癌细胞系786-O细胞Mthfd2表达可抑制细胞增殖与侵袭。
Cebpd是CCAAT增强子结合蛋白δ,是涉及细胞分化、代谢、炎症、生长停滞和细胞死亡等多种生理过程的转录因子。Cebpd是候选肿瘤抑制基因,与细胞凋亡及细胞增殖相关。有研究发现,肝癌组织中CebpdmRNA表达较正常组织减少,且与肝癌患者预后差相关[20]。此外,ATF5在诸多肿瘤组织,如神经胶质瘤、肺癌、乳腺癌中高表达[20-21]。Nukuda等[22]研究表明,通过si-RNA抑制乳腺癌细胞系MCF7的ATF5表达,可降低癌细胞的侵袭性。
本研究中,通过转录组测序结果发现抑制STYK1/NOK表达后BHK21细胞中Mthfd1l、Mthfd2和ATF5高表达,Cebpd低表达。既往认为Mthfd1l、Mthfd2和ATF5高表达均促进肿瘤发生发展或是与肿瘤患者较差预后相关,而Cebpd为候选抑癌基因,其低表达亦可能促进肿瘤发生发展,表明抑制BHK21细胞STYK1/NOK蛋白表达后,可能促使BHK21细胞向癌细胞转化。
综上所述,BHK21细胞中抑制STYK1/NOK表达后将致使原癌基因表达增强,抑癌基因表达减少,可能导致BHK21细胞癌变。进一步实验表明,抑制STYK1/NOK蛋白表达后细胞增殖明显增加,与转录组测序结果相符,然而,现有研究表明STYK1/NOK的高表达与诸多肿瘤的发生发展相关,本分析结果与现有文献报道结果不符,可能是STYK1/NOK在BHK21细胞中具有特殊作用,具体原因仍需进一步研究。
