1,25-二羟维生素D3通过TGF-β1/(Smad2/3)影响的ROS调节气道重塑
2020-05-09张鹤张沄王宋平
张鹤,张沄,王宋平
支气管哮喘(哮喘)是由多种细胞和细胞组分参与的以气道慢性炎症为特征的异质性疾病。氧化-抗氧化机制失衡是支气管哮喘的发病机制之一[1]。其中活性氧(ROS)可促进气道高反应、黏液高分泌等,导致气道重塑[2-3]。转化生长因子-β1(TGF-β1)通过诱导胶原蛋白的合成和成纤维细胞的增殖,导致气道基底膜增厚,从而引起气道重塑[4]。而TGF-β1同时具有调节多种细胞生长和分化等功能,可以刺激细胞产生ROS,促进氧化应激反应,加速纤维化进程[5-6]。近年来1,25-二羟维生素D3[1,25-(OH)2D3]在支气管哮喘方面的研究成为热点。相关研究表明,1,25-(OH)2D3对哮喘的气道炎症及气道重塑有抑制作用,1,25-(OH)2D3可以通过抑制TGF-β1/Smads通路,从而改善气道重塑[7]。同时1,25-(OH)2D3也具有抗氧化应激作用,通过减少ROS生成,调控哮喘气道氧化应激水平,从而达到抗炎和抗氧化作用[8]。但目前1,25-(OH)2D3对于支气管哮喘通过TGF-β1/(Smad2/3)通路调节ROS的机制尚不明确。本研究通过构造慢性哮喘小鼠模型,探讨1,25-(OH)2D3对哮喘小鼠气道重塑和对氧化应激的影响及其机制,以期为哮喘临床应用提供参考。
1 资料与方法
1.1 一般资料 (1)实验动物。雌性SPF级Balb/c小鼠24只,周龄6~8周,体质量18~24 g,购自重庆莱彼特生物科技有限公司,饲养于西南医科大学动物房,恒温25℃,清洁饲料喂养,自由饮食和饮水,12 h昼夜交替。(2)主要药品与试剂。卵清白蛋白(ovalbumin,OVA)购自美国Sigma公司,氢氧化铝粉剂购自成都市科隆化学品有限公司,1,25-(OH)2D3粉剂购自阿拉丁公司,无水乙醇购自成都市科隆化学品有限公司,自制密闭纸箱30 cm×30 cm×20 cm,超声雾化器购自东莞市健宝电子科技有限公司,TGF-β1和Smad2/3抗体分别购自武汉三鹰公司和CST公司。
1.2 哮喘模型的制备 参照文献[9],标准饲养1周后24只小鼠随机分为正常组(A组)、哮喘组(B组)、1,25-(OH)2D3+哮喘组(C组)。B组和C组分别于第0、7、14天腹腔注射0.5 mL致敏液(10µg卵清蛋白与2 mg氢氧化铝制剂),而A组则注射等量的生理盐水。于第21天将B、C组小鼠分别置于封闭纸箱中,以2.5%OVA溶液雾化30 min,其中第21~27天每天雾化1次,第28~77天隔天雾化1次。而A组给予等量的生理盐水雾化。C组在第21天每次雾化激发前30 min腹腔注射100 ng 1,25-(OH)2D3溶液。A组及B组给予等量的生理盐水进行腹腔注射。整个实验过程持续至少77 d。
1.3 肺组织病理形态检测 各组小鼠于末次激发后24 h内用戊巴比妥麻醉并处死。取出右肺置于4%甲醛溶液中外固定48 h,常规制备病理石蜡切片,用于HE、PAS染色及Masson染色,免疫荧光检测小鼠气道ROS。
1.4 气道重塑相关指标测量 Masson染色观察气道胶原沉积程度,运用计算机图像分析软件Image-Pro Plus测量气道胶原沉积的面积,分别测量支气管基底膜周径(Pbm)、气管内管壁面积(WAi)、平滑肌层面积(WAm),并用Pbm将测量值标准化,分别代表支气管内壁厚度(WAi/Pbm),平滑肌层厚度(WAm/Pbm),以衡量气道重塑程度。
1.5 各组小鼠肺组织中ROS水平检测 将小鼠处死后取出肺组织,用磷酸盐缓冲溶液(PBS)稍洗,冷冻,将冷冻后的肺组织用冰冻切片机,切片。制片后,滴加稀释好的探针溶液,37℃孵育30 min,PBS洗去多余探针溶液,抗体孵育后用二脒基苯基吲哚(DAPI)染色,用抗荧光淬灭剂封片,用荧光显微镜(×200)观察并拍照。
1.6 肺组织中TGF-β1及Smad2/3的表达 提取小鼠肺组织匀浆总蛋白,使用BCA蛋白质浓度测定试剂盒测定蛋白浓度,采用SDS-PAGE、转膜、抗体孵育、化学发光。检测肺组织中TGF-β1及Smad2/3的表达。
1.7 统计学方法 采用SPSS 17.0统计软件进行数据分析。符合正态分布的计量资料以表示,多组间采用单因素方差分析,组间多重比较方差齐者采用LSD-t检验,方差不齐者采用Dunnett-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 肺组织病理形态改变
2.1.1 HE染色 A组小鼠可见气道上皮结构完整,未见明显破坏。B组可见大量炎性细胞,气道管腔分泌物,支气管壁增厚,支气管平滑肌肥大,黏膜下水肿。C组小鼠气道上皮结构相对完整,仍可见少许气道上皮脱落,病理改变较B组减轻。见图1。
2.1.2 PAS染色 A组小鼠气道上皮结构完整,未见支气管上皮杯状细胞,气道管腔光滑,未见黏液分泌;与A组比较,B组小鼠支气管上皮杯状细胞增生,黏液分泌增加,部分管腔黏液栓形成,PAS染色阳性细胞数明显增加;C组较B组支气管上皮杯状细胞增生及黏液分泌减少,PAS染色阳性细胞数减少,但较A组增多,见图2。
2.1.3 Masson染色 A组气管腔气道上皮光滑,气道上皮有少许胶原沉积,B组气道上皮下胶原沉积明显增多,病理改变明显,而C组较B组上述改变减轻,但仍较A组多,见图3。
2.1.4 各组胶原沉积面积、壁厚度和平滑肌厚度比较 与A组比较,B组胶原沉积面积比、支气管管壁厚度和平滑肌厚度明显增加,C组胶原沉积面积比、管壁厚度和平滑肌厚度较B组减少,但仍较A组增加(P<0.05),见表1。
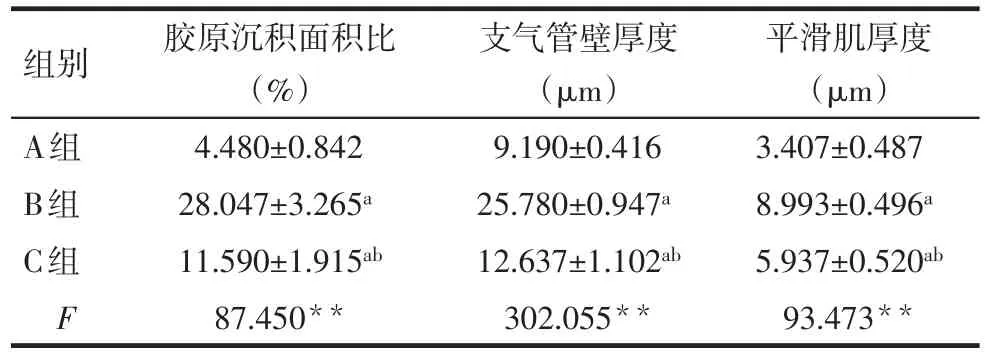
Tab.1 comparison of bronchial wall thickness,smooth muscle thickness and collagen deposition area ratio between three groups表1 3组支气管胶原沉积面积比、管壁厚度和平滑肌厚度比较 (n=3,x±s)
2.2 各组肺组织ROS、TGF-β1、Smad2/3蛋白的表达水平比较 正常情况下,A组细胞中产生低水平的ROS,TGF-β1、Smad2/3蛋白也呈低表达,B组较A组ROS、TGF-β1、Smad2/3蛋白的表达水平明显升高;与B组相比,C组ROS,TGF-β1、Smad2/3蛋白的表达降低,但仍较A组升高(P<0.05),见图 4、5,表2。
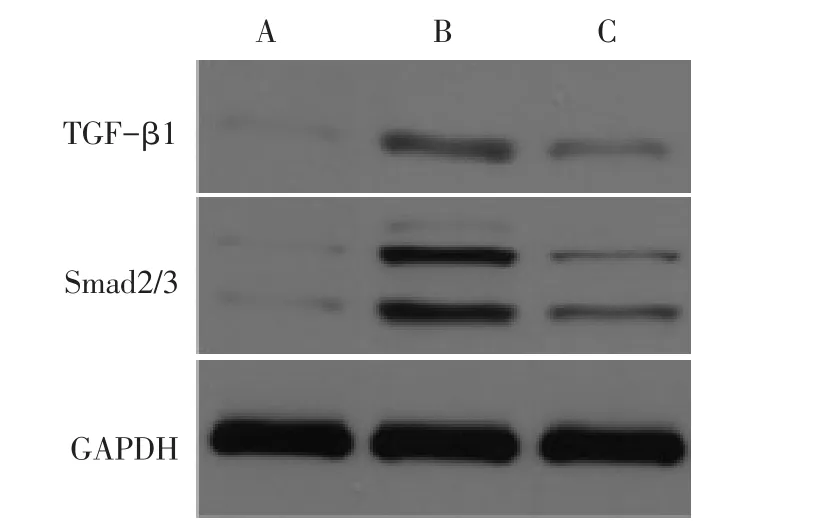
Fig.5 The electroporesis of TGF-β1 and smad2/3 protein expressions in lung tissues of mice in three groups图5 3组小鼠肺组织中TGF-β1和Smad2/3蛋白表达电泳图
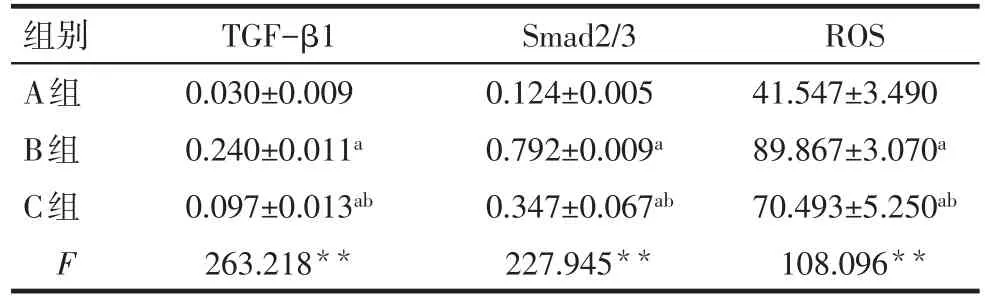
Tab.2 Comparison of TGF-β1,Smad2/3 and ROS expressions between three groups表2 3组TGF-β1、Smad2/3及ROS表达比较 (n=3,x±s)
3 讨论
1,25-(OH)2D3是体内最重要的维生素D的活性代谢产物,可通过参与先天性免疫过程和适应性免疫过程发挥抗炎、免疫调节等作用[10]。Kim等[11-12]发现,1,25-(OH)2D3可能通过调控RhoA/Rho激酶信号通路、抑制核因子-κB(NF-κB)、TGF-β1/Smads通路调节哮喘等过敏性疾病。1,25-(OH)2D3不仅具有抗炎的作用,也可通过减少ROS生成调控氧化应激水平,从而达到抗氧化作用[13]。但目前1,25-(OH)2D3对于哮喘小鼠通过TGF-β1/(Smad2/3)调节ROS的机制少有报道。
本研究结果显示,与哮喘组比较,给予1,25-(OH)2D3治疗后气道炎性细胞及管腔分泌物明显减少,气道上皮结构相对完整,胶原纤维沉积减少,ROS免疫荧光强度降低,TGF-β1及Smad2/3表达减少,提示1,25-(OH)2D3可改善支气管哮喘气道炎症、气道重塑及氧化应激水平。TGF-β1/Smads通路是哮喘发病机制中主要的信号转导通路,在哮喘气道重塑中起关键作用,可通过调节细胞的增殖、分化、凋亡、纤维化等,影响胶原沉积及纤维化的形成,增加小气道狭窄[14-15]。本研究结果显示,哮喘状态下小鼠的TGF-β1和Smad2/3表达明显增加,而1,25-(OH)2D3治疗后,TGF-β1和Smad2/3的表达减少,提示1,25-(OH)2D3能在一定程度上抑制TGF-β1和Smad2/3的表达,表明1,25-(OH)2D3调控哮喘气道重塑的机制可能是通过抑制TGF-β1/(Smad2/3)通路实现的。氧化应激参与哮喘发生发展过程,而ROS可直接作用并破坏细胞,导致细胞功能障碍或细胞死亡等,促进炎症反应,并且进一步促进气道高反应、黏液高分泌及纤维化[16]。另外本研究显示,哮喘状态下小鼠的ROS表达明显增加,而1,25-(OH)2D3治疗后,ROS的表达减少,提示1,25-(OH)2D3能在一定程度上抑制ROS的表达,表明1,25-(OH)2D3可能通过抑制ROS的表达从而抑制氧化应激反应。Demir等[17]也证实,1,25-(OH)2D3可以抑制ROS的表达,从而抑制氧化应激反应。
TGF-β1参与包括哮喘在内的多种气道慢性炎症疾病,可通过多种机制促进哮喘气道重塑,其中包括刺激肺泡上皮细胞、内皮细胞等合成ROS[18]。ROS是诱导纤维化的重要介质,能够促进胶原蛋白的合成,是TGF-β1和Smad2/3作用于纤维化的细胞内信号转导介质,其能够通过激活TGF-β1/(Smad2/3)通路,从而进一步促进气道重塑[19]。本研究结果显示,哮喘状态下小鼠TGF-β1和ROS表达均明显升高,这与Tyagi等[20]研究结果一致,提示TGF-β1可刺激细胞产生ROS,促进氧化应激反应,加速纤维化进程,考虑原因可能为TGF-β1能够通过上调尼克酰胺腺嘌呤二核苷酸磷酸氧化酶4(NOX4)的活性,增强细胞内ROS的合成,促进氧化应激反应,使气道反应性升高,黏液分泌增高,血管通透性增加,进而加速器官纤维化,促进气道重塑[21]。而1,25-(OH)2D3治疗后,TGF-β1和ROS的表达减少,提示1,25-(OH)2D3能够在一定程度上抑制TGF-β1和ROS的表达,表明1,25-(OH)2D3可能通过抑制TGF-β1的表达,从而下调ROS,达到抑制哮喘气道重塑及氧化应激水平的作用。
综上所述,1,25-(OH)2D3可以抑制哮喘气道重塑及氧化应激水平。同时,1,25-(OH)2D3可能通过抑制TGF-β1/(Smad2/3)的表达,从而减少ROS水平,达到调节小鼠气道重塑及氧化应激的作用。但相关机制尚未完全明确,还需进一步完善实验明确具体机制。
(图1~4见插页)
