β-葡聚糖酶对人工湿地反应器中胞外多糖的酶解研究
2020-05-08岳菲菲倪利晓王逸飞刘烜瑜
岳菲菲,倪利晓,2,王逸飞,王 娜,刘烜瑜
(1.河海大学 环境学院,江苏 南京 210098;2.河海大学 浅水湖泊综合治理与资源开发教育部重点实验室,
江苏 南京 210098)
0 引言
人工湿地发挥净化作用的三大要素即微生物、水生植物和基质[1],其中湿地微生物是湿地内部物质转化的主要驱动者,湿地系统的除污能力在一定程度上取决于微生物的种群结构及其多样性。生物膜大量繁殖,微生物自身在基质孔隙中彼此团聚、架接。同时其自身分泌的胞外物质不断在基质表面包裹,形成致密不透水层[2]。这些胞外聚合物也极有可能与其他物质发生络合作用,降低人工湿地系统的基质孔隙度,造成水力传导系数的显著下降[3-5]。在微生物生长代谢行为中,胞外聚合物主要来源于微生物分泌、细胞表面物质的脱落、细胞溶解以及微生物对周围物质的吸附。胞外聚合物中的有机组分占比80% ~90%,以多糖、蛋白质、核酸为主[6-7]。人工湿地基质中提取所得胞外多糖分子由β-糖苷键所连接的单糖残基所组成,是由O-H,C-H,O-H,C-O-C及=CH 等多种官能团(对不同离子表现强烈亲和性)组成的复杂高分子,其分子内部及分子间存在大量氢键,使其分子间具有较为强烈的作用力。ZHAO Lei-hong 等[8]认为胞外聚合物可以通过其表面负电性影响静电反应和氢键等反应,对污泥性质产生重要影响。β-葡聚糖酶主要来源于微生物[9],是一类能特异作用于β-葡聚糖,降解β-1,3-糖苷键、β-1,4-糖苷键的水解酶,可使多糖改性增溶,具体表现为粘性和亲水性丧失[5,10]。本实验通过研究β-葡聚糖酶对人工湿地反应器中胞外多糖的酶解的影响,尝试通过降低胞外多糖的积累量,从而切断人工湿地填料堵塞的一个重要环节,为缓解人工湿地堵塞状况提供新思路。
1 材料与方法
1.1 试验装置
设置圆形单元垂直流人工湿地反应器。其由高度100 cm,内径45 cm 的均质塑料桶加工而成。桶底为集水区,填充层由下至上分别为: ①厚度为5 cm 的砾石(粒度为d50=15 mm);②厚度为60 cm 的粗砂(粒度为d10=0.5 mm,d50=2 mm,不均匀系数Cu=4.2)。3 组PVC 取样管(带阀门)垂直设置在反应器侧壁(距填料层顶端距离分别为5 cm/25 cm/45 cm)。湿地植物选用香蒲,栽种密度为10 株/m2。实验进水经由反应器顶部的穿孔布水管均匀分配进入湿地基质层。桶底设置出水口,由竖直带阀PVC 管(高度=60 cm)进行系统的水位控制。
1.2 基质取样点的设置
实验所需的基质样品通过柱状土壤采样器采集,所得样品用于胞外多糖含量测定。采样点分别位于以表面基质中心及中心距反应器侧壁中点处为起点垂直深入基质层内部10,30 及50 cm 处。为了使同一横剖面上所采取的样品能够反应其真实的胞外多糖含量,故以反应器中点为圆心的同心圆法采取所需样品,半径分别为反应器半径的1/2 及1/4,取样点位于圆心及圆周与经过圆心的2 条相互垂直的轴线的交点处,并以所采取样品的平均值表征胞外多糖含量。
1.3 检测指标及测定方法
1.3.1 胞外多糖的提取、纯化
量取0.5 g 基质颗粒样品,采取水浴加热法从基质颗粒表面提取胞外多糖[11]。采用Sevga 法[12]去除胞外多糖浓缩液中的蛋白质。得到脱蛋白粗多糖提取物后,经洗脱后,收集洗脱液以苯酚-硫酸法[11]测定吸光度,合并洗脱液移入截留相对分子质量为3 500的透析袋中流水透析48 h 后于-50 ℃下冷冻干燥,得到精制多糖,储存于聚乙烯塑料品种待后续实验使用。
1.3.2 还原糖测定
还原糖含量采取3,5-二硝基水杨酸比色法(DNS 法)[13]测定。
1.3.3 酶解影响因素的实验研究及条件优化
β-葡聚糖酶购自Aladdin Industrial Corporation。
(1)底物浓度对β-葡聚糖酶降解作用的影响
向各试管中依次加入0.5 mL 质量浓度分别为0.2,0.8,1.0,1.5,2.0,2.4,2.8,3.2,3.6,4.0 mg/mL 的糖溶液,预热至50 ℃,加稀释后酶液0.1 mL,pH 值为中性的缓冲液0.4 mL,50 ℃水浴10 min,用DNS中止反应,煮沸5 min;同时设置空白对照组,反应结束后于540nm 下测定吸光度值(即光密度值OD540),计算还原性糖质量浓度[14]。
(2)酶质量浓度对β-葡聚糖酶降解作用的影响加入0.5 mL 一定质量浓度的糖溶液,预热后依次加入0.1 mL 质量浓度分别为0.2,0.4,0.6,0.8,1.0,1.2,1.4,1.6,1.8,2.0 mg/mL 的β-葡聚糖酶溶液,其余反应条件同(1)所述,计算还原性糖质量浓度。
(3)pH 值对β-葡聚糖酶降解作用的影响
加入0.5 mL 一定质量浓度的糖溶液,预热后加入稀释后的酶液0.1 mL,向各个试管中依次加入0.4 mL pH 值 分 别 为3,3.5,4,4.5,5,5.5,6,6.5,7,7.5,8 的缓冲液,其余反应条件同(1)所述,计算还原性糖质量浓度。
(4)温度对β-葡聚糖酶降解作用的影响
加入0.5 mL 一定质量浓度的糖溶液,预热后加入稀释后的酶液0.1 mL,加入pH 值为中性的缓冲液0.4 mL,分别在温度为25,30,35,40,45,50,55,60,65,70,75 ℃下反应,反应条件同(1)所述,计算还原性糖质量浓度。
(5)酶解时间对β-葡聚糖酶降解作用的影响
取一定质量浓度的酶液和糖溶液在固定条件下(糖质量浓度为2.8mg/mL,酶液质量浓度为1.2mg/mL,反应温度为50 ℃,体系初始pH 值为5.5)反应1,10,20,30,40,50,60,90 min,计算还原性糖质量浓度。
(6)β-葡聚糖酶酶解的条件优化
为了使反应条件达到最佳,得到最高的还原性糖得率,在以上单因素实验的基础上,以底物中糖质量浓度(A)(mg/mL)、酶质量浓度(B)(mg/mL)、温度(C)(℃)、pH 值(D)(无量纲)为实验因素,进行4 因素3水平的正交试验:①实验因素与因素水平见表1;②此处有4 个3 水平因素,可以选用L9(34)或L27(313)正交实验表;因本实验仅考察4 个因素对还原糖得率的作用情况,对因素间的交互作用不进行考察,故宜选用L9(34)正交实验表;③实验此处不考察因素间的交互作用,可将A,B,C,D 依次安排在L9(34)的第1,2,3,4 列上;④实验方案见表2。

表1 实验因素水平

表2 实验方案
2 结果与讨论
2.1 底物质量浓度对β-葡聚糖酶降解胞外多糖作用的影响
胞外多糖在β-葡聚糖酶的作用下,β-1,3-糖苷键和β-1,4-糖苷键断裂,水解为寡糖或还原性糖,见图1。从图1 中可知,实验开始随底物质量浓度增加,还原糖得率不断增加;当还原性糖质量分数增加至63.33%时,底物质量浓度再继续增加,还原性糖质量分数呈现下降趋势。据此判断最适底物质量浓度范围为2.4 ~3.2 mg/mL,此段还原性糖质量分数较高;2.8 mg/mL 为最适底物质量浓度,此时还原性糖质量分数达到最高值。还原糖得率呈现先升后降的趋势主要可能因为底物质量浓度增大的同时,反应体系的黏度也在增大,影响了底物与酶的接触,另一方面是因为酶量一定时,底物浓度达到饱和。

图1 糖质量浓度对还原性糖得率的影响
2.2 酶质量浓度对β-葡聚糖酶降解胞外多糖的影响
酶质量浓度对酶解产物还原性糖得率的影响见图2。从图2 中可知,实验开始时,酶质量浓度相对较小,底物相对充足,随β-葡聚糖酶质量浓度的增加,还原糖得率迅速上升;而当酶质量浓度增加到一定程度时,酶分子几近饱和,此时还原糖得率不再增加。最适酶质量浓度范围为0.8 ~1.6 mg/mL,此时还原性糖质量分数呈增加趋势且增长趋势逐缓。酶质量浓度在1.2 ~1.6 mg/mL 范围内时,还原性糖质量分数增长幅度极小,且在酶质量浓度达到1.6 mg/mL以后,还原性糖质量分数的增长幅度几乎为0,综合考虑酶质量浓度为1.2 mg/mL 时最为合适。

图2 酶质量浓度对酶解产物还原性糖得率的影响
从理论上解释,保持反应体系中其他成分不变,随着β-葡聚糖酶质量浓度增加,其与底物多糖接触机会同步提升,更多的大分子的葡聚糖被水解成小分子低聚糖,而小分子低聚糖粘度小,填料间粘滞作用减弱,湿地的孔隙率和水力停留时间也会分别随之增大和减小但当酶浓度增加至一定水平,酶分子逐渐被饱和,水解速度就会变缓。
2.3 pH 值对β-葡聚糖酶降解胞外多糖的影响
pH 值对β-葡聚糖酶降解胞外多糖的影响见图3。由图3 可知,pH 值范围在5 ~6.5 时,还原性糖质量分数较高,pH 值为5.5 时,还原性糖质量分数达到最大值45.21%,此时为最适pH 值。还原糖得率出现先升后降的趋势且两端还原糖得率极低的情况主要是由于pH 值低于或超过酶活性范围时,酶的空间结构发生一定程度改变,引起酶的活性降低。
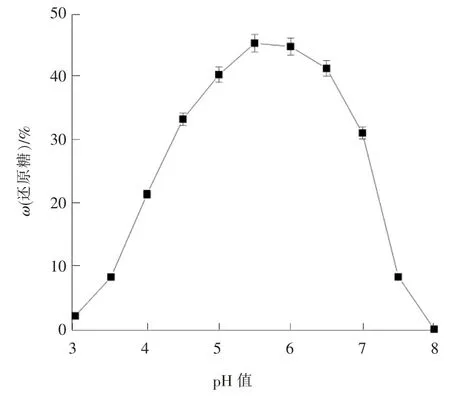
图3 pH 值对酶解产物还原性糖得率的影响
对酸碱的敏感性是酶的生物学特性之一,环境pH 值的变化能够被酶快速响应,活性和稳定性随之受到影响。pH 值对酶的活性的显著影响主要通过改变酶的肽链构象、氨基酸残基微环境造成,同一种酶在不同的pH 值下所表现的活性会产生差异,超出最适范围都将影响酶活性。
2.4 温度对β-葡聚糖酶降解胞外多糖的影响
温度对β-葡聚糖酶降解胞外多糖的影响见图4。

图4 温度对酶解产物还原性糖得率的影响
从图4 中可知,温度范围为45 ~55 ℃时,还原性糖质量分数较高;温度为50 ℃时,还原性糖质量分数达到最大值47.52%,此时温度为最适值。实验开始随温度增加,还原性糖质量分数增大,表示此段随温度的升高,酶活性同步增加。但当体系上升到一定温度,超过酶的最适活性范围时,就会对酶有破坏作用,造成酶的活性减小,还原性糖质量分数降低。
温度对酶的活性影响[15]主要体现在:温度的变化会直接影响酶蛋白活化分子的数目。低温时,酶蛋白活化分子数目少,反应速度维持在较低水平;随着温度升高,酶促反应加快;相应地,酶蛋白的变性速度加快,直至温度上升至某一点后,在酶蛋白的热变性作用下,酶蛋白活化分子数会急剧减少,反应速度会迅速下降。
2.5 酶解时间对β-葡聚糖酶降解胞外多糖的影响
酶解时间对β-葡聚糖酶降解胞外多糖的影响见图5。由图5 可知,不同水解时间对还原性糖质量分数的有一定影响,反应时间1 min 时,由于时间太短,底物与酶接触不充分,反应不完全,还原性糖质量分数较小,后随着时间的增加还原性糖质量分数增加。反应至10 min 时,还原性糖质量分数趋于稳定,自此以后随时间的延长,还原性糖质量分数基本保持不变。

图5 酶解时间对酶解产物还原性糖得率的影响
2.6 β-葡聚糖酶酶解胞外多糖的条件优化
为了探究最佳反应条件,理清各因素间的主次顺序,便于在实际条件下选择合适的时机进行酶解。在以上单因素实验的基础上,以底物中糖质量浓度、酶质量浓度、温度和pH 值为实验因素,进行4 因素3 水平正交试验,正交实验结果及极差分析见表3,实验结果的方差分析见表4。

表3 正交实验结果及分析
由于F0.05(2,2)= 19.00,F0.01(2,2)= 99.00,从表4中可以看出,底物中糖质量浓度的各水平间的差异极显著,pH 值影响不显著,酶质量浓度和温度各水平间的差异显著,相比而言酶质量浓度略强。F 检验法要求选取Se,且希望fe 要大,故在安排实验时,适当留出些空列会较好。综合各因素对还原性糖质量分数的影响,最优组合为A1B3C3D1,即反应体系中糖质量浓度为2.4 mg/mL,酶质量浓度为1.4 mg/mL,反应温度为55 ℃,体系pH 值为6 时,还原性糖质量分数最高达到75.02%。

表4 方差分析
3 结论
(1)随底物多糖浓度增加,还原糖得率趋势呈先升后降,在底物多糖质量浓度为2.8 mg/mL 时,还原糖得率上升至最高63.33%;实验最初,β-葡聚糖酶质量浓度不断增加,还原糖得率相应不断增加。当酶质量浓度增加至0.8 mg/mL 时,还原糖得率的增长趋势变缓,至酶质量浓度为1.2 mg/mL 时,还原糖得率达到最高65.15%。酶质量浓度在1.2 ~1.6 mg/mL范围内,还原糖得率基本趋于平稳。
(2)pH 值、温度和酶解时间对酶解效果的影响相对底物浓度和酶质量浓度较低,这3 者中温度影响作用最大。温度在45 ~55 ℃之间时,还原性糖质量分数较高,皆高于42%,还原性糖质量分数在温度为50 ℃时,达到最大值47.52%;pH 值的最适范围在5.0 ~6.5,超出此范围时,酶解后还原糖得率都较低,低于3.5 和高于7.5 的时候,还原糖得率极低;实验开始10 min 之内,还原糖得率持续升高至70%左右,10 min 后,还原糖得率维持稳定,基本不再发生变化。所以理论上酶解在温度为45 ~55 ℃,pH 值介于5.0 ~6.5 间,持续反应时间10 min 以上,酶解效果最好。
(3)各水平间的差异显著性较好的因素有底物中糖质量浓度、酶质量浓度、温度。其中底物中糖质量浓度的各水平间的差异极显著,酶质量浓度次之,温度各水平间的差异显著性最低;根据显著性分析,实际选择合适投加时间时可依上述顺序做选择,主要依据胞外多糖的累积量,其次为温度。
