lncRNA HSD52在卵巢癌组织中的表达及其对卵巢癌细胞增殖和侵袭的影响
2020-05-08张瑜吴美琴涂红勤张清曾友玲
张瑜 吴美琴 涂红勤 张清 曾友玲
华中科技大学同济医学院附属武汉儿童医院(武汉市妇幼保健院)妇科(武汉433016)
卵巢癌是妇科最常见的恶性肿瘤之一,具有发病率高、病死率高的特点,近年来有年轻化的趋势[1]。目前卵巢癌仍缺乏早期有效的诊断方法,多数患者就诊时已处于晚期,因而预后较差[2]。卵巢癌的发生、发展是一个复杂的过程,包括原癌基因的激活、抑癌基因失活等多种分子改变。长链非编码RNA(long-chain non-coding RNA,lncRNA)是近些年新发现的生物体内长度超过200 个核苷酸的非编码RNA 分子,通过转录激活、染色质修饰、核内运输、转录干扰等多种方式调控基因的表达[3-4]。有研究[5-7]表明,lncRNA 与人类各种肿瘤的发生、发展关系密切,在肿瘤如非小细胞肺癌、宫颈癌、甲状腺癌、胃癌等中均存在异常表达的lncRNA,其表达量与肿瘤的大小、临床分期、预后显著相关。越来越多的lncRNA 被发现参与卵巢癌细胞的增殖、迁移、侵袭、凋亡、衰老等生物过程,更多的lncRNA 有待探索[8-9]。本研究首先通过检测多个尚未报道研究的lncRNA 在卵巢癌组织和癌旁组织中的表达,结果表明lncRNA HSD52在卵巢癌组织中的表达明显降低,其表达可能与卵巢癌的发生、发展有关,因而lncRNA HSD52 在卵巢癌中的作用机制研究可能具有重要意义。本研究旨在检测lncRNA HSD52 在卵巢癌组织和细胞株中的表达,观察其对卵巢癌细胞生物学功能的影响,初步探讨其分子作用机制。
1 资料与方法
1.1 一般资料收集2018年2月至2019年5月本院妇科73例卵巢癌根治性手术切除的癌组织和癌旁组织,术后立即于液氮中冷冻保存。所有标本均经本院两名以上病理科专家确诊。患者年龄36 ~69 岁,平均(46.76 ± 9.52)岁。病理分型:浆液性癌41例,黏液性癌13例,子宫内膜样癌10例;临床分期:Ⅰ期12例,Ⅱ期25例,Ⅲ期36例。所有患者术前均未行放化疗,本研究经本院伦理委员会同意,患者均签署知情同意书。
1.2 细胞与主要试剂载有lncRNA HSD52 序列的质粒和阴性对照质粒购自上海吉凯公司。正常卵巢上皮细胞(IOSE80)和卵巢癌细胞株(OC3、A2780、OVCAR-3、HO-8910、SKOV-3)购自中国医学科学院基础医学研究所细胞资源中心。Matrigel基质胶购自美国BD 公司。RPMI 1640 培养基、DMEM 培养基和胎牛血清购自美国Gibco 公司。Transwell 小室购自美国康宁公司。转染试剂LipofectamineTM3000 购自美国Invitrogen 公司。噻唑蓝(methyl thiazol tetrazolium,MTT)试剂盒和二甲基亚砜购自南京凯基生物科技发展有限公司。荧光实时定量PCR(qRT-PCR)试剂盒购自大连宝生物工程有限公司。ECL 显影液购自美国Thermo 公司。一抗(EDN3、α-Tubulin、p-ERK、AP-1、c-fos 和c-Jun)和二抗购自美国Abcam 公司。
1.3 细胞培养和质粒转染IOSE80、A2780、HO-8910、SKOV-3 接种于含10%胎牛血清的DMEM 培养基,OC3、OVCAR-3 接种于含10%胎牛血清的RPMI-1640 培养基,于37 ℃、5%CO2湿润培养箱中培养。将对数生长期的SKOV-3 细胞接种于6 孔板,待细胞密度达到30%时,采用LipofectamineTM3000 转染试剂将载有lncRNA HSD52 序列的质粒和阴性对照质粒分别转染至SKOV-3 细胞,分别命名为实验组和对照组,严格按照试剂盒说明书进行操作。转染细胞6 h 后,更换新鲜培养基培养基。
1.4 RNA提取和荧光实时定量PCR(qRT-PCR)应用TRIzol 提取卵巢癌组织或细胞株的总RNA,检测RNA 浓度和纯度后,以RNA 为模板逆转录为cDNA。以GAPDH 为内参检测lncRNA HSD52 和EDN3 mRNA 的表达,以U6 为内参检测miR-498-5p的表达。GAPDH 上游引物为5′-ACAACTTTGGTATCGTGGAAGG-3′,下游引物为5′-GCCATCACGCCACAGTTTC-3′;lncRNA HSD52 上游引物为5′-TGCCCTGGAAGGGACTAGA-3′,下游引物为5′-TTGCAAATGCTGTCCACTTG-3′;EDN3 上游引物为5′-ATTGCCACCTGGACATCATT-3′,下游引物为5′-GCAGGCCTTGTCATATCTCC-3′;miR-498-5p 上游引物为5′-GGGAAAGTTCGGTCCC-3′,下游引物为5′-CAGTGCGTGTCGTGGAGT-3′;U6 上游引物为5′-CTCGCTTCGGCAGCACA-3′,下游引物为5′-AACGCTTCACGAATTTGCGT-3′。qRT-PCR 反应参数为94 ℃预变性10 min,62 ℃30 s,72 ℃30 s,40个循环。获得的数据运用2-ΔΔCt方法计算表达量。
1.5 MTT 法检测SKOV-3 细胞增殖能力将对照组和实验组SKOV-3 细胞分别接种于96 孔板,每孔200 μL,细胞密度为1×104个/mL。分别于接种后第1、2、3、4、5 天,每孔加入20 μL MTT 试剂(浓度为5 g/L),继续培养4 h 后,弃去上清,每孔加入150 μL 二甲基亚砜,摇床振荡25 min。酶标仪测定每孔在450 nm 波长处的光密度(OD)值。每个时间点设4 个复孔,实验重复4 次。
1.6 Matrigel 侵袭实验检测SKOV-3 细胞侵袭能力应用Matrigel 胶包被Transwell 上室的微孔膜。将对照组和实验组SKOV-3 细胞采用无血清培养基重悬后,分别接种于Transwell 上室,每孔200 μL,细胞密度为5 × 104个/mL。下室加入含10%FBS 的DMEM 培养基600 μL。培养24 h 后,用棉签轻轻擦去微孔膜上室面细胞。多聚甲醛室温下固定30 min,PBS 溶液洗3 次。0.1%结晶紫染液室温下染色30 min,PBS 溶液洗3 次。室温下晾干后,在高倍显微镜下随机选取4 个视野记穿膜细胞数,拍照并统计。实验重复4 次。
1.7 生物信息学软件预测lncRNA HSD52 的作用机制 应用LncBase Predicted v.2 软件预测lncRNA HSD52 配对结合的miRNA,应用miRanda 软件预测miRNA 配对结合的基因。
1.8 Western Blot实验检测EDN3蛋白的表达收集处于对数生长期的两组SKOV-3 细胞,应用细胞裂解液提取各组细胞总蛋白。测定蛋白浓度后,以40μg/孔蛋白质进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,将电泳分离后的蛋白转移到PVDF 膜上。应用5%脱脂牛奶在室温下封闭PVDF 膜2 h,孵育一抗EDN3(1∶1 000 稀释)、p-ERK(1∶1 000 稀释)、AP-1(1∶2 000 稀释)、c-fos(1∶2 000)、c-Jun(1∶2 000)及α-Tubulin(1∶1 000),在4 ℃下孵育过夜。次日洗膜后,在室温下孵育二抗2 h,洗膜后应用ECL 显影剂进行显影曝光,α-Tubulin 为蛋白内参。
1.9 统计学方法应用SPSS 21.0 统计软件进行统计学分析,计量资料均采用均数±标准差表示,组间均数比较采用t检验进行分析,P<0.05 为差异有统计学意义。
2 结果
2.1 lncRNA HSD52 在卵巢癌组织和细胞株中均呈低表达qRT-PCR 检测结果显示,lncRNA HSD52 在73例卵巢癌组织和癌旁组织中的表达分别为0.76 ± 0.13 和5.18 ± 0.64。与癌旁组织相比,卵巢癌组织中lncRNA HSD52 的表达明显降低(t=32.87,P<0.01)。qRT-PCR 检测结果显示,lncRNA HSD52 在卵巢癌细胞株(SKOV-3、PC-3、C4-2B、22Rv1、DU-145)和正常卵巢上皮细胞IOSE80中的表达分别为0.69 ± 0.02、0.43 ± 0.02、0.79 ±0.02、0.31 ± 0.03、0.13 ± 0.02 和1.01 ± 0.07。与正常卵巢上皮细胞相比,lncRNA HSD52 在卵巢癌细胞株中的表达量明显降低(P<0.05),其中在SKOV-3 细胞中表达最低(P<0.01),见图1。
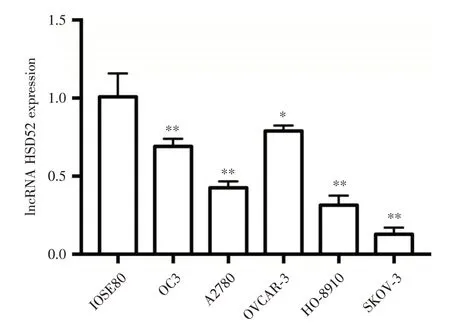
图1 lncRNA HSD52 在卵巢癌细胞株和正常卵巢上皮细胞中的表达Fig.1 Expression level of lncRNA HSD52 in ovarian cancer cell lines and normal ovarian epithelial cell
2.2 转染载有lncRNA HSD52 序列质粒上调SKOV-3 细胞中lncRNA HSD52 的表达转染载有lncRNA HSD52 序列质粒后48 h,qRT-PCR 检测结果显示,实验组和对照组SKOV-3 细胞中lncRNA HSD52表达量分别为10.37±1.58和1.01±0.07。与对照组相比,实验组SKOV-3细胞中lncRNA HSD52的表达明显上调(P<0.01)。
2.3 上调lncRNA HSD52 抑制SKOV-3 细胞的增殖能力MTT 检测结果显示,在接种后第2、3、4、5天,上调lncRNA HSD52 的实验组SKOV-3 细胞OD值明显低于对照组(P<0.05),表明上调lncRNA HSD52 可抑制SKOV-3 细胞的增殖能力,见图2。
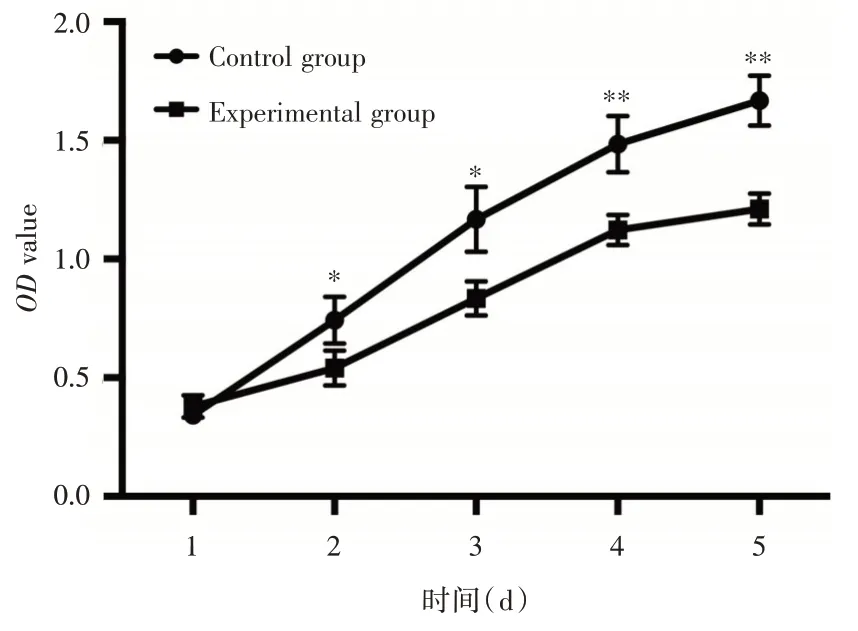
图2 上调lncRNA HSD52 对SKOV-3 细胞增殖能力的影响Fig.2 Effect of overexpression lncRNA HSD52 on the proliferation of SKOV-3 cells
2.4 上调lncRNA HSD52 明显抑制SKOV-3 细胞的侵袭能力Matrigel 侵袭实验结果显示,实验组和对照组SKOV-3 细胞穿过微孔膜的细胞数分别为43.10 ± 7.85 和94.58 ± 9.82,实验组明显低于对照组(P<0.01),表明上调lncRNA HSD52 可抑制SKOV-3 细胞的侵袭能力。见图3。
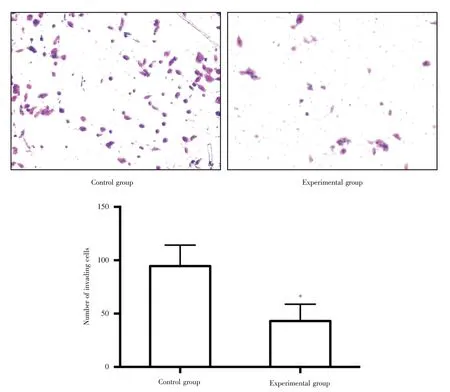
图3 上调lncRNA HSD52 对SKOV-3 细胞侵袭能力的影响(100×)Fig.3 Effect of overexpression lncRNA HSD52 on the invasion of SKOV-3 cells(100×)
2.5 生物信息学软件预测lncRNA HSD52 的分子作用机制应用LncBase Predicted v.2 软件预测显示,lncRNA HSD52 可配对结合miR-498-5p;应用miRanda 软件预测显示,miR-498-5p 可配对结合EDN3 mRNA,见图4。

图4 生物信息学软件预测lncRNA HSD52 作用机制Fig.4 Bioinformatics technology predicts the mechanism of action of lncRNA HSD52
2.6 上调lncRNA HSD52 对SKOV-3 细胞中miR-498-5p 和EDN3 mRNA 表达的影响qRT-PCR 检测结果显示,实验组和对照组SKOV-3 细胞中miR-498-5p 表达分别为0.19 ± 0.05 和1.00 ± 0.03,实验组miR-498-5p 的表达明显低于对照组(P<0.01)。实验组和对照组SKOV-3 细胞中EDN3 mRNA 表达分别为6.32±0.492 和1.01±0.06,实验组EDN3 mRNA 的表达明显高于对照组(P<0.01),表明上调lncRNA HSD52 可降低miR-498-5p的表达,促进EDN3 mRNA 的表达。
2.7 上调lncRNA HSD52 对EDN3 蛋白和ERK 信号通路蛋白表达的影响Western Blot 检测结果显示,上调lncRNA HSD52 后,EDN3 蛋白表达水平增加,ERK 信号通路如p-ERK、AP-1、c-fos 和c-Jun 等多种蛋白的表达明显降低,提示上调lncRNA HSD52 后ERK 信号通路转导被抑制,见图5。
3 讨论

图5 上调lncRNA HSD52 对SKOV-3 细胞EDN3 相关蛋白表达的影响Fig.5 Effect of high-expressed lncRNA HSD52 on the expression of EDN3 protein and related proteins in SKOV-3 cells
卵巢癌是威胁女性健康的最常见肿瘤之一,其异常的增殖和转移能力是影响卵巢癌患者预后的重要因素[10-11]。lncRNA 最初被认为是RNA 聚合酶Ⅱ的副产物,属于基因组转录的“噪音”,不能发挥任何生物学功能[12-13]。越来越多的研究显示,lncRNA 在卵巢癌的发生、发展中发挥重要作用,有望成为卵巢癌诊断和治疗的有效靶点[14-16]。YOU 等[17]研究发现,lncRNA DLX6-AS1 在卵巢癌组织中显著高表达,通过靶向作用于miR-613,促进卵巢癌细胞的迁移和侵袭。SHEN 等[18]通过比较卵巢癌组织和癌旁组织发现,LINC01627 在卵巢癌组织中的表达明显增加,与卵巢癌患者的不良预后关系密切。lncRNA HSD52 是一种由1 094 个核苷酸组成的lncRNA,其对卵巢癌细胞生物学功能的影响并不明确。
本研究发现,与癌旁组织和正常卵巢上皮细胞相比,卵巢癌组织和细胞株中lncRNA HSD52 的表达均明显下降,表明lncRNA HSD52 可能参与卵巢癌的发生、发展。MTT 法和Matrigel 侵袭实验进一步显示,上调lncRNA HSD52 可显著抑制卵巢癌细胞的增殖和侵袭能力,lncRNA HSD52 可能在卵巢癌细胞中发挥抑癌基因作用。lncRNA 发挥基因调控作用的重要分子机制之一是“竞争性内源RNA”,即通过竞争性结合内源性miRNA,干扰miRNA 与其靶基因mRNA 之间的靶向结合,间接促进靶基因mRNA 的翻译[19-21]。lncRNA HSD52 在卵巢癌中的抑癌作用可能依赖于“竞争性内源RNA”机制。通过生物信息学软件预测结果显示,lncRNA HSD52 与miR-498-5p 之间存在结合位点,miR-498-5p 与EDN3 mRNA 之间存在结合位点。有研究表明,miR-498-5p 可明显促进前列腺癌细胞的增殖、迁移和侵袭,降低肿瘤的放疗敏感性,发挥原癌基因作用[22]。EDN3 基因位于染色体20q13,是血管内皮素家族成员之一,主要作用于细胞表面的内皮素受体B[23]。EDN3 蛋白在多种肿瘤中表达下调,其表达水平与患者的总生存期具有相关性[24]。EDN3 蛋白可抑制肿瘤细胞的增殖、转移等生物功能,发挥明显的抑癌基因作用[25]。本研究通过qRT-PCR检测和Western Blot 实验表明,lncRNA HSD52 过表达可降低miR-498-5p的表达,同时促进miR-498-5p 下游靶基因EDN3 的表达。本研究进一步发现,SKOV-3 细胞中EDN3蛋白表达增加后,ERK 信号通路蛋白如p-ERK、AP-1、c-fos 和c-Jun 的表达明显降低,ERK 信号通路转导被抑制,提示EDN3 蛋白可能通过抑制ERK信号通路发挥作用。下一步的研究方向是通过双荧光素酶报告基因实验明确lncRNA HSD52 与miR-498-5p 的靶向结合位点,验证lncRNA HSD52在动物体内对卵巢癌细胞增殖和侵袭的抑制作用。
综上所述,本研究发现lncRNA HSD52 在卵巢癌组织和细胞株中低表达,上调lncRNA HSD52 可抑制卵巢癌细胞的增殖和侵袭能力,其分子作用机制为特异性吸附miR-498-5p 调控EDN3 基因的表达。lncRNA HSD52 的研究可能为卵巢癌诊断和治疗提供新的分子标志物及治疗靶点。
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
