超声波结合聚乙二醇化多西他赛白蛋白纳米粒治疗小鼠乳腺癌模型的研究
2020-05-08陈兰阴美娇权修权金光明
陈兰 阴美娇 权修权 金光明
目前,乳腺癌是中国女性发病率最高的癌症,在癌症死亡原因位居第6[1]。每年中国乳腺癌新发数量和死亡数量分别占全世界的12.2% 和9.6%[2]。一项研究[3]发现,82.1% 的女性发现患乳腺癌时,其症状已经十分明显,近2/3 的患者被诊断为晚期。现阶段乳腺癌的治疗主要为手术辅助化疗,但是,由于化疗药物的一些毒副作用,约12.1%的患者只能接受不到4 个周期的治疗[4],这远远低于国际推荐的最低标准。
本课题组前期研究发现,聚乙二醇(polyethylene glycol,PEG)化多西他赛白蛋白纳米粒(PEGDANPs)可有效地治疗非小细胞肺癌(non-small-cell lung cancer,NSCLC)并具有较小的毒副作用[5-7],但化疗药物在正常组织中仍有分布,导致了抗癌药物靶向性不足[8],因此如何进一步提升药物的靶向性仍是需要继续研究的方向。
研究表明超声波(ultrasound,US)可以促进纳米制剂治疗肿瘤,提升治疗效果[9-10],据此本研究利用超声波结合前期制备的纳米制剂对小鼠的乳腺癌模型进行治疗,旨在进一步提升药物疗效,这也是本研究的最大创新性所在,希望能够为临床治疗乳腺癌提供一种新的思路。
1 材料与方法
1.1 动物和细胞株BALB/c 小鼠(北京维通利华公司);乳腺癌4T1 细胞系(延边大学附属医院中心实验室提供)。实验用BALB/c 小鼠共20 只由北京维通利华实验动物技术有限公司提供,生产许可证编号为SCXK(京)2016-0006,使用许可证编号为SYXK(京)2014-0023,洁净级别SPF 级。在延边大学医院中心试验室SPF 级别动物房饲养(实验单位使用许可证编号:B10011020),所有动物实验设计与操作均遵守延边大学附属医院实验动物管理和保护条例,实验严格遵守伦理3R 原则,伦理审查报告审批号:IACUC-201902022-05。
1.2 仪器与试剂DANPs(自制),PEG-DANPs(自制),胎牛血清、胰蛋白酶、杜尔伯科极限必需培养基(dulbecco minimum essential medium,DMEM)、磷酸缓冲液(hosphate buffered saline,PBS)均购自朗润科技有限公司。NANO DEBEE45-1 乳均机(美国NANO 公司),DZF-200 型真空干燥箱(上海浦东荣丰公司),IKA MS3(英国Malvern 公司),Agilent Tech 1200 系列高效液相色谱、V-999H 型旋转蒸发仪、Spectra Max190 酶标仪(美国Agilent公司),HERA Cell 150 细胞培养箱(美国HERA公司),Thermo micro max 高速离心机(日本Hitachi公司)。
1.3 方法
1.3.1 乳腺癌皮下移植瘤模型建立将Matricgel提前一天放到-4 ℃冰箱中使之变成液体;以胰酶消化4T1细胞,加PBS终止反应,混匀使之形成单细胞悬液,1 500 r/min 条件下离心5 min。将细胞浓度调整为1 × 105个/mL,细胞和Matricgel 1∶1 混合准备注射。BALB/c小鼠20只,分为4组,每组5只,每只在左前腿侧面(腋窝下)注射0.1 mL(约3 ×106个细胞),形成肿瘤皮下模型。
1.3.2 治疗方法将皮下移植瘤模型20只分为4组,当皮下肿瘤体积约达到120 mm3时,以5% 葡萄糖注射液(对照组),DANPs、PEG-DANPs 及US+PEGDANPs 进行治疗,药物剂量为20 mg/kg,每7 天为一疗程,共4 个疗程,超声照射条件为每次30 s,强度为1 MHz。在最后一次给药治疗48 h 后,处死全部小鼠,取瘤块及易转移脏器,10%中性甲醛固定,送检HE 染色切片检测。
1.3.3 给药小鼠瘤块、肺及肝组织病理图半定量分析结合图像分析系统对以下指标进行半定量评分:癌细胞核染色深度、核形态、异型性、癌细胞排列形状、肺泡内癌栓形成状况、肝组织内癌巢形成状况、纤维组织增生情况、组织出血情况、癌细胞变性坏死情况。其中每项指标评分为0 分(正常)~3 分(异常)[11],以图像分析系统软件进行分析。
1.3.4 TUNEL 法检测NSCLC 皮下移植瘤小鼠肿瘤细胞凋亡小鼠处死后,将瘤块进行石蜡切片,分别以二甲苯、梯度乙醇(100%、95%、90%、80%、70%)和PBS 进行脱蜡、水化;加3%H2O2去离子水,室温孵育5 min,封闭切片;擦去多余的PBS,滴加50 μL PBS 配制的Proteinase K,确保覆盖所有细胞,装入湿盒,37 ℃恒温孵育20 min 准备进行Tunel 反应;按试剂盒说明书,配置好标记反应混合物,实验组滴加50 μL Tunel 标记反应混合物,阴性对照组滴入dUTP,代替Tunel 反应混合物,阳性对照组在滴加Tunel 标记反应混合物之前,需先经DNase 处理,避光孵育1 h;每片加50 μL 转化剂POD,放入湿盒,避光反应30 min 进行POD 转化;每片加入新鲜配制的DAB 工作液50 μL,室温下反应,直至镜下可以判断棕色深浅,加入PBS 终止显色,苏木复染几秒后立即冲洗、脱水、封片。
1.4 统计学方法运用统计软件SPSS 19.0进行统计学分析。计量资料的正态性检验采用Kolmogorov-Smirnov 检验,符合正态分布的两组间差异采用独立样本t检验,多组间均值差异采用方差分析检验,两两多重比较采用了Bonferroni 方法;以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠瘤块体积与各种治疗方法的关系DANPs、PEG-DANPs 及US+PEG-DANPs 组均对肿瘤都具有一定的抑制作用,US+PEG-DANPs 抑制肿瘤生长的作用最强。见图1。
2.2 小鼠体质量与各种治疗方法的关系DANPs、PEG-DANPs 及US+PEG-DANPs 组小鼠的体质量均有不同程度的下降,说明3 种疗法在一定程度上都造成了机体损伤,但其中US+PEG-DANPs 的毒性最小(P<0.05)。见图2。
2.3 移植瘤瘤块与各种治疗方法的关系根据乳腺癌瘤块病理(图3)显示:对照组光镜下可见癌细胞核深蓝色、异型性明显,呈腔状或实体状;DANPs组:癌细胞核颜色淡蓝色,仍可见病理性核分裂相;PEG-DANPs 组:可见癌细胞坏死,病理分裂相明显减少;US+PEG-DANPs 组:癌细胞核呈红色,癌细胞大片状坏死。提示US+PEG-DANPs 抑制乳腺癌移植瘤效果最佳。

图1 各组药物及制剂治疗乳腺癌小鼠瘤体体积变化Fig.1 Changes of tumor volume in mice with breast cancer treated by drugs and preparations in each group
2.4 肺组织病理与各种治疗方法的关系乳腺癌模型的肺组织病理图(图4),对照组肺泡内可见巨大的癌栓,癌细胞异型性明显;DANPs 组:肺泡内癌栓,较对照组明显变小;PEG-DANPs 组:该组肺泡内无癌栓,细胞核染色明显变淡;US+EG-DANPs组:肺泡内仅可见纤维组织广泛增生。提示US+PEG-DANPs 能够更好地抑制乳腺癌细胞肺转移。
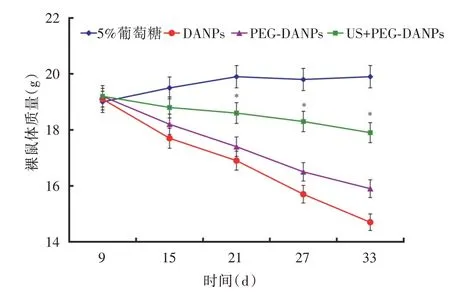
图2 各组药物及制剂治疗乳腺癌小鼠体质量变化Fig.2 Weight changes of mice in each group treated with drugs and preparations
2.5 肝组织病理与各种治疗方法的关系乳腺癌模型的肝组织病理图(图5),对照组可见肝组织内存在癌巢,形态巨大,癌细胞核深染、变形,异型性显著;DANPs 组:肝组织内仍可见多处癌巢,但癌巢体积减小;PEG-DANPs 组:癌巢明显缩小,可见少量病理性核分裂相;US+PEG-DANPs 组:该组肝组织细胞核趋近于正常的红色,无明显核分裂相。提示US+PEG-DANPs 组具有良好的抑制乳腺癌细胞肝转移的作用。
2.6 小鼠肺组织和肝组织病理图半定量分析从给药小鼠肺、肝组织上各随机选取15 个切面,按照评分标准结合图像分析系统进行半定量评分,结果显示,US+PEG-DANPs 组病理评分值为(27.38± 5.55),与其他组相比,差异有明显统计学意义(r= 0.527,P<0.05),提示US+ PEG-DANPs 抗瘤、抗转移疗效更好(表1)。

图3 小鼠乳腺癌皮下移植瘤镜下病理图(HE 染色,×500)Fig.3 Microscopical pathology of subcutaneous transplantation of mouse breast cancer
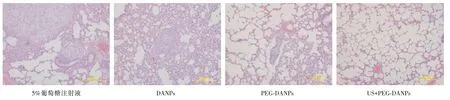
图4 小鼠乳腺癌肺转移镜下病理图(HE 染色,×500)Fig.4 Histopathology of lung metastasis in mice with breast cancer
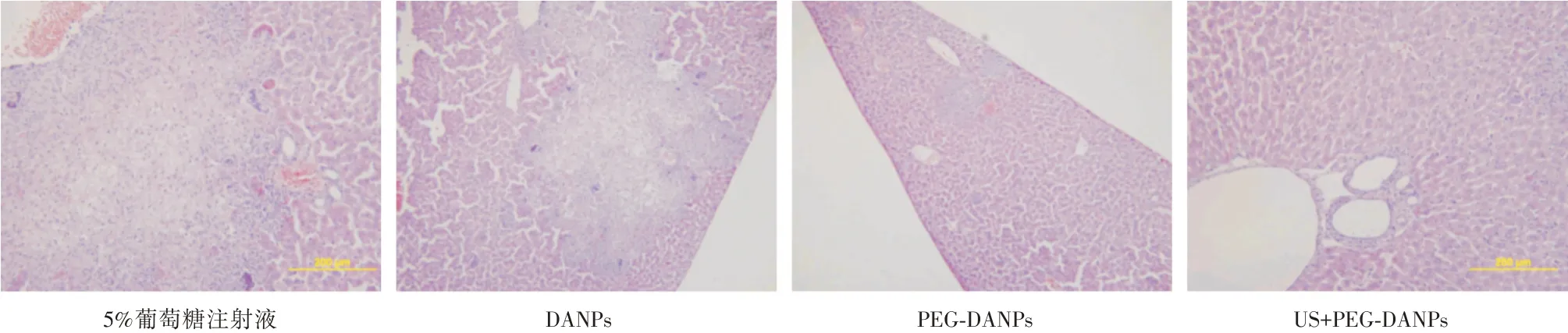
图5 小鼠乳腺癌肝转移镜下病理图(HE 染色,×500)Fig.5 Histopathology of liver metastasis of mouse breast cancer
表1 小鼠乳腺癌模型瘤块、肺、肝组织病理评分比较Tab.1 Comparison of pathological scores of tumor mass,lung and liver in mice breast cancer model ±s

表1 小鼠乳腺癌模型瘤块、肺、肝组织病理评分比较Tab.1 Comparison of pathological scores of tumor mass,lung and liver in mice breast cancer model ±s
注:*P <0.05
组别对照组DANPs PEG-DANPs US+PEG-DANPs瘤块切面例数15 15 15 15肺切面例数15 15 15 15肝切面例数15 15 15 15病理评分65.10±9.85 45.15±10.66 34.65±7.97 27.38±5.55*
2.7 TUNEL 法检测小鼠皮下移植瘤肿瘤细胞凋亡情况光镜下观察发现,对照组几乎不存在凋亡细胞(细胞核显棕黄色),细胞呈蓝色且排列紧密;DANPs 组细胞体积较对照缩小,排列较紧密;PEG-DANPs 组细胞体积进一步缩小,排列疏松,呈淡染的棕色;US+PEG-DANPs 组视野内可见大量凋亡细胞,其体积缩小、排列疏松,染色质浓缩,呈显著的棕黄色,偶可见凋亡小体的存在,差异有统计学意义(P<0.05)。结果如图6。
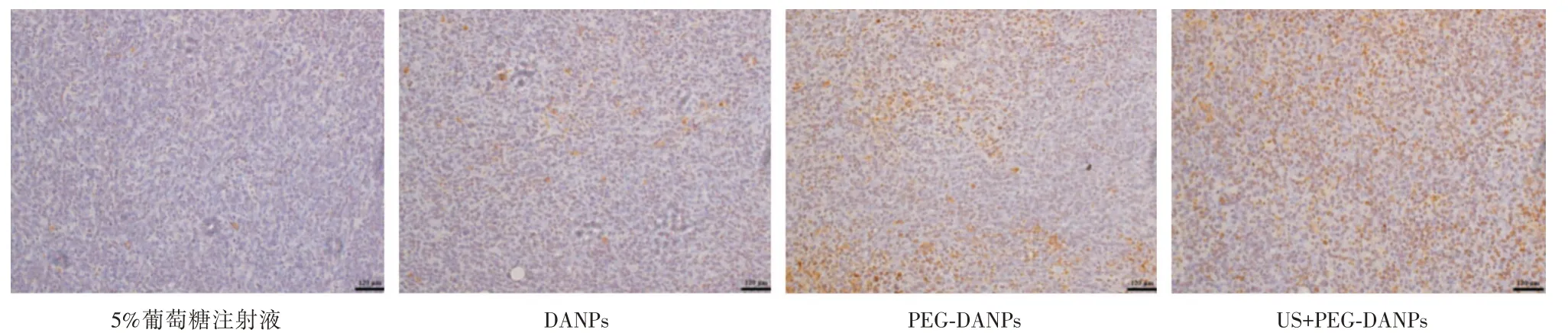
图6 TUNEL 法检测不同治疗方法4T1 细胞凋亡(HE 染色,×500)Fig.6 Apoptosis of 4T1 cells detected by tunel
3 讨论
本研究使用的PEG-DANPs 避免了被网状内皮系统所吞噬,转变成为了一种类似于“隐形的”纳米粒,再加上其半衰期的明显延长[12],可以长时间在机体内循环,使其到达肿瘤细胞和被肿瘤细胞所吸收的量得到了明显的提升[13]。PEG-DANPs 中的主要药物成分是多西他赛(docetaxel,DTX),当其通过胞吞(clathrin-mediated endocytosis)方式进入癌细胞后[14],可与细胞内游离的微管蛋白相结合,通过破坏微管的网状结构从而抑制肿瘤细胞的增殖生长[15-16];另一方面,其干扰了肿瘤细胞分裂所必需的微管网络系统,导致细胞分裂受阻进而抑制肿瘤细胞[17-18]。
US 可以促进纳米制剂治疗肿瘤,提升治疗效果,其具体原理主要是根据US 的空化及弥散作用来实现的。空化作用是指超声照射肿瘤时,肿瘤血管内的液体在减压作用形成的负压区产生大量真空微气泡,而当转换成增压作用时,这些真空微起气泡受压破裂,瞬间形成超过上千个大气压的冲击力,这种冲击力从物理方面可直接将药物制剂推入癌细胞的分子间隙,从而进入癌细胞内部发挥抗癌作用[19];另一方面,在化学角度上,空化作用可使细胞膜对钾、钙离子的通透性增加,引起细胞膜弥散过程和细胞代谢增快,使药物制剂进入癌细胞的数量更多、速度更快[20]。
本研究发现US 结合药物组在HE 染色中基本没有发现癌巢和癌栓的存在,分析这是由于US 另外一个重要作用引起的,即弥散作用[21]。在本实验中使用的高频探头所产生的超声波是以直线传播的,其声束是以探头为底而向组织深处延伸的圆柱体,因此它可以有效地照射肿物而不是向周边正常的组织扩散,因此对周边正常组织的损害也会更加减少。对于在肺泡中的癌栓,肝组织中的癌巢这些深处的病灶来说,超声波能够通过改善肿瘤血液和淋巴液循环,提升新陈代谢,来促进药物制剂导入到这些深层结构中[22]。这也是本课题组前期研究及国外其他学者的研究中没有做到的[6-7,23],通过本研究的结果,证实了US 对抗癌纳米制剂的促进作用。另外,由超声波照射附带产生的热作用也可以使肿物组织局部血液循环加快,新陈代谢加速,提升癌细胞对抗癌药物的吸收[24]。有学者利用超声波结合化疗药物纳米制剂对其他一些肿瘤进行了辅助治疗,取得了较为满意的效果[25],这也进一步对本研究进行了佐证。
综上所述,以US 照射结合PEG-DANPs 对乳腺癌的治疗方式,可以为无法接受手术的晚期乳腺癌患者提供一种新的选择。然而,有关于超声照射最佳的频率及时间仍是需要进一步研究的要点。
